Вагові незалежні механізми контролю глюкози після шлункового шунтування Roux-en-Y
Бландін Лаферрер
1 відділ ендокринології, Нью-Йоркський дослідницький центр з питань ожиріння, Медичний факультет, Коледж лікарів та хірургів Колумбійського університету, Нью-Йорк, Нью-Йорк, США
Франсуа Патту
2 Трансляційні дослідження діабету, UMR 1190, Інсерм, Університет Лілля, Лілль, Франція
3 Ендокринна та метаболічна хірургія, CHU Лілль, Лілль, Франція
Анотація
Шлункове шунтування Roux-en-Y призводить до великої та стійкої втрати ваги та вирішення діабету 2 типу у 60% випадків на 1–2 роки. На додаток до обмеження калорій та зниження ваги, різні механізми, опосередковані шлунково-кишковим трактом, незалежно від втрати ваги, також сприяють контролю глюкози. Анатомічна перебудова тонкої кишки після шлункового шунтування призводить до прискореного транзиту поживних речовин, підсилює вивільнення інкретинів післяпрандіальних гормонів кишечника та інсуліну, змінює метаболізм та ентеропечінковий цикл жовчних кислот, модифікує засвоєння глюкози в кишечнику та метаболізму, а також змінює склад і функції мікробіома. Поліпшення функції бета-клітин після шлункового шунтування у осіб з діабетом 2 типу вимагає ентеростимуляції. Однак функція бета-клітин у відповідь на внутрішньовенний подразник глюкози залишається сильно порушеною, навіть у осіб з повною клінічною ремісією діабету. Постійне порушення бета-клітини може пояснити рецидив діабету через кілька років після операції.
Поширеність тяжкого ожиріння, яке визначається як індекс маси тіла (ІМТ) понад 40 кг/м 2, зростає. Це вражає жінок більше, ніж чоловіків, а афроамериканських жінок (16,9%) більше, ніж кавказьких (9,3%), або іспаномовних (8,9%) жінок (1). Кількість баріатричних операцій, що проводяться щороку в США, зросла лише мінімально за останні кілька років і, за оцінками, становила 216 000 у 2016 році. Отже, лише невеликий відсоток людей, які відповідають критеріям баріатричної хірургії, є найбільш ефективною та довговічною формою схуднення, насправді виграють від цього. Шлунковий шунтування (Roux-en-Y) шлункового шунтування (RYGB) був домінуючим типом хірургічного втручання, що проводився в США до 2011 р. Вертикальна рукавна гастректомія (VSG) зараз є найбільш виконуваною хірургічною операцією і становила 58% усіх баріатричних процедур у 2016 р. (2, 3 ). Однак RYGB - це хірургічна модель, яка була вивчена найбільше для дослідження механізмів роботи кишечника, незалежно від втрати ваги, яка може сприяти післяопераційному контролю глюкози. Крім того, є більше довгострокових даних про клінічну ремісію діабету 2 типу (T2D) після RYGB. Отже, цей огляд буде більш орієнтованим на RYGB.
Об’єднавши дані спостережних досліджень (14) та RTC (15, 28–30), частота ремісії T2D становить близько 60% через 2 роки після RYGB. Механізм, за допомогою якого RYGB призводить до цього надзвичайно високого рівня ремісії діабету, до кінця не з’ясований. Ключове питання полягає в тому, чи повністю залежить ремісія від схуднення чи ні. Якщо це зумовлене зниженням ваги, то дослідження слід зосередити на механізмах, ймовірно, централізовано опосередкованих, за допомогою яких пацієнти їдять менше, втрачають близько 30% загальної маси тіла і здатні утримувати вагу, усі цілі не відповідають дієті та фізичним вправам самостійно (31) або з фармакотерапією (32). Якщо деякі ефекти незалежного зниження ваги мають місце при ремісії діабету, вони, швидше за все, опосередковані кишечником. Однак, хоча RYGB призводить до багатьох змін ендокринних механізмів, опосередкованих кишечником, деякі з яких відіграють роль у контролі глюкози після їжі, їх роль у ремісії діабету не була повністю продемонстрована. Розуміння цих механізмів має вирішальне значення, оскільки це може допомогти визначити нові цілі для лікування СД2.
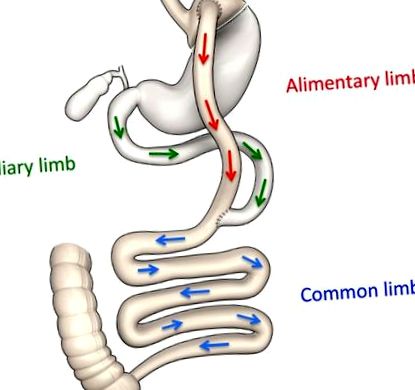
Схематичне зображення анатомічних змін після RYGB.
Механістична модель поліпшення глікемії після RYGB. RYGB покращує метаболізм глюкози за рахунок втрати ваги та за допомогою незалежних від ваги механізмів, включаючи стимуляцію пептидів кишечника, зміну ентерогепатичного циклу жовчних кислот, перебудову шлунково-кишкового тракту та зміну мікробіома. Суцільні лінії: механізми, що базуються на доказах; штрихові лінії: можливі механізми. RYGB, операція шунтування шлунка Roux-en-Y; HGP, вироблення печінкової глюкози; Похідне БА, похідне жовчних кислот; ШКТ, шлунково-кишковий; ШПГ, глюконеогенез; GLP-1, глюкагон-подібний пептид 1; PYY, пептид YY; OXY, оксинтомодулін; GSIS, стимульована глюкозою секреція інсуліну; PPG, глюкоза після їжі; ↑: збільшення; ↓: зменшення.
Роль посиленого ендогенного GLP-1 у контролі секреції інсуліну у відповідь на пероральну глюкозу після RYGB добре продемонстрована; його довгострокові наслідки для ремісії діабету, однак, залишаються незрозумілими (79). Функція бета-клітин, оцінена у відповідь на внутрішньовенний стимул глюкози, покращується лише мінімально і залишається порушеною у осіб із клінічною ремісією діабету та стійкою втратою ваги до 3 років після RYGB (76). Змінення постпрандіальної гіперінсулінемічної гіпоглікемії шляхом введення їжі безпосередньо через гастростому в залишковий шлунок, а не per os, підкреслює відсутність постійного покращення ендокринної функції підшлункової залози через роки після RYGB (80, 81). Тому підвищена секреція інсуліну, пов’язана з їжею, після RYGB залежить швидше від ентеростимуляції, ніж від покращеної реакції бета-клітин на глюкозу (82) або на інкретинові подразники (83). Стійкий дефект функції бета-клітин, подоланий під час їжі, може частково пояснити можливість рецидиву діабету через роки після RYGB у пацієнтів старшого віку, які їдять менш обмежувальну дієту і відновлюють певну вагу.
Таблиця 1
Механізми контролю глікемії після RYGB, VSG та AGB.
| Втрата ваги | +++ | ++ | + |
| Прискорений транзит поживних речовин | + | + | ↔ |
| ↑ GLP-1, PYY, OXY | ++ | +/ - | ↔ |
| Виведення жовчної кислоти | + | - | - |
| Циркулюючий пул жовчних кислот | ↑ | ↑/↔ | ↓/↔ |
| Ремоделювання шлунково-кишкового тракту | + | - | - |
| Мікробіом | + | + | + |
Загалом, результати клінічних досліджень та досліджень на тваринах свідчать про важливу роль зміненого пулу жовчних кислот, їх складу, перенаправлення та передачі сигналів, які можуть сприяти метаболічним ефектам RYGB або VSG (таблиця (табл. 1). 1). Елегантні експерименти з виведенням жовчних кислот та FXR та TGR5 KO пропонують роль просвітніх жовчних кислот у поліпшенні метаболізму після баріатричної хірургії. Клінічний переклад цих даних, проте, досі невловимий. Часова дисоціація між негайним підвищенням GLP-1 та затримкою збільшення циркулюючих жовчних кислот робить менш вірогідною зв'язок цих процесів, принаймні в перші місяці після RYGB. Важлива інформація про концентрацію внутрішньосвітлових жовчних кислот після RYGB (або VSG) у людей відсутня. Склад, а отже, функція жовчних кислот відрізняється у різних видів, і це ускладнює трансляційні дослідження в цій галузі. Нарешті, велика мінливість концентрацій циркулюючих жовчних кислот в дослідженнях на людях (115) вказує на інші механізми, можливо, від дієти та/або мікробіомів, які можуть модулювати їх склад та функції.
Важливою змінною, яку часто не враховують у дослідженнях поперечних розрізів, є зміна в часі багатьох механізмів, описаних вище. Прискорений час проходження поживних речовин та стимульоване вивільнення GLP-1 відбуваються відразу після RYGB і зберігаються з часом. Однак дисперсія відповіді GLP-1 збільшується між 1 місяцем та 3 роками після операції (147). Ми (113) та інші (111) продемонстрували тимчасову зміну пулу циркулюючих жовчних кислот після RYGB. Адаптація кишечника (гіпертрофія, щільність ендокринних клітин, зондування глюкози, СПГ) та мікробіом, швидше за все, зазнають часової трансформації, частково залежно від дієти. Ці дані показують складність фізіології та адаптації кишечника, складність клінічних досліджень та важливість довгострокових довгострокових досліджень для кращого розуміння впливу кишечника на постпрандіальну глікемію, а також на ремісію діабету.
Таким чином, RYGB призводить до ремісії T2DM в результаті великої та стійкої втрати ваги. RYGB також запускає незалежні від ваги шлунково-кишкові механізми, включаючи стимуляцію інкретинів, модуляцію транспорту та метаболізму глюкози в кишечнику, зміну циклу ентеропечінкових жовчних кислот та зміну мікробіому. Ці системи, пов’язані з кишечником, взаємопов’язані, оскільки відведення жовчі погіршує засвоєння глюкози у верхніх відділах кишечника, порушення всмоктування поживних речовин та жовчних кислот можуть стимулювати GLP-1, і мікробіом модулює багато з цих цілей шлунково-кишкового тракту. Описані вище механізми, ймовірно, діятимуть спільно, щоб зі зниженням ваги та обмеженням калорій сприяти контролю рівня глюкози після баріатричної операції (рис. (Рис. 2). 2). Однак потрібно провести більше клінічних досліджень, щоб зрозуміти молекулярні механізми взаємодії цих різних систем для поліпшення метаболізму глюкози та результату ремісії діабету. Відсутність нормалізації функції бета-клітин у відповідь на подразник глюкози внутрішньовенно може бути важливим фактором, що визначає майбутній ризик рецидиву діабету після операції RYGB.
Внески автора
Усі перелічені автори внесли значний, прямий та інтелектуальний внесок у роботу та схвалили її до публікації.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Ми вдячні Капілі Патель за допомогу з форматуванням посилань та рисунків. BL та деякі роботи, на які вона посилається в цьому огляді, були частково підтримані грантом Національного інституту охорони здоров'я (NIH) R01DK067561, P30DK26687-30, P30DK063608, а також частково Національним центром удосконалення поступальних наук, NIH, через номер гранту UL1TR001873. За вміст відповідають виключно автори, і він не обов'язково відображає офіційні погляди NIH. FP підтримала Франкофонська федерація дослідницьких досліджень (FFRD).
- На відміну від обмеження калорій, операція шунтування шлунка Roux-en-Y не збільшує AgRP гіпоталамусу
- Загальна втрата ваги як результат виміру вибору після шлункового шунтування Roux-en-Y - PubMed
- На загальну втрату ваги після лапароскопічного шунтування шлунка Roux-en-Y впливає передопераційна вага
- Які найкращі медичні центри Міні шлункового шунтування в Нижньовартовську, Росія
- Ланцетовий діабет; Ендокринологія Шлунковий шунтування допомагає підліткам, що страждають ожирінням, підтримувати вагу