На відміну від обмеження калорій, операція шлункового шунтування Roux-en-Y не збільшує AgRP і NPY гіпоталамусу у мишей на дієті з високим вмістом жиру.
Прешит П. Паткар
1 Департамент харчових наук, Коледж гуманітарних наук, Техаський технічний університет, Лаббок, Техас 79409, США
Чжен Хао
2 Лабораторія нейробіології харчування, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США
Майкл Б. Мамфрі
2 Лабораторія нейробіології харчування, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США
Р. Лі Таунсенд
2 Лабораторія нейробіології харчування, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США
Ганс-Рудольф Бертуд
2 Лабораторія нейробіології харчування, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США
Ендрю С. Шин
1 Департамент харчових наук, Коледж гуманітарних наук, Техаський технічний університет, Лаббок, Техас 79409, США
Пов’язані дані
Анотація
Завдання:
Дієта часто не вдається, оскільки втрата ваги викликає сильні протирегулятивні біологічні реакції, такі як підвищений голод та гіпометаболізм, які, як вважають, критично залежать від головного датчика палива в медіобазальному гіпоталамусі (MBH). Оскільки було доведено, що тривале голодування збільшує AgRP та NPY, рівень експресії цих двох орексигенних генів був прийнятий як експериментальний показник наявності чи відсутності голоду. Операція шлункового шунтування Roux-en-Y (RYGB) призводить до значної втрати ваги, не викликаючи пов'язаного з цим голоду, вказуючи на можливі зміни нейропептидів гіпоталамусу та/або сигналізації. Нашою метою було оцінити ключові гени MBH, що беруть участь у регуляції маси тіла, апетиту та запального/окисного стресу після операції RYGB у мишей.
Методи:
Повним мишам, які харчувались жирним харчуванням, піддавали або фіктивну операцію, або операцію RYGB, або обмеження калорійності, щоб відповідати вазі групи RYGB. Додатковою контрольною групою служили миші, яких годували чау без операції. Через 2 або 12 тижнів після операції гени гіпоталамусу аналізували за допомогою qPCR у реальному часі.
Результати:
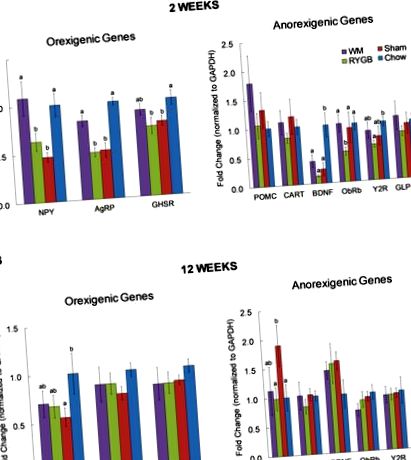
Під час фази швидкої втрати ваги через 2 тижні після операції RYGB експресія гена AgRP та NPY гіпоталамусу не збільшувалась порівняно з мишами з підробленою операцією, що вказує на те, що миші не голодні. Навпаки, однакова втрата ваги, спричинена обмеженням калорій, негайно спричинила збільшення експресії AgRP та NPY. Цей диференціальний ефект RYGB та обмеження калорій більше не спостерігався на етапі збереження ваги через 12 тижнів після операції. Подібний диференційний ефект спостерігався для ObRb, але не для експресії POMC та CART. Крім того, RAGE та IBA-1, два маркери запалення/окисного стресу, були значно пригнічені після RYGB порівняно з обмеженням калорій через 2 тижні після операції.
Висновки:
Ці результати свідчать про те, що RYGB запобігає біологічно адаптаційній реакції голоду, спричиненій недоїданням та втратою ваги, та пригнічує маркери запалення гіпоталамусу, спричинені втратою ваги.
Вступ
Нещодавно ми розробили модель миші хірургічного втручання RYGB, вага тіла та склад якої відображають ті, що спостерігаються у людей з низькою смертністю та частотою ускладнень 10. Метою дослідження було використовувати цю мишачу модель, з додаванням важливої групи, яка відповідає вазі, для проведення всебічного аналізу мРНК ключових генів МБГ, що беруть участь у регуляції апетиту, маси тіла, запалення та окисного стресу при два моменти часу - через 2 тижні після операції під час фази швидкого схуднення та через 12 тижнів після операції, коли вага тіла стабілізується на нижчому рівні.
Матеріали і методи
Тварини
Мишей із ожирінням C57BL6J, спричинених дієтою, було придбано у лабораторіях Джексона у віці 18 тижнів. Після прибуття до Біомедичного дослідницького центру в Пеннінгтоні вони продовжували дотримуватися тієї ж дієти з високим вмістом жиру (60% жиру; 5,21 ккал/г; Дієти досліджень D12492), а також надавали доступ до звичайної чау (13% жиру; 3,36 ккал/г; Purina 5001) протягом 14 тижнів. Тварин утримували у стандартних лабораторних умовах із кімнатною температурою 21–23 ° C та 12-годинним циклом світло-темрява (світло світиться о 07:00), за винятком, деталізованим нижче. Догляд за тваринами та експериментування були схвалені Інституційним комітетом з догляду та використання тварин Пеннінгтонського центру біомедичних досліджень та суворо дотримувались правил та рекомендацій, наданих Американським фізіологічним товариством та NIH.
Експериментальний огляд
Хірургія RYGB
Детальний опис нашої операції миші RYGB можна знайти деінде 11. Коротко, кінцівка Ру з довжиною 5–6 см і біліопанкреатична кінцівка довжиною 6–7 см були створені шляхом розрізання тонкої кишки поблизу зв’язки Трейца і анастомозування дистального кінця вирізаної тонкої кишки до невеликого шлункового мішечка та проксимального кінця з середина тонкої кишки. З великою обережністю було збережено шлункові судини та нерви поблизу кардії. Фіктивна хірургія складалася з лапаротомії середньої лінії та м’якої мобілізації шлунку та кишечника.
Кількісна ПЛР у режимі реального часу (RT)
Використовуються наступні послідовності праймерів: POMC - вперед, AAGAGGTTAAGAGCAGTGA; реверс, ACATCTATGGAGGTCTGAAG; КОШКА - вперед, GCAAGAAGTCCTGAAGAAG; реверс, GTAAAGACCGTGTGTAAGATT; NPY - вперед, CTAGGTAACAAGCGAATGG; реверс, GGTGATGAGATTGATGTAGTG; AgRP - вперед, ACAAGAGACCAGGACATC; реверс, CAACAGCAGAACACAACT; GLP-1R (глюкагоноподібний рецептор пептиду 1) - вперед, TGGCTACATAAGGACAACT; реверс, CAACAAGGATGGCTGAAG; Y2R (пептидний YY-рецептор) - вперед, GCAGAGGCAGATGAGAAT; реверс, AAGATGATGGAGCAGTAGG; BDNF (похідний від мозку нейротрофічний фактор) - вперед, TTGGAAGCCTGAATGAATG; реверс, CCTAAGATGAAGCGATTGTT; ObRb - вперед, AGTCACAAGATAATGGAGAATAAG; реверс, GGCTCTACTGGAATGGAA; GHSR - вперед, GAGCGTCTTCTTCTTCCT; реверс, AGCATCTTCACTGTCTGTT; TNF-α - прямий, CCACCATCAAGGACTCAA; реверс, ATCTTATCCAGCCTCATTCT; Іл-6 - вперед, ACAGAAGGAGTGGCTAAG; реверс, AGAGAACAACATAAGTCAGATAC; IL-1β - вперед, GCAGCACATCAACAAGAG; реверс, CAGCAGGTTATCATCATCATC; NF-kB - вперед, AAGAAGGACACGACAGAA; реверс, CAGGCTATTGCTCATCAC; GFAP - вперед, CGCATCACCATTCCTGTA; реверс, GGAGCACGCATCTATCTAA; RAGE - вперед, CTACCGAGTCCGAGTCTA; реверс, CCTGGTCTCTTCCTTCAC; ALCAM - вперед, GAGGCAGACGATATAAGTGA; реверс, GAGGAGACCAACGACAAT; IBA-1 - вперед, TCTGCCATCTTGAGAATGA; реверс, TGACATCCACCTCCAATC.
Статистичний аналіз
Під час аналізу даних експериментатори були сліпими до груп. Ряд мРНК між 4 групами спочатку нормалізували до GAPDH і виражали як кратну зміну від худої контрольної групи, що годується чау. Це було проаналізовано ANOVA, а потім проведено багаторазові порівняльні тести Бонферроні. Дані про масу тіла та споживання калорій аналізували повторним аналізом ANOVA з подальшим багаторазовим порівняльним тестом Бонферроні. Дані представлені як середнє значення ± SEM. Статистично значуща різниця була встановлена на рівні p 10. У цій когорті RYGB знизив масу тіла приблизно на 17% порівняно з дохірургічним рівнем та на 34% порівняно з підробленими мишами, переважно через втрату маси жиру. Було невелике середнє відновлення ваги на 5% від надиру, яке відбулося приблизно через 3 тижні. У 2-тижневій когорті RYGB знизив масу тіла приблизно на 22% порівняно з дохірургічним рівнем та на 18% порівняно з мишами, що були піддані підробці (Додатковий рис. S1). Рівні лептину в плазмі як на 2, так і на 12 тижні як у мишей RYGB, так і у WM були набагато нижчими, ніж у фіктивних мишей, і не суттєво відрізнялись від контрольних мишей, яких годували чау, і один від одного 10. Споживання їжі було значно нижчим протягом перших 8 днів після RYGB, а потім відновилось до рівня до хірургічного рівня через 2 тижні (Додаткова Рис. S2).
Вплив на експресію генів до кінця фази схуднення
Через 2 тижні експресія мРНК AgRP та NPY була значно вищою у обмежених калорій, але не у мишей з RYGB, порівняно з мишами, що були піддані підробці (рис. 1А). Подібна тенденція спостерігалася і при експресії рецепторів греліну (GHSR), яка не досягла статистичної значущості. Порівняно з контрольними мишами, яких годували чау, без будь-якої операції, рівні експресії AgRP, NPY та GHSR були значно нижчими як у мишей RYGB, так і у підроблених, але не у мишей WM з обмеженим вмістом калорій.
Експресія генів, пов’язаних із запаленням або окислювальним стресом, включаючи TNF-α, RAGE, IL-6, IBA-1 та NFkB (рис. 2), як правило, була найнижчою у мишей з RYGB, але не значно нижча, ніж у мишей, які були підроблені. За винятком TNF-α, жоден з цих генів не регулювався у підставних оперованих мишей з ожирінням. Однак у 2,2 рази підвищення регуляції TNF-α не було статистично значущим через високу мінливість. Цікаво, що мРНК RAGE та IBA-1 була значно вищою у групі WM, яка втратила таку ж кількість ваги, як миші RYGB.
Серед анарексигенних генів, що оцінювались, POMC був значно збільшений у підробному порівнянні з RYGB та контролем чау (рис. 1B). Крім того, спостерігалася тенденція до підвищення рівня BDNF у всіх трьох групах з високим вмістом жиру в порівнянні з контролем чау, на відміну від того, що ми спостерігали через 2 тижні.
Подібним чином, за винятком IBA-1 та ALCAM, TNF-α, IL-6, IL-1β та NFkB мРНК більше не регулюється в контролях WM (рис. 2).
Обговорення
Знижений рівень Y2R у мишей RYGB у порівнянні з худими контролями, що годуються чау, може трактуватися як компенсаційне зниження регуляції через надмірну активацію рецептора анорексигенним гормоном кишечника PYY. Хоча це не вимірювалось у цьому дослідженні, наша 22 та інші попередні роботи 23 чітко продемонстрували значно вищий базальний рівень та/або стимульований прийомом їжі рівень PYY у плазмі після операції RYGB. Це також може допомогти пояснити зниження експресії мРНК NPY/AgRP, незважаючи на різку втрату ваги у цих мишей. Схоже, той самий потенційний механізм не застосовується для нижчих рівнів ObRb у мишей RYGB, оскільки їхні рівні лептину в плазмі були низькими та порівнянними з показниками як худих, так і контрольних груп WM.
Близько половини генів, пов’язаних із запаленням чи окислювальним стресом, були зменшені у фіктивних мишей з ожирінням порівняно з худими контролями, що годувались чау, хоча здебільшого не досягали статистичної значущості. Хоча високочастотне годування або ожиріння, спричинене дієтою, часто асоціюється із запаленням гіпоталамусу 24, наші дані узгоджуються з висновками інших, які не показали або ніяких змін, або навіть знизили маркери запалення гіпоталамусу у мишей із ожирінням, спричинених дієтою 25, 26. Невідповідність можна пояснити тривалістю ВЧ годування та/або складом ВЧ дієти. Важливо, що мРНК цих маркерів була аналогічним чином знижена в RYGB, але не в групі WM, що припускає, що миші WM можуть сприймати обмежене годування та подальше зниження ваги як стресові фактори, тоді як миші RYGB цього не роблять. Було б критично врахувати ці дані за допомогою протеомічного та метаболомічного аналізів, серед іншого, найближчим часом, щоб краще зрозуміти, чи дійсно операція RYGB змінює стан запалення гіпоталамуса.
Миші Sham та RYGB демонструють різні криві маси тіла під час гострої фази, одночасно поділяючи подібні рівні мРНК для багатьох досліджених тут генів, припускаючи, що ці гени можуть виконувати різні ролі після операції. Цікаво, що більшість змін вже не було під час хронічної фази, коли миші RYGB успішно підтримували свою втрату ваги. Це може свідчити про знижену чутливість до індукованих RYGB механізмів сигналізації. Альтернативно, може існувати група генів, важливих для «зниження» проти «підтримання» маси тіла та маси жиру всередині та/або поза MBH. Враховуючи зниження рівня мРНК BDNF серед груп лікування в гострій фазі та її узгоджене повернення до доопераційних рівнів у хронічній фазі, ми припускаємо, що BDNF може бути одним із генів, які допомагають підтримувати нову масу тіла та жирову масу.
На закінчення ми пропонуємо докази, що демонструють, що операція RYGB диференційовано регулює гени гіпоталамусу, критичні для апетиту, маси тіла та запального/окисного стресу під час гострої фази «швидкого схуднення» та хронічної фази «підтримки ваги». Важливо, що наші результати показують, що втрата ваги, спричинена обмеженням калорій, але не RYGB, збільшує експресію орексигенних та запальних генів, що свідчить про те, що операція RYGB пригнічує адаптивний голод та реакцію на стрес до втрати ваги. Наші результати також показують, що ці зміни зникають на етапі підтримання ваги/відновлення ваги, можливо, вказуючи на розвиток толерантності до індукованих RYGB механізмів сигналізації.
- Вагові незалежні механізми контролю глюкози після шлункового шунтування Roux-en-Y
- Загальна втрата ваги як результат виміру вибору після шлункового шунтування Roux-en-Y - PubMed
- На загальну втрату ваги після лапароскопічного шунтування шлунка Roux-en-Y впливає передопераційна вага
- Які найкращі медичні центри Міні шлункового шунтування в Нижньовартовську, Росія
- Чому обмеження калорій призведе до жиру - Шон Майнар