Зміст
Graziani A, Cappa FM, Fiorini E, Casalini P, Albertini F (2019) Пневмококовий сепсис як причина масивного інфаркту селезінки у пацієнта з невідомою целіакією. Int J Crit Care Emerg Med 5: 079. doi.org/10.23937/2474-3674/1510079
ЗВІТ З СПРАВИ | ВІДКРИТИЙ ДОСТУП DOI: 10.23937/2474-3674/1510079
Алессандро Граціані 1 *, Федеріка Мірічі Каппа 2, Еріка Фіоріні 2, П'єрпаоло Казаліні 3 та Франческо Альбертіні 4
1 відділення внутрішніх хвороб, лікарня Равенни, Італія
2 Відділення внутрішніх хвороб, лікарня Фаенца, Італія
3 Відділення інтенсивної терапії лікарні Фаенца, Італія
4 Інфекційне відділення, лікарня Равенни, Італія
Інфаркт селезінки (СІ) - це рідкісна подія, яка виникає, коли артерія селезінки (СА) або її гілки закупорюються емболом або тромбозом in situ [1]. Більшість подій СІ є результатом емболічних джерел - серцевих або аортальних. Однак злоякісні гематологічні розлади та аутоімунні захворювання є основними причинами тромбозу селезінки [2]. Масивний інфаркт селезінки (МСІ) є наслідком порушеного кровотоку більш ніж до половини селезінки [3]. У цій роботі ми описуємо випадок раніше здорового пацієнта, який страждав на пневмококовий сепсис, який під час дослідження виявив невідому целіакію та MSI.
57-річна жінка потрапила до відділення невідкладної допомоги (ЕД) із загостренням болю в правій нозі на 48 годин, млявості та лихоманки. Її минула історія хвороби включала пролапс мітрального клапана (MVP). У ЕД вона була гарячковою, млявою, зіниці були рівними та реактивними, без відхилень від норми при неврологічному обстеженні. Її життєві показники були такими: артеріальний тиск (АТ) 60/40 мм рт.ст., частота серцевих скорочень (ЧСС) 103 удари/хв, температура 38,6 ℃, частота дихання (RR) 18/хв та пульсова оксиметрія 96% на повітрі в приміщенні . Фізичний огляд показав чіткі легеневі звуки до аускультації, тахікардичний пульс із регулярним ритмом без шуму, живіт розтягнутий і дифузно ніжний, не охороняючи і не відскакуючи.
Первинне лабораторне обстеження продемонструвало: Клітини білої крові (WBC) 37210 × 10 9/літр; гемоглобін (Hb) 11,5 г/дл; тромбоцити (PLT) 12 × 10 9/літр; креатинін, 1,53 мг/дл; загальний білірубін 1,3 мг/дл; прямий білірубін, 0,9 мг/дл; АЛТ 75 Од/л; 1,39 індійських рупій; фібриноген 232 мг/дл, активований частковий тромбопластин (aPTT) 37 с (співвідношення 1,39); С-реактивний білок (CRP) 272 мг/л (норма 9/літр при гематурії. З цієї причини пацієнт отримав переливання концентратів тромбоцитів (ПК) та свіжозамороженої плазми (FFP).
З дня прийому вона виявила еритематозний макулярний висип, спочатку подібний до петехій, який потім еволюціонував до пурпурової висипки з шкірними пухирцями і швидко прогресував до пульпури фульмінанів. Ураження поширювались на верхні та нижні кінцівки, ніс, щоки та черевну область. Посів крові був позитивним на стрептококову пневмонію, і антибіограма показала, що ця бактерія чутлива до терапії, яку пацієнт отримував з амоксициліном/клавуланатом. Після дванадцяти днів перебування у відділенні інтенсивної терапії вона стала клінічно стабільною і була переведена у відділення внутрішньої медицини. Тут їй зробили УЗД черевної порожнини, а потім доплерівське ехо з контрастною речовиною. Цей тест виявив повну втрату перфузії селезінки, що передбачало масивний інфаркт (рис. 1), підтверджений також КТ черевної порожнини з контрастним матеріалом (рис. 2). Її лікували антикоагулянтним підшкірним еноксапарином у дозі 100 ОД/кг/добу. У наступні дні хворий був фебрильним і потребував хірургічної та інфекційної консультації. Потім було вирішено провести подальші дослідження та продовжити антибіотикотерапію.
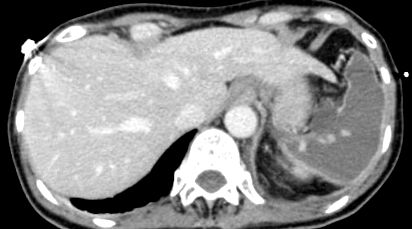
Малюнок 2: КТ 2. Перегляд Рисунок 2
Трансторакальна ехокардіограма (ТТЕ) продемонструвала рослинність на мітральному клапані, не виявлену колишнім обстеженням інтенсивної терапії, підтверджену транс-стравохідною ехокардіограмою (ТЕЕ). Новий зразок культури крові був негативним для росту бактерій, тому ми припустили, що попереднє поширення пневмокока під час гострої фази сепсису спричинило ендокардіальну колонізацію мітрального клапана. Пацієнт також пройшов позитронно-емісійну томографію (ПЕТ) з аналогом глюкози 2- [18F] флуоро-2-дезокси-D-глюкози (18F-FDG), яка не виявила запалення або інфекції. Ми дослідили можливі причини пневмококового сепсису і, зокрема, виявили позитивні серологічні маркери для антигліадинових та антиендомізіальних антитіл. Ендоскопія верхнього відділу шлунково-кишкового тракту продемонструвала втрату складок Керкрінга в низхідній дванадцятипалій кишці, а гістопатологія виявила повну атрофію ворсин. На підставі вищезазначених даних ми запідозрили целіакію, і пацієнт почав дотримуватися безглютенової дієти та отримувати вітаміни. Лікування антибіотиками продовжували протягом 15 днів після останньої негативної культури крові.
У наступні дні лабораторні обстеження показали прогресивне зниження показників запалення як лейкоцитів та РКП. Селезінка, яка періодично оцінювалась за допомогою УЗД черевної порожнини з контрастною речовиною, залишалася неконфузійною і поступово зменшувала свій об’єм, як це продемонструвало також ТК черевної порожнини з контрастним матеріалом (рис. 3а та 3б). Пацієнта виписали і рекомендували пройти щеплення від капсульованих організмів. Після чотирьох місяців спостереження вона була клінічно стабільною. Білок С, рівень білка S та антитромбіну III, антикардіоліпінові антитіла імуноглобулін (Ig) G та IgM, антикоагулянт вовчака, гомоцистеїн, мутація гена v617f гена JAK 2 та мутація гена протромбіну були нормальними. УЗД черевної порожнини показало подальше зменшення об’єму селезінки без будь-яких ускладнень.
Рисунок 3А: КТ 3. Перегляд малюнка 3А
Рисунок 3B: ТК живота з контрастним матеріалом. Подивіться малюнок 3B
СІ є результатом паренхіматозної ішемії та некрозу тканин внаслідок оклюзії однієї або декількох гілок селезінкової артерії [4,5]. Селезінка, яка має багатий судинний запас (5% серцевого викиду), вразлива до інфаркту через відсутність колатеральної циркуляції між гілками артерії. СІ може розвинутися на тлі серцево-судинних розладів як фібриляція передсердь, шлуночкова аневризма та захворювання серцевих клапанів. Іншими етіологічними несерцево-судинними розладами є гематологічні захворювання, тромботичні захворювання, захворювання колагенової тканини, травми, операції на черевній порожнині або інфекція [6]. Переважаючим симптомом є біль у животі, іноді гострий і сильний, розташований у лівому верхньому квадранті, пов’язаний з лихоманкою та блювотою. Лабораторні обстеження можуть показати підвищений вміст лактатдегідрогенази в сироватці крові (ЛДГ) та лейкоцитів.
У цьому звіті ми описуємо пацієнта, який потрапив до відділення інтенсивної терапії через пневмококовий септичний шок, у якого розвинувся MSI. Дослідження, проведені при вступі, не виявили місця первинного джерела інфекції [7]. Під час госпіталізації були розглянуті ті захворювання, які схильні до пневмококового сепсису, і ми виявили невідому целіакію (CD). У CD спостерігається порушення імунної функції селезінки, яке називається функціональним гіпоспленізмом (FH). Це спричиняє зменшення кількості В-лімфоцитів пам'яті IgM та дефектну активність опсонізуючих молекул (туфцин, пропердин), які беруть участь у реакції імунітету проти інкапсульованих мікроорганізмів [8-10]. Клінічними проявами септичного синдрому у хворих на ФГ є: масивна бактеріємія, спричинена інкапсульованими мікроорганізмами, відсутність очевидного первинного джерела інфекції, швидке виникнення симптомів, септичний шок, що супроводжується дисемінованою внутрішньосудинною коагулопатією та рівень смертності 50-70% [ 11].
Дослідження селезінки за допомогою абдомінального ехо-кольорового доплера з контрастною речовиною, а потім за допомогою КТ черевної порожнини, виявило повну втрату судинного сигналу, як описано в MSI [12,13]. Як зазначалося раніше, серед причин СІ найчастішими є серцево-судинні події. З цієї причини пацієнту зробили транс-стравохідну ехокардіограму, яка виявила ендокардит мітрального клапана. В умовах лівого інфекційного ендокардиту (ІЕ) СІ зустрічається приблизно у 40% пацієнтів, і, за оцінками, лише в 5% випадків розвинеться абсцес селезінки [14]. Диференціація абсцесу від інфаркту утруднена. Постійний сепсис та повторні позитивні посіви крові, які погано реагують лише на антибіотикотерапію, є більш типовими для абсцесу [15]. Під час госпіталізації пацієнт тривалий час був гарячковим, але після початку лікування антибіотиками посіви крові неодноразово були негативними. Селезінку періодично досліджували за допомогою ехо-кольорового доплерометрія з контрастною речовиною, що виявляло абсолютну відсутність судинного сигналу та поступове зменшення об'єму.
ПЕТ з аналогом глюкози 2- [18F] флуоро-2-дезокси-D-глюкози (18F-FDG) не виявив запалення або інфекції. На підставі цих результатів ми не проводили спленектомію. СІ сам по собі не є показанням до хірургічного втручання, але такі ускладнення, як інфекція, розрив або хронічний біль, є показанням до операції [16]. MSI у цього пацієнта може бути обумовлений одночасним механізмом, який діє узагальненим чином. Поширене внутрішньосудинне згортання крові під час сепсису може визначити системну активацію згортання крові, що призводить до тромбозу дрібних судин [17,18]. Цей стан може посилити ішемічний ефект, що створюється через оклюзію селезінкової артерії емболізованою рослинністю з мітрального клапана. Протягом усього періоду перебування в лікарні пацієнтку лікували парентеральною антикоагуляцією. Врешті-решт її виписали через два місяці госпіталізації в клінічно стабільному стані, і їй рекомендували ретельне спостереження. Ехо-кольоровий доплер з контрастною речовиною, проведений через три місяці, показав подальше зменшення об’єму селезінки без ознак абсцесів або розриву.
На закінчення ми хотіли б підкреслити, що у пацієнтів з масивною бактеріємією, спричиненою інкапсульованими мікроорганізмами, і відсутністю явного первинного джерела інфекції, може бути корисним дослідити та перевірити наявність потенційного захворювання, що спричиняє функціональний гіпоспленізм, іноді виявлений у зрілому віці, як щодо пацієнт, якого ми описали у цьому звіті [19,20]. Крім того, Ехо-кольоровий доплер з контрастною речовиною є корисним інструментом для діагностики та спостереження за пацієнтами із СІ. Цей тест можна проводити на ліжках пацієнтів, і це особливо корисно для пацієнтів, які не транспортуються в реанімацію [21].
- Спонтанний інфаркт селезінки як нечаста причина лихоманки у хворого на цироз печінки - ScienceDirect
- Ожиріння як етіологія хвороби, лікування та міркування щодо лікування ожиріння у пацієнта -
- Звичайна біопсія дванадцятипалої кишки для діагностики целіакії
- Non; Целіакія Клейковина Фонд целіакії для чутливості до пшениці
- Інфаркт селезінки