Докази та механізми виснаження жиру при раку
Анотація
1. Вступ
Жирова тканина (АТ) є активним секреторним органом, який регулює енергетичний баланс, гомеостаз, апетит, запалення, чутливість до інсуліну, ангіогенез та жировий обмін [1]. Метаболізм жирової тканини та жирова маса всього тіла регулюються за двома основними шляхами: ліполіз (розпад жиру) та ліпогенез (синтез жиру) [2]. Порушення функції жирової тканини, зміна маси жиру та супутні зміни у виробництві адипокінів, запальних цитокінів та ліпідних метаболітів є загальними явищами при порушеннях обміну речовин, таких як резистентність до інсуліну, діабет 2 типу, серцево-судинні захворювання та рак, пов’язаний з ожирінням, такий як колоректальний та молочний рак [3,4].
Зв'язок між ожирінням та збільшенням захворюваності на рак добре встановлена [5,6], але зв'язок між масою жиру та прогресуванням раку набагато менш чітка. Дослідження показують, що більшість онкологічних хворих відчуває певний ступінь пов'язаного з раком виснаження м'язів та/або жиру під час траєкторії захворювання [7]. Однак мало що відомо про важливість втрати жиру при раку, оскільки більшість досліджень, пов'язаних з раком, витрачається, як правило, на м'язи. Виявлено потенційні зв’язки між втратою жиру та поганими результатами, які свідчать про те, що втрата жиру є поганим прогностичним фактором при запущеному раку незалежно від маси тіла пацієнта [8,9]. У цій статті розглядаються сучасні знання про виснаження жирової тканини при раку, зосереджуючись як на оцінці жирової тканини, так і на морфологічному визначенні жирової тканини у популяціях раку. Також обговорюються можливі механізми втрати жиру. Біологічні зміни в метаболізмі жирової тканини передують фізичному прояву втрати жирової тканини. Таким чином, розуміння механізмів та потенційних маркерів втрати жиру при раку є важливим для раннього виявлення, що полегшує запобігання подальшим втратам для збереження жиру та покращує виживання хворих на рак.
2. Атрофія жирової тканини при раку
Повідомляється, що втрата жиру пов'язана з меншим часом виживання [8,9]. Аналіз морфології жирової тканини та складу тіла виявив виснаження жиру в організмі людини та тварин на моделях ракової кахексії. У більшості досліджень на людях, обговорених у цьому огляді, кахексія визначається як ≥5% втрати ваги (ЗВ) протягом 3 місяців або ≥10% протягом попередніх 6 місяців. Втрата ваги не обов'язково відображає тяжкість кахексії та втрати жиру, але це перше вимірювання результату, яке зазвичай використовується в дослідженнях раку. З'являються підтверджені дані для класифікації кахексії на основі нещодавнього консенсусу [10].
Аденокарцинома миші (MAC16) спричиняє зменшення розміру адипоцитів зі збільшенням мітохондріальної щільності та підвищений фіброз жирової тканини у мишей-кахектиків порівняно з тваринами, котрі годували пару та контрольними [11]. Карцинома Walker 256, добре встановлена модель ракової кахексії, впливає на жирову тканину в залежності від часу та депо [12,13,14]. Через сім днів після ін'єкції пухлини Walker 256 значних змін у розмірі адипоцитів не спостерігалося. Однак через 14 днів розмір адипоцитів заочеревинної та епідидимальної жирової тканини зменшився. З іншого боку, брижова жирова тканина не втрачалась, і розмір брижових адипоцитів збільшувався через 14 днів [13,14]. На підтвердження цих експериментальних досліджень повідомляється про зменшення обсягу жирових клітин у хворих на рак шлунково-кишкового тракту (ШКТ), що втрачають вагу [15,16,17]. Кахектичні пацієнти виявляли менші адипоцити порівняно із контролерами, стійкими до ваги [15,16,17,18], та нераковими пацієнтами [16], але загальна кількість клітин жирових клітин у організмі не змінювалася [16,17]. У сукупності ці дослідження свідчать про зміну розміру адипоцитів та зменшення здатності до зберігання ліпідів при наявності пухлини.
3. Оцінка жирових тканин за траєкторією раку
Склад тіла оцінюють у онкологічних хворих за допомогою різних методів, включаючи аналіз біоелектричного імпедансу (BIA), подвійну енергію рентгенівської абсорбціометрії (DEXA), магнітно-резонансну томографію (МРТ) та комп’ютерну томографію (КТ) [21]. Аналіз складу тіла за допомогою BIA продемонстрував зниження рівня жиру в організмі (% або кг) у кахектичних пацієнтів порівняно з контролем раку, стійким до ваги [15,16,17,22], здоровим контролем [23] або не злоякісним контролем [16,22 ]. Коли DEXA застосовували до недоїдаючих паліативних хворих на рак, ніяких відмінностей в абсолютній масі жиру (кг) під час спостереження (4–62 місяці) [9] не спостерігалось. Однак відносна зміна (відсоток зміни від початкових значень) виявила одночасну втрату жиру з незначним збільшенням м’язової маси під час прогресування раку [9]. Оскільки DEXA кількісно визначає регіональну масу тіла, це дослідження підняло ймовірність того, що пацієнти, можливо, не набирали скелетні м’язи як такі, а скоріше масу м’язів у внутрішніх органах, таких як печінка та селезінка, про що повідомлялося, коли пацієнти наближались до смерті в наступному дослідженні 24].
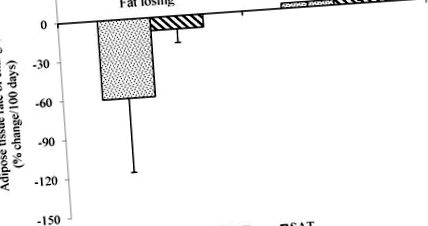
Середня швидкість зміни вісцеральної жирової тканини (ПДВ) та підшкірної жирової тканини (САТ) у хворих на рак, що втрачають жир, оцінюється шляхом послідовного сканування комп’ютерної томографії (КТ). Дані представлені як середнє значення ± SD, n = 5 (втрата жиру) та n = 2 (стабільність жиру), р за 3 місяці до смерті [36]. Ці результати дадуть початок подальшим дослідженням, спрямованим на визначення відповідного часу для початку дієтичного втручання для збереження як м’язової, так і жирової тканини.
Таблиця 1
Статті, що повідомляють про втрату жиру та нежирної тканини у вперше діагностованих хворих на рак.
| Fouladiun та ін., [9] | Пацієнти з недостатнім харчуванням (n = 132; 66 ± 3 роки), що страждають на рак із недостатнім харчуванням (T4N1M1) | ГІ (n = 123) Груди (n = 1) Меланоми (n = 2) Інші (n = 6), після чого протягом 6–42 місяців | DEXA | Втрата жиру у всьому тілі була пов’язана з коротшим виживанням Втрата жиру в організмі більш інтенсивна і виражена в порівнянні з нежирною тканиною |
| Агусстон та ін., [15] | Хворі на рак із стабільною вагою (n = 11), кахектичні ракові, які втрачають вагу, з (n = 8) та без (n = 7) гіпотрофії | Рак шлунково-кишкового тракту без лікування до операції | BIA | Немає різниці в худій масі тіла між групами Підвищений ліполіз у кахектичних хворих на рак |
| Далман та ін., [17] | Кахектичні пацієнти (n = 13) Вагостійкий рак (n = 14) | Рак шлунково-кишкового тракту без лікування до операції | BIA | Знижена маса жиру в організмі, але схожа на масу тіла між кахектичними та контрольними пацієнтами |
| Ryden та ін., [16] | Кахектичні пацієнти (n = 13) Вагомі пацієнти з раком (n = 10), Без раку (n = 5) | Рак шлунково-кишкового тракту без лікування до операції | BIA | Немає різниці в худій масі тіла між групами Підвищений ліполіз без змін у ліпогенезі Місцевого запалення немає |
| Агустонсон та ін., [26] | Кахектичний рак без (n = 13) та з непрохідністю шлунково-кишкового тракту (n = 10), втрата ваги - рак (n = 17) | Рак шлунково-кишкового тракту без лікування до операції | BIA, CT | Ніяких змін у нежирній масі не спостерігалося Обсяг вісцерального жиру був нижчим у кахектичній групі порівняно зі стабільною вагою |
1 Жоден пацієнт не отримував хіміо- та променевої терапії.
4. Механізми виснаження жирової тканини при раку
Підвищені витрати енергії, зменшення споживання їжі та зміни рівня циркулюючих гормонів, включаючи інсулін, лептин, катехоламіни, а також підвищений катаболізм через наявність пухлини (великі енергетичні потреби пухлини, медіатори запалення, що утворюються пухлиною) та взаємодії пухлина-господар. фактори, що сприяють марнотратству при раку [40]. Ці фактори можуть спричинити порушення обміну ліпідів, що також може призвести до втрати жиру. Підвищена ліполітична активність, що підтверджується підвищеним вмістом гліцерину в плазмі натще і вільних жирних кислот, є рушійною силою втрати жиру у хворих на рак, що перебувають у стадії розвитку [15,23,41], але основні причини підвищеного ліполізу невідомі. Інші механізми, включаючи знижений ліпогенез [42,43], порушення адіпогенезу [11,14], підвищене окислення жиру [17,23,44], та зменшення відкладення ліпідів [45,46,47,48,49] також були визначені до втрати жиру при раку (рисунок 2).
Короткий зміст механізмів та специфічних генів, що беруть участь у жировій атрофії раку. ВАТ, біла жирова тканина; FFA, вільні жирні кислоти; ATGL, жирова тригліцеридна ліпаза, HSL, гормоночутлива ліпаза; PGC-1α, активований проліфератором пероксисом рецептор-гамма-коактиватор 1 альфа; UCP, незчеплюючі білки; CIDEA, ефектор А, що викликає смерть клітин DFFA (фактор фрагментації ДНК-альфа); CPT1α, карнітинпальмітоїлтрансфераза 1 альфа; PPAR-γ, гамма-рецептор, що активується проліфератором пероксисоми; C/EBPα, CCAAT-енхансер-зв’язуючий білок α; LPL, ліпопротеїн-ліпаза; FAS, синтаза жирних кислот; ACC, ацетил-КоА карбоксилаза; Scd1, дезатураза стеароїл-КоА; SREBP1c, регулюючий елемент стеролу елемент, що зв’язує білок-1c.
Людські та експериментальні моделі використовувались для вивчення механізмів втрати жиру при раку. Моделі на тваринах необхідні, щоб підвищити наше розуміння втрати ваги, пов’язаної з раком. Однак кожна модель може представляти лише деякі аспекти кахексії раку людини, і вибір моделі тварин заснований на цілях дослідження. Наприклад, аденокарцинома MAC16 індукує кахексію за відсутності анорексії і підходить для вивчення марнотратства, пов'язаного з факторами, що утворюються пухлиною, а не споживанням їжі. Йошида асцитує гепатому AH130 (YAH-130), навпаки, індукує кахексію та анорексію, що супроводжуються запаленням [50]. Отже, результати досліджень, що вивчають механізми, що лежать в основі втрати жиру при раку, слід тлумачити з обережністю, оскільки кожен конкретний тип пухлини на різних стадіях росту може по-різному впливати на різні депо жирової тканини.
4.1. Зниження споживання їжі та гіперметаболізму
У паліативних хворих на рак протягом 4–62 місяців спостереження маса тіла та жирова маса (% зміни від вихідного рівня) зменшувались за відсутності змін РЗЕ. Незважаючи на надання харчової підтримки пацієнтам, у яких споживання калорій на початковому рівні менше 90% від їх енергетичної потреби, маса тіла та жирова маса не зростали [9]. Отже, інші фактори, крім споживання поживних речовин та гіперметаболізму, можуть сприяти втраті жиру при раку.
4.2. Ліполіз та підвищене окислення жиру
Загальновизнано, що підвищений ліполіз є основною причиною втрати жиру при раку [15,16,17,22,23,55,56], проте конкретні механізми, що сприяють ліполізу, чітко не визначені. Гормоночутлива ліпаза (HSL) та жирова тригліцеридна ліпаза (ATGL) є основними ферментами, які сприяють розпаду TG в жировій тканині. Жирова тригліцерид-ліпаза каталізує перший етап гідролізу TG. Під час ліполізу жирової тканини гідролізом тригліцеридів утворюються вільні жирні кислоти (FFA) та молекули гліцерину. Активність HSL регулюється гормонами, тобто катехоламінами, інсуліном та глюкагоном, через процес, опосередкований цАМФ [57,58]. Катехоламіни стимулюють ліполіз, тоді як інсулін має антиліполітичні функції [59]. Зв'язування гормонів з рецепторами, пов'язаними з G-білками, призводить до підвищення регуляції аденилатциклази, що призводить до збільшення концентрації внутрішньоклітинного циклічного аденозинмонофосфату (цАМФ). цАМФ стимулює протеїнкіназу, яка, у свою чергу, фосфорилює та активує HSL [57,58]. Фосфорильований HSL транслокується з цитозолю на поверхню крапель ліпідів, щоб викликати ліполіз.
4.3. Ліпогенез та відкладення ліпідів
Незважаючи на важливість ліполізу для втрати жиру при раку, виснаження жиру може також відбуватися, коли ліпогенез обмежений у білій жировій тканині. На кахектичних моделях мишей (асцитна гепатома Yoshida AH-130) зниження ліпогенезу АТ супроводжувалось збільшенням ліпогенезу печінки та гіпертригліцеридемією [42]. Зниження ліпогенезу супроводжувалося зниженням активності FAS, ферменту розщеплення цитрату та яблучного ферменту у щурів, що несуть аденокарциному молочної залози, на пізніх фазах прогресування пухлини [43]. Погіршення здатності синтезу ліпідів епідидимальної жирової тканини спостерігалося у щурів, що несуть MAC16, про що свідчить зниження рівня мРНК важливих ліпогенних ферментів, таких як ацетил-КоА-карбоксилаза, FAS, стеароїл-КоА-десатураза-1 та гліцерол-3-фосфатна ацилтрансфераза [11].
Повідомлялося про посилений ліполіз та знижений ліпогенез у білих кроликів-самців японської породи, які несли клітини пухлини VX2, порівняно з тваринами з обмеженим харчуванням. Зниження маси тіла та втрата жиру відбувалися до будь-якого зменшення споживання їжі [65]. Апоптоз адипоцитів (через 20–30 днів після імплантації пухлини) також спостерігався в пухлинних групах, однак у попередніх дослідженнях на людях не зафіксовано змін у загальній кількості клітин жирових клітин [15,16,17]. Розбіжності можуть бути викликані тим фактом, що пацієнти в попередніх дослідженнях були на ранніх стадіях захворювання, а також кількість жирових клітин екстраполювались на основі загального жиру в організмі та середнього обсягу жирових клітин. На відміну від цих досліджень на людях, за тваринами спостерігали під час прогресування раку, а також біологічні відмінності та обмеження результатів екстраполяції між різними видами можуть сприяти розбіжностям.
LPL опосередковує поглинання ФА в жировій тканині шляхом гідролізу ліпопротеїдів і хіломікронів дуже низької щільності. Численні дослідження на тваринах свідчать про знижену активність LPL при раку [42,43,45,46]. Зниження активності AT LPL у мишей, що несуть пухлину, до рівнів голодуючих тварин було пов’язано з порушенням відкладення ліпідів, втратою жиру, зменшенням розпаду ліпопротеїдів у плазмі та збільшенням концентрації циркулюючих ліпідів [47]. Зниження активності LPL жирової тканини асоціювалося з гіпертригліцеридемією на ранніх стадіях росту пухлини у щурів Льюїса, що несли аденокарциному молочної залози [43]. Зниження вмісту жиру та активності LPL у ВАТ супроводжувалося збільшенням циркулюючих тригліцеридів та втратою маси тіла, спричиненою асцитним гепатом Yoshida AH-130 у щурів [42,45,46]. У мишей, що несуть MAC16, плазмові TG зменшувались під час прогресування раку, незалежно від величини втрати ваги. На ранніх стадіях плазмовий FFA знижувався, а активність LPL збільшувалась; однак на запущених стадіях пухлини активність LPL знижувалась [49].
Хоча в більшості досліджень використовувались тваринні моделі для дослідження ліпогенезу та активності LPL під час прогресування раку, дослідження на людях повідомляють про зниження експресії мРНК та активності LPL та FAS у ПДВ поблизу пухлини порівняно з дистальною жировою тканиною у хворих на рак прямої кишки [ 48]. Зниження активності FAS в жировій тканині та підвищена активність у клітинах пухлини можуть бути важливими для росту пухлинних клітин [48]. Не спостерігалось змін у ліпогенезі в адипоцитах, виділених із САТ хворих на рак, порівняно з контролем [16]. У кахектичних пацієнтів спостерігали нижчий рівень TG у плазмі крові та вищий рівень гліцерину та FFA [16,17,27], але активність або експресія LPL у цих дослідженнях не визначалась. Потрібні подальші дослідження для визначення здатності ліпогенезу та поглинання жирних кислот жировою тканиною у різних груп хворих на рак на різних стадіях під час траєкторії захворювання.
4.4. Адипогенез
5. Місцеве запалення жирових тканин
6. Висновки
Внески автора
Мар'ям Ебаді та Віра С. Мазурак внесли свій внесок у концепцію та інтелектуальний зміст статті.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Кашель! Це Рак
- Хто-небудь приймає добавки куркуми куркумін (метаболізм, рак, кров, якість) - трави,
- Ознаки, симптоми та ускладнення раку шийки матки
- Огляд доказів Дієти з низьким глікемічним індексом краще для схуднення
- Свідчення вигоди майже на половині пробного періоду для схуднення MedPage сьогодні