Вплив різних рівнів обмеження дієти на гомеостаз глюкози та метаболічну пам’ять
Стефанія Маті
1 Кафедра геріатричної медицини, Університет штату Оклахома, Центр наук про здоров'я, штат Оклахома-Сіті, США
2 Reynolds Oklahoma Center on Aging, штат Оклахома-Сіті, штат Оклахома, США
Джордан Джексон
1 Кафедра геріатричної медицини, Університет штату Оклахома, Центр наук про здоров'я, штат Оклахома-Сіті, США
2 Reynolds Oklahoma Center on Aging, штат Оклахома-Сіті, штат Оклахома, США
Карла Гаррет
1 Кафедра гериатричної медицини, Університет штату Оклахома, Центр наук про здоров'я, Оклахома-Сіті, штат Оклахома, США
2 Reynolds Oklahoma Center on Aging, штат Оклахома-Сіті, штат Оклахома, США
Сатіасеелан С. Діпа
1 Кафедра гериатричної медицини, Університет штату Оклахома, Центр наук про здоров'я, Оклахома-Сіті, штат Оклахома, США
2 Reynolds Oklahoma Center on Aging, штат Оклахома-Сіті, штат Оклахома, США
Арчана Уннікрішнан
1 Кафедра гериатричної медицини, Університет штату Оклахома, Центр наук про здоров'я, Оклахома-Сіті, штат Оклахома, США
2 Reynolds Oklahoma Center on Aging, штат Оклахома-Сіті, штат Оклахома, США
3 Діабетичний центр Гарольда Хамма, Оклахома-Сіті, штат Оклахома, США
Анотація
За останні 50 років було доведено, що обмеження в харчуванні (ДР) продовжує тривалість життя найрізноманітніших організмів. Відмінною рисою DR є покращений гомеостаз глюкози, що призводить до підвищення толерантності до глюкози та чутливості до інсуліну тварин, починаючи від гризунів і закінчуючи людиною. У цьому дослідженні ми демонструємо ранні ефекти різних рівнів АД на толерантність до глюкози. Протягом 10 днів 40% АД толерантність до глюкози значно покращилася і до 120 днів; 10 і 20% DR також показали підвищену толерантність до глюкози. Всі три рівні DR демонстрували знижене ожиріння, підвищену експресію генів, що беруть участь в жирообміні, і зниження експресії для маркерів запалення. Дослідження показали, що миші, які харчувались дієтою DR, зберігали метаболічну пам’ять з точки зору поліпшення толерантності до глюкози навіть після припинення DR. Ми показуємо, що 40% АД не тільки рано впливає на толерантність до глюкози, але й підтримує її після припинення АД на 2 місяці. Отже, поліпшення толерантності до глюкози забезпечується усіма трьома рівнями АД, але метаболічна пам’ять не залежить від дози.
Вступ
Першою та найбільш вивченою маніпуляцією, яка показала збільшення тривалості життя ссавців, є обмеження дієти/калорій. Спочатку було показано, що обмеження в харчуванні (DR) збільшує тривалість життя щурів, а згодом і різних штамів мишей. Дослідження за останні два десятиліття показують, що DR збільшує тривалість життя широкого кола інших організмів, починаючи від безхребетних, таких як дріжджі, C. elegans і дрозофіла, а також павуків і коловерток до різних штамів щурів та мишей (Weindruch та Walford 1988; Swindell 2012). Також повідомляється, що ДР збільшує тривалість життя інших типів ссавців, таких як лабрадор-ретрівери (Kealy et al. 2002) та резус-мавп (Colman et al. 2009).
Стандартна дієта DR, яка використовується в більшості досліджень на щурах та мишах, становить 40% DR, де гризунів годують 60% раціону, який споживають тварини, які харчуються ad libitum (AL). Зазвичай вважають, що збільшення рівня обмежень призводить до більшого збільшення тривалості життя до певної точки (близько 60% DR) і де подальше обмеження є шкідливим (Weindruch et al. 1986; Clancy et al. 2001). Наприклад, Weindruch et al. (1986) повідомили, що значне збільшення (понад 20%) середнього рівня виживання відбулося між ними
55% DR для самок мишей C3B10RF1. Однак два останні дослідження показують, що зниження рівня АД є таким же ефективним для збільшення тривалості життя, як 40% АД. Наша група показала, що 10% DR значно збільшує тривалість життя щурів F344 до рівня, подібного до збільшення тривалості життя, що спостерігається при 40% DR (Richardson et al. 2016). Крім того, Mitchell et al. (2016) показали, що 20% DR був настільки ж ефективним, а в деяких випадках більш ефективним, ніж 40% DR, при збільшенні тривалості життя у мишей C57BL/6 та DBA/2.
Метою описаних нижче експериментів було визначити, наскільки швидко різні рівні DR (10, 20 та 40%) покращують толерантність до глюкози. Ми спостерігали, що протягом 10 днів після 40% DR толерантність до глюкози значно покращується, і до 4 місяців миші, які годували 10 та 20% DR, мали подібне покращення толерантності до глюкози, як 40% DR. Ми також спостерігали, що короткочасний 40% DR (4 місяці) надає мишам метаболічну пам'ять, коли вони перейшли на годування AL, чого не спостерігалося у мишей, які годували 10 і 20% DR.
Методи
Тварини та дієта
Склад тіла
Склад тіла тварин вимірювали за допомогою ядерно-магнітно-резонансної спектроскопії (ЯМР-Bruker minispec) після DR та через 2 місяці після переходу на годування AL. Вимірювали жир і нежирну масу тіла тварин у кожній групі.
ПЛР у режимі реального часу
Рівні специфічних транскриптів РНК (мРНК) генів, що беруть участь у запаленні, метаболізмі жирних кислот та диференціації адипоцитів, вимірювали методом ПЛР у реальному часі в епідидимальних та підшкірних жирових тканинах білого кольору від мишей DR та AL через 4 місяці після ініціювання DR (n = 5 на групу). Коротко кажучи, РНК виділяли за допомогою набору RNeasy від Qiagen (Germantown, MD, США). КДНК першої ланцюга синтезували з 1 мкг РНК із використанням випадкових праймерів (Promega, Madison, WI, USA) та очищали за допомогою набору для очищення ПЛР QIAquick (Qiagen, Germantown, MD, USA). Експресія генів-кандидатів була кількісно визначена за допомогою ПЛР у реальному часі з SYBR Green, а послідовності праймерів наведені в таблиці Таблиця1. 1. Транскрипти генів нормалізувались до β-актину. Відносну експресію генів кількісно визначали як порівняльний аналіз Ct, використовуючи метод аналізу 2 −ΔΔct з β-актином як ендогенним контролем. Одностороння конструкція ANOVA із багаторазовою корекцією тесту Тукі була використана для статистичного аналізу окремих зразків.
Таблиця 1
| Адипонектин | 5′-GCCGCTTATGTGTATCGCTCAG-3 ′ | 5′-GCCAGTGCTGCCGTCATAATG-3 ′ |
| Лептин | 5′-TGACACCAAAACCCTCATCA-3 ′ | 5′-TCATTGGCTATCTGCAGCAC-3 ′ |
| Іл-6 | 5′-TGGTACTCCAGAAGACCAGAGG-3 ′ | 5′-AACGATGATGCACTTGCAGA-3 ′ |
| TNF-α | 5′-CACAGAAAGCATGATCCGCGACGT-3 ′ | 5′-CGGCAGAGAGGAGGTTGACTTTCT-3 ′ |
| MCP-1 | 5′-CCACTCACCTGCTGCTACTCAT-3 ′ | 5′-GGTGATCCTCTTGTAGCTCTCC-3 ′ |
| ФАС | 5′-GGAGGTGGTGATAGCCGGTAT-3 ′ | 5′-TGGGTAATCCATAGAGCCCAG-3 ′ |
| ACC | 5′-GATGAACCATCTCCGTTGGC-3 ′ | 5′-GACCCAATTATGAATCGGGAGTG-3 ′ |
| КПТ-1 | 5′-AAGGGTAGAGTGGGCAGAGG-3 ′ | 5′-GCAGGAGATAAGGGTGAAAGA-3 ′ |
| MCAD | 5′-CTAACCCAGATCCTAAAGTACCCG-3 ′ | 5′-GGTGTCGGCTTCCAAATGA-3 ′ |
| LCAD | 5′-CTTGCTTGGCATCAACATCGCAGA-3 ′ | 5′-ATTGTAGTACGCTTGCTCTTCCCA-3 ′ |
| PGC-1α | 5′-CCCTGCCATTGTTAAGACC-3 ′ | 5′-TGCTGCTGTTCCTGTTTTC-3 ′ |
| PPARγ-2 | 5′-CGAGGACATCCAAGACAAC-3 ′ | 5′-GTGCTCTGTGACGATCTG-3 ′ |
| CEBP-α | 5′-CAAGAACAGCAACGAGTACCG-3 ′ | 5′-GTCACTGGTCAACTCCAGCAC-3 ′ |
| AP-2 | 5′-TAACCCTAGATGGCGGGGCCC-3 ′ | 5′-AACACATTCCACCACCAGCTTGTC-3 ′ |
| β-актин | 5′-GATGACCCAGATCATGTTTGAGACC-3 ′ | 5′-AGATGGGCACAGTGTGGGTGA-3 ′ |
Тест на толерантність до глюкози
Толерантність до глюкози визначали після нічного голодування мишей через 3, 10, 21 та 120 днів DR. Толерантність до глюкози також була визначена на 40% обмежених мишах C57BL/6, переведених на годування AL (DR-AL) з n 10 на групу. Мишам зважували і вводили внутрішньочеревно 20% глюкози (2 г/кг), а рівні глюкози в крові, зібрані з хвоста, вимірювали протягом 120 хв за допомогою глюкометра (Contour NEXT EZ, Bayer, Whippany, Німеччина). Площа під кривою (AUC) для кожної кривої була визначена і представлена як AUC глюкози (ммоль × 120 хв).
Результати
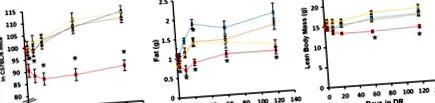
Вплив різних рівнів АД на склад тіла
Раніше дослідження показали, що 40% DR зменшує масу тіла та загальну жирову масу лабораторних гризунів (Barzilai et al. 1998; Mitchell et al. 2016). У цьому дослідженні ми досліджували ранній вплив DR на масу тіла та склад тіла самців мишей C57BL/6, які годувались трьома рівнями DR (10, 20 та 40% DR). Ми ініціювали ДР у віці 4 місяців і стежили за змінами маси тіла та складу протягом 4 місяців, поки вони не досягли 8 місяців. Рисунок Рисунок 1 1 показує масу тіла та склад тіла тварин на 3, 10, 21, 60 та 120 днях DR. Миші, яких годували 10 та 20% DR, не виявляли значних змін у своїй масі тіла порівняно з групою AL у будь-який досліджуваний момент часу (рис. 1, а). З іншого боку, миші в групі 40% DR демонстрували значне зниження маси тіла порівняно з аналогами AL, починаючи з 3 днів DR. У 40% мишей DR спостерігалося зниження маси тіла на 10–15%, що зберігалося протягом 4-місячного дослідження (рис. (Рис. 1а). 1 а). Загальна жирова маса значно зменшилася (
28%) у мишей, які годували 10 і 20% DR через 21 день DR, порівняно з аналогами AL (рис. (Рис. 1b). 1 b). Миші, яких годували 40% DR, продемонстрували значно більше зменшення загальної маси жиру (
67%), починаючи з 10 днів DR (рис. (Рис. 1b). 1 b). М'ясна маса тіла мишей, яких годували 10 і 20% DR, не виявляла істотних змін порівняно з групою AL; однак у мишей, яких годували 40% DR, було значне зменшення (
20%) у своїй нежирній масі тіла, починаючи з 60 днів DR.
Збільшення на 66% та миші, які годували 20% DR, показали
Збільшення співвідношення підшкірний/епідидимальний жир на 36% за рахунок зменшення епідидимального жиру та відсутність змін у підшкірному жирі порівняно з мишами, які годували АЛ. На відміну від цього, миші, які годували 10% DR, не виявляли значної різниці у співвідношенні підшкірного/епідидимального жиру порівняно з мишами, що годувались AL, після 4 місяців DR. Знову ж таки, збільшення співвідношення підшкірний/епідидимальний жир було обумовлено зменшенням епідидимального жиру без суттєвих змін у підшкірному жирі. Наші дані показують, що вплив DR на співвідношення підшкірний/епідидимальний жир змінюється залежно від рівня DR; отже, чим більший рівень DR, тим більше зменшення жиру епідидиму.
Доведено, що короткочасний 40% DR збільшує маркери мітохондріального біогенезу (наприклад, PGC-1α) у багатьох тканинах мишей, включаючи білу жирову тканину (Nisoli et al. 2005; Nisoli et al. 2003; Larrouy et al. 1999; Higami et al. 2004). У нашому дослідженні 40% DR значно підвищували експресію PGC-1α на
75% лише в епідидимальному жирі, але не в підшкірному жирі (рис. (Рис. 3г). 3 г). З іншого боку, 10 та 20% DR не мали значного впливу на експресію PGC-1α в епідидимальному жирі (рис. (Рис. 3d). 3 d). На відміну від епідидимального жиру, підшкірний жир продемонстрував значне зменшення (
40–60%) у експресії PGC-1α для всіх трьох рівнів DR (рис. (Рис. 3г). 3 г). Нарешті, ми оцінили експресію генів, що беруть участь у диференціації адипоцитів (PPAR-γ, CEBP-α та AP-2). Показано, що адипонектин стимулює диференціацію адипоцитів (Fu et al. 2005), і відповідно до цього, 40% DR показав значне збільшення маркерів диференціації адипоцитів як в епідидимальному, так і в підшкірному жирі (рис. (D))., 3 г), обидва з яких також показали значне збільшення адипонектину (рис. (Рис. 3а). 3 а). Епідидимальний жир мишей, яких годували 10% DR, продемонстрував значне збільшення рівня CEBP-α, але не продемонстрував суттєвої різниці в експресії PPARγ-2 та AP-2, тоді як у підшкірному жирі 10% DR не показав значної різниці в будь-якому досліджуваних генів (рис. (рис. 3г). 3 г). Подібним чином, 20% DR також продемонстрував лише значне збільшення CEBP-α в епідидимальному жирі, але на відміну від 10% DR, 20% DR значно збільшив PPARγ-2 та CEBP-α у підшкірному жирі (рис. 3 3 г).
Вплив різних рівнів АД на толерантність до глюкози
Наш аналіз експресії генів обох жирових депо показує диференціальну регуляцію різних маркерів запалення, метаболізм жирних кислот, біогенез мітохондрій та диференціацію адипоцитів між трьома рівнями ДР, що потенційно може відігравати роль у чутливості до інсуліну. Дані лабораторних гризунів та приматів, що не є людиною, показали, що 40% DR постійно знижує рівень глюкози в крові (Masoro et al. 1992; McCarter et al. 2007; Gresl et al. 2001). Крім того, раніше було показано, що DR (40%) покращує толерантність до глюкози на лабораторних моделях гризунів (Escriva et al. 2007; Cameron et al. 2012; Selman and Hempenstall 2012; Mitchell et al. 2016); тому в цьому дослідженні ми розглянули вплив часового курсу всіх трьох рівнів АД на толерантність до глюкози. Малюнок Рисунок 4 4 показує площу під кривими для самців мишей C57BL/6, що харчуються AL, та три рівні DR (10, 20 та 40%). З рис. 4 видно, що 40% DR сильно впливає на толерантність до глюкози. Протягом 10 днів після 40% АД толерантність до глюкози значно покращилася (
20%). Миші, яких годували 40% DR протягом 21 дня, продемонстрували подальше поліпшення толерантності до глюкози
27%, і до 120 днів АД толерантність до глюкози покращилася
40% порівняно з мишами, які годували AL. Таким чином, 40% DR значно покращує толерантність до глюкози протягом 10 днів після її впровадження, а толерантність до глюкози стабільно покращується протягом решти досліджень (рис. (Рис. 4). 4). Як показано на рис. 4, 10 та 20% АД не показали значних змін толерантності до глюкози до 120 днів АД, тоді 10 і 20% АД демонстрували покращення (24 та 36% відповідно) толерантності до глюкози порівняно з аналоги AL. Через 120 днів DR толерантність до глюкози не суттєво відрізнялася для мишей, які годували 10, 20 або 40% DR. Таким чином, хоча кінетика поліпшення толерантності до глюкози змінюється залежно від рівня DR, виявляється, що подібний рівень поліпшення досягається протягом 120 днів.
- Вплив різних дієтичних рівнів DL-метіоніну та аналога DL-гідрокси на антиоксидант
- Вплив різних харчових жирів на рівень гастрину в пілоричній антрумі та плазмі відлучувача
- Вплив глікемічного навантаження їжі на рівень глюкози в крові дорослих з різними індексами маси тіла
- Вплив дієтичного обмеження вуглеводів на ефект зниження глюкози при T2DM
- Вплив харчових поліфенолів на кишкове всмоктування глюкози та фруктози Взаємозв'язок з