Високий протонічний потенціал приводить у дію механізм утворення активних форм кисню в мітохондріях
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Відповідний автор. Факс: (7) (95) 939 03 38 або (7) (95) 939 31 81. Електронна пошта: [email protected] Шукати інші статті цього автора
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Відповідний автор. Факс: (7) (95) 939 03 38 або (7) (95) 939 31 81. Електронна пошта: [email protected] Шукати інші статті цього автора
Кафедра біоенергетики ім. Білозерський інститут фізико-хімічної біології Московського державного університету, Москва 119899, Росія
Анотація
Утворення H2O2 вивчали в мітохондріях серця щурів, попередньо оброблених H2O2 та амінотріазолом, щоб знизити їх антиоксидантну здатність. Показано, що швидкість утворення H2O2 в мітохондріях, окислюючи 6 мМ сукцинату, інгібується протонофорним роз'єднувачем, АДФ і фосфатом, малонатом, ротеноном і міксотіазолом, і стимулюється антиміцином А. Ефект АДФ скасовується за допомогою карбоксиатрактилату та олігоміцину. Додавання розпарювача після ротенону індукує подальше пригнічення вироблення H2O2. Показано, що інгібування утворення H2O2 відпарювачем, малонатом та ADP + Pi пропорційне зменшенню ΔΨ цими сполуками. Виявлено порогове значення ΨΨ, вище якого відбувається дуже сильне збільшення виробництва H2O2. Цей поріг трохи перевищує рівень 3 ΔΨ. Отримані дані відповідають концепції [Скулачов В.П., Q. Rev. Biophys. 29 (1996), 169–202], що висока рушійна сила протону в стані 4 потенційно небезпечна для клітини через збільшення ймовірності утворення супероксиду.
1. Вступ
У 1973 р. Boveris and Chance [1] встановили, що роз'єднувач окисного фосфорилювання (CCCP) або ADP + Pi інгібує утворення H2O2 мітохондріями, окислюючи сукцинат та глутамат. Пізніше Лю та Хуан [2, 3] повідомили про дуже круту залежність продукування O −⋅ 2 та H2O2 мітохондріями від рівня ΔΨ на мембрані мітохондрій. В їх експерименті ΔΨ зменшували, додаючи різні концентрації малонату, що зменшує частоту дихання стану 4. Тому можна припустити, що утворення активних форм кисню (АФК) є функцією транспорту електронів дихального ланцюга, а не ΔΨ.
Наша група запропонувала [4-6], що активація вироблення АФК у стані 4, коли протонний потенціал високий, а частота дихання обмежена відсутністю АДФ, пов'язана з тим, що деякі перехідні процеси транспорту електронів дихального ланцюга здатні зменшувати Від O2 до O −⋅ 2, такі як CoQH ⋅, стають довгожителями. Передбачалося, що мітохондрії оснащені спеціальним механізмом (`` м'яке розчеплення ''), що запобігає занадто високому протонному потенціалу.
У цій роботі ми повторно досліджуємо проблему мітохондріальних АФК-протонних потенційних зв'язків. Було виявлено, що будь-яке зниження стану 4 ΔΨ призводило до сильного пригнічення утворення H2O2 мітохондріями незалежно від того, додавали активатори (розпарювач або ADP + Pi) або інгібітори (малонат) транспорту електронів, щоб спричинити зниження ΔΨ. Виявлено порогове значення ΨΨ, необхідне для підвищення рівня генерації H2O2.
2 Матеріали та методи
Мітохондрії були виділені із серцевого м’яза щурів. Охолоджені м'язи, очищені від жиру і сухожиль, подрібнювали і пропускали через прес з нержавіючої сталі з отворами діаметром близько 1 мм. Потім тканину гомогенізували протягом 3 хв тефлоновим маточкою у скляному (Pyrex) гомогенізаторі, співвідношення тканина: ізоляційна суміш становило 1: 8. Після першого центрифугування (10 хв, 700 ×g), супернатант декантирували і фільтрували через марлю, потім центрифугували (10 хв, 16000 ×g). Осад суспендували в 1 мл ізолюючої суміші (250 мМ сахарози, 10 мМ MOPS, 1 мМ EDTA, рН 7,4) з додаванням BSA (3 мг/мл). Потім суміш ще раз центрифугували і промивали ізолюючим середовищем без BSA (10 хв, 16000 ×g). Остаточний мітохондріальний осад суспендували в ізолюючій суміші (70–90 мг білка/мл) і зберігали на льоду.
У всіх експериментах, показаних на малюнках, вищевказану процедуру доповнювали обробкою мітохондрій 2 мМ H2O2 та 7 мМ амінотріазолом, які додавали до супернатанту перед другим центрифугуванням.
Споживання кисню реєстрували за допомогою кисневого електрода типу Кларка та полярографа Rank Brothers.
Рівень ΔΨ оцінювали за допомогою сафраніну О. Співвідношення барвника (нмоль) до білка мітохондрій (мг) становило 20: 1. Слід зазначити, що було показано, що реакція сафраніну O лінійно залежить від ΔΨ в області 50–170 мВ [7-9] .
Вироблення H2O2 вимірювали методом скополетин/пероксидаза хрону [10]. Реакція флуоресценції скополетину була відкалібрована за допомогою глюкози/глюкозооксидази [11] та додаванням відомих кількостей H2O2. На рис. 3 і 4, показники виробництва пероксиду водню виражаються у відсотках від норми, яка була отримана в мітохондріях штату 4. Ця швидкість становила 0,14 ± 0,04 нмоль H2O2/хв/мг білка.
Олігоміцин, антиміцин А, SF6847 та ротенон розчиняли у двічі дистильованому етанолі. Спочатку всі реагенти були протестовані, щоб уникнути втручання в аналіз скополетин/пероксидаза.
EDTA, EGTA, ротенон та скополетин були від Serva; ADP, олігоміцин, MOPS, БСА без жирних кислот, каталаза, антиміцин А та амінотріазол були від Sigma; 30% H2O2 було від Merck.
3 Результати
У літературі немає єдиної думки щодо здатності мітохондрій виробляти вимірювані кількості АФК у стані 4. Деякі автори описують таке виробництво [1, 10-12], інші не роблять цього [13] або досягли успіху за особливих умов ( наприклад, лише у випадку, коли застосовували високу концентрацію сукцинату [14]).
У наших руках швидкість вироблення H2O2 у стані 4 була незначною, але зростала під час зберігання ізольованих мітохондрій. Було висловлено припущення, що таке збільшення зумовлене виснаженням ендогенних мітохондріальних антиоксидантів (наприклад, відновленого глутатіону). Щоб стимулювати цей процес, ми модифікували процедуру виділення мітохондрій, включивши коротку обробку H2O2 на етапі промивання мітохондрій розчином BSA на холоді. Промивну суміш доповнювали 2 мМ H2O2 та 7 мМ амінотріазолом, інгібітором каталази. Ця модифікація дала мітохондрії, які завжди виробляють H2O2 із вимірюваною швидкістю при окисленні 6 мМ сукцинату в стані 4. Мітохондрії, оброблені H2O2, демонструють 3,5–4-кратне стимулювання дихання стану 4 роз’єднувачами.
1 показує вплив розчеплювачів та інгібіторів дихання на продукцію H2O2 мітохондріями серця щурів, попередньо обробленими H2O2 та амінотріазолом. Видно (рис. 1, верхня крива), що дуже низька концентрація відпарювача (1 × 10 −9 M SF6847) сильно пригнічує вироблення 4 H2O2 стану. Здається, цей ефект обумовлений роз'єднувальною активністю SF6847, а не іншими можливими ефектами цієї сполуки, оскільки 6-кетохолестанол, рекупелер, специфічний для SF6847 та похідних карбонілціаніду фенілгідразону [15, 16], спричинив тимчасову активацію генерації H2O2, інгібованої SF6847. Подальше додавання антиміцину сильно стимулювало вироблення H2O2, що підтверджує оригінальні спостереження Боверіса та Шанса [1] .
Хенсфорд та його колеги [14] повідомили, що виробництво АФК державними 4 мітохондріями у присутності високої концентрації сукцинату затримується ротеноном. Вони припустили, що NADH-CoQ-редуктаза відповідає за все утворення АФК дихальним ланцюгом. Ми виявили (рис. 1, нижня крива), що ротенон дійсно інгібує виробництво H2O2 в результаті окиснення сукцинату 4, але вимірювана швидкість (близько 20%) утворення H2O2 все ще спостерігається після додавання насичуючої концентрації ротенону. Після ротенону добавки SF6847 та антиміцин А були інгібуючими та стимулюючими відповідно. Відповідно до деяких попередніх спостережень (для огляду див. [17]), міксотіазол, доданий після антиміцину А, сильно пригнічує вироблення H2O2.
Стан 4-стану 3 переходу також пригнічує генерування H2O2 мітохондріями серця. Рис. 2 показує, що додавання Pi та ADP майже повністю скасувало виробництво H2O2. Інгібітори АТФ-синтази (олігоміцин) або АДФ/АТФ-транслокази (карбоксиатрактилат) запобігали дії АДФ.
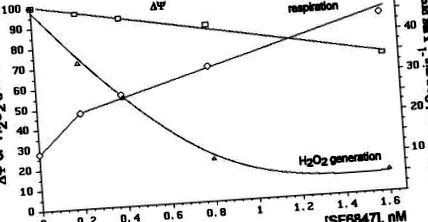
Вплив різних концентрацій SF6847 на дихання мітохондрій, рівень ΔΨ та швидкість утворення H2O2 порівняно на рис.3. Видно, що утворення H2O2 є найбільш чутливим параметром. Наприклад, 8 × 10 −10 М SF6847 спричинили незначне зменшення мембранного потенціалу (приблизно на 13%), збільшення частоти дихання у 2,2 рази та інгібування вироблення H2O2 приблизно на 80%.
Дуже круту залежність утворення H2O2 від ΔΨ ілюструє рис.4. Рівень ΔΨ варіювали шляхом додавання ADP та Pi або різних концентрацій SF6847 або малонату.
4 Обговорення
Не дивно, що деякі особливі умови, такі як попередня обробка H2O2 та амінотріазолу та висока концентрація сукцинату, необхідні для отримання вимірюваної генерації H2O2 мітохондріями в стані 4; інакше клітина була б отруєна АФК у будь-якому випадку, коли АДФ вичерпався. Таке виснаження трапляється досить часто, напр. у м’язах під час переходу активності у спокій. Ось чому ми постулювали [4-6] про існування в мітохондріях механізму (який називається `` м'яким розчепленням ''), що робить підтримку протонічного потенціалу неможливим на рівні, який істотно перевищує порогове значення, критичне для швидкого формування АФК (рис.4). ). Передбачалося, що розглянутий механізм знаходиться під контролем щитовидної залози, пов’язаний з неомічним опором мембрани мітохондрій [5, 6] .
Неомічність внутрішньої мітохондріальної мембрани (сильне збільшення провідності H + при високих рівнях протонного потенціалу) було запропоновано бути першим напрямком антиоксигенного захисту аеробної еукаріотичної клітини. Не вдається зберегти комірку, напр. коли дихальний ланцюг інгібується антиміцином А або (у разі пов'язаних з NAD субстратів) ротеноном. Таке гальмування спричинене досить широким спектром гідрофобних ксенобіотиків.
З іншого боку, індуковане антиміцином A генерування H2O2 сильно інгібується міксотіазолом ([17] та у цій роботі), що запобігає окисленню CoQH2 до CoQH ⋅ у Q-циклі. Той самий ефект викликає ціанід [19] та екстракція цитохрому c ([17] та Симонян, Скулачов та Старков, що готуються). Більш того, міжмембранний цитохром c може (i) організувати байпас продукуючих супероксид стадій дихального ланцюга через NADH-цитохром b 5 редуктаза та цитохром b 5 в деяких тканинах та (ii) окислюють O −⋅ 2 до O2, запобігаючи утворенню H2O2.
Нещодавно повідомлялося про вивільнення мітохондріального цитохрому c є фізіологічним явищем, яке бере участь в апоптозі [20-24]. З іншого боку, ми припустили, що індукований АФК апоптоз, механізм очищення тканини від клітин, що продукують АФК, являє собою останню лінію антиоксигенного захисту організмів [4-6]. Таким чином, наступний ланцюг подій може бути припущений про участь у захисті від кисню: (i) легке розчеплення, (ii) вивільнення цитохрому c, (iii) цитохром c‐ Опосередкований апоптоз.
Подяки
Описані тут дослідження частково стали можливими завдяки гранту RFBR 95‐04‐12799.
- Довгострокові ефекти високоліпідної та високоенергетичної дієти на сироваткові ліпіди, склад жирних кислот мозку,
- Харві Даймонд Від життєвого життя до низького рівня - Новини - Sarasota Herald-Tribune - Sarasota, FL
- Як визначаються нормальні дієти з високим або низьким вмістом білка, визначені в British Journal of Nutrition Cambridge Core
- Кава всередині природного максимуму, що підмітає Америку - рухомий камінь
- In Vivo гіпохолестеринемічний ефект екстракту води з ферментованого червоного дріжджового рису MARDI у високій концентрації