Менший ризик раку, пов’язаного з курінням, у осіб із сімейною гіперхолестеринемією порівняно з контролем: перспективне збіжне когортне дослідження
Предмети
Анотація
Відповідно до рекомендацій, особи з сімейною гіперхолестеринемією (ФГ) повинні отримувати втручання у спосіб життя та інтенсивне зниження рівня ліпідів з самого початку життя, щоб зменшити ризик ішемічної хвороби серця. Нашою метою було вивчити, чи може лікування FH також впливати на ризик раку, пов'язаного із способом життя. Ми представили сукупну частоту захворювань на загальний рак та ділянки раку, пов’язані із способом життя, у осіб із генетично підтвердженим FH (n = 5531) порівняно з контролем за віком та статтю (n = 108354). Особи з ФГ мали на 20% менший ризик раку, пов'язаного з курінням, порівняно з контрольною популяцією [HR 0,80 (95% ДІ, 0,65-0,98)], зокрема чоловіки з ФГ у 40–69 років у віці діагнозу з ЧСС 0,69 ( 95% ДІ, 0,49–0,97). Популяція FH та контролі мали подібні показники загального раку [HR 0,97 (95% ДІ, 0,86–1,09)], раку, пов’язаного з неправильним харчуванням [HR 0,82 (95% CI, 0,59–1,15)], раку, пов’язаного з фізичною неактивністю [ HR 0,93 (95% ДІ, 0,73–1,18)], пов’язаний з алкоголем рак [HR 0,98 (95% ДІ, 0,80–1,22)] та рак, пов’язаний з ожирінням [HR 1,03 (95% ДІ, 0,89–1,21)]. Підводячи підсумок, ми виявили знижений ризик раку, пов'язаного з тютюнопалінням, у осіб з ФГ, швидше за все, через меншу поширеність куріння. Наслідками цих висновків може бути посилена мотивація і, отже, відповідність лікуванню гіперхолестеринемії.
Вступ
Матеріали і методи
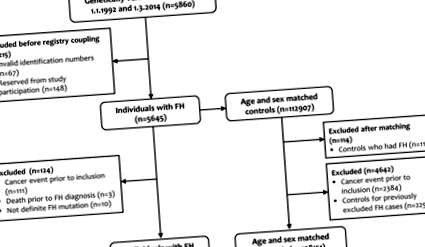
Дизайн дослідження та сукупність
Блок-схема осіб із сімейною гіперхолестеринемією (FH) та контролем за віком та статтю, включеним у дослідження.
Це дослідження було схвалено Регіональним комітетом з питань етики медичних та медичних досліджень у Південно-Східній Норвегії (посилання 2011/1343 REK Sør-Øst B), норвезьким офіцером з питань захисту даних університетської лікарні Осло та відповідає Гельсінській декларації. Зважаючи на характер цього дослідження, ми отримали звільнення від обов'язку отримувати поінформовану згоду з боку населення ІХ та органів контролю. Однак особи, які страждають на ЗГ, були проінформовані про це дослідження листом інформації та отримали можливість відхилити прив'язку їхньої інформації до реєстрів, як описано раніше 7,10 .
Результати раку
Популяція FH та засоби контролю були пов’язані (за допомогою 11-значного персонального ідентифікаційного номера, унікального для кожного жителя Норвегії) з Реєстром раку Норвегії (CRN) та Норвезьким реєстром причин смерті (NCoDR) з метою отримання інформації про рак захворюваність та смертність (основна причина смерті у свідоцтвах про смерть). Кінцеві точки визначали відповідно до Міжнародної класифікації хвороб (МКБ), версія 10 (МКБ-10), а для NCoDR також коди МКБ-9 (1992–1995). Усі коди МКБ-9 були перетворені в коди МКБ-10, які показані в таблиці 1.
Як зазначалося раніше, ССЗ та рак мають кілька спільних факторів ризику, пов'язаних із способом життя 6. Ми визначили та класифікували типи раку за даними Всесвітнього фонду з вивчення раку (WCRF) та Американського інституту досліджень раку (AIRC) та Фактів та цифр раку від Американського товариства раку (ACS), які визначили групи раку, пов’язаного із способом життя 11,12. Фактори ризику, які відповідно до WCRF & AICR та ACS мають достатні або вагомі (або переконливі, або ймовірні) докази, що викликають рак у людей, були включені в дослідження 11,12. Отже, сайти раку, пов’язані із способом життя, включали рак, пов’язаний з курінням 11, рак, пов’язаний з неправильним харчуванням [споживання червоного та переробленого м’яса, низьке споживання клітковини та цільнозернових продуктів та низьке споживання кальцію в раціоні], рак, пов’язаний з фізичною неактивністю, пов’язаний із алкоголем рак та рак, пов’язаний з жировістю тіла та збільшенням маси тіла 12, як показано з відповідними кодами МКБ-10 у таблиці 1.
Статистичний аналіз
Результати
Частота загального раку та згрупованих ракових захворювань, пов’язаних із способом життя, для популяції ЗГ та контрольної популяції зведені в Таблицю 1. Базові характеристики досліджуваних популяцій наведені в Таблиці 2. Вік на вихідному рівні відповідає віку при генетичному діагнозі СГ для більшості вибірки і становив 33,7 ± 18,9 у популяції FH (n = 5521) та 33,2 ± 18,7 у контролі за віком та статтю (n = 108151) (Таблиця 2).
Тотальний рак
У загальній складності 289 випадків раку спостерігалося у популяції FH та 5579 випадків у контрольній популяції (Таблиця 1). У популяції FH загальна кількість років спостереження становила 71253, а середній час діагностики раку серед тих, у кого розвинувся рак, становив 8,7 років. У контрольній популяції відповідні цифри становили 1366647 людських років та 8,8 років відповідно. Як проілюстровано на рис. 2А, крива кумулятивної захворюваності на загальний рак зростала з віком, аналогічно для популяції FH та контрольних груп. Загальна частота спостереження на тисячу людських років становила 3,99 (95% ДІ, 3,88–4,09) у контрольній популяції та 4,06 (95% ДІ, 3,61–4,55) у популяції ІХ. Рівень захворюваності на загальний рак для популяції ЗГ порівняно з контрольною популяцією становив 0,97 (95% ДІ, 0,86–1,09) (табл. 1). Подібним чином не спостерігалося суттєвої різниці в загальному рівні раку між популяцією FH та групами контролю, стратифікованими чоловіками [HR 0,97 (95% ДІ, 0,82–1,15)] та жінками [HR 0,98 (95% CI, 0,83–1,15)], а також будь-яка з трьох вікових груп (0–39, 40–69 та вік 70 років + на початку) (Таблиця 3).
(A,B) Крива кумулятивної захворюваності на загальний рак (A) та рак, пов’язаний з курінням (B) у осіб з сімейною гіперхолестеринемією (FH) порівняно з відповідними контролями, стратифікованими за статтю та віком (включення до реєстру UCCG) як часовий масштаб.
Рак, пов’язаний із способом життя
У популяції FH ми спостерігали 97 випадків раку, пов'язаного з курінням, тоді як у контрольної популяції спостерігали 2220 випадків. Особи з FH мали на 20% нижчий ризик раку, пов’язаного з курінням, порівняно з контрольною популяцією [HR 0,80 (95% ДІ, 0,65–0,98)]. У віковій групі 40–69 років на початковому рівні популяція ЛЖ мала на 27% менше шансів мати рак, пов’язаний з курінням, порівняно з контролем, як це було продемонстровано з показниками ЧСС 0,73 (95% ДІ, 0,57–0,94). Найбільш сильний відносний знижений ризик спостерігався у чоловіків із ЗГ у віці 40–69 років на початковому рівні, де рівень захворюваності на рак, пов’язаний з курінням, на тисячу осіб років становив 3,94 (95% ДІ, 3,69–4,20) порівняно з 2,85. (95% ДІ, 2,04–3,99) для контролів [ЧСС 0,69 (95% ДІ, 0,49–0,97]. Відповідна ЧСС для жінок у віці 40–69 років становила 0,79 (95% ДІ, 0,56–1,13) (Таблиця 4 та Рис. . 2B).
Наш відповідний аналіз також показав, що показник HR для раку, пов’язаного з неправильним харчуванням, для жінок та чоловіків разом становив 0,82 (95% ДІ, 0,60–1,15) (табл. 1). Було 14 випадків захворюваності на рак, пов’язаний з неправильним харчуванням для жінок із СР, та 434 серед контрольної популяції жінок, що призвело до показника ЧСС 0,59 (95% ДІ, 0,35–1,01). Відповідна ЧСС для чоловіків становила 1,10 (95% ДІ, 0,71–1,69) (Додаткова таблиця 1). Не було різниці в оцінках ризику між загальною популяцією FH та контролем щодо раку, пов’язаного з фізичною неактивністю [HR 0,93 (95% ДІ, 0,73–1,18)], алкогольного раку [HR 0,98 (95% CI, 0,80–1,22) ] та рак, пов’язаний із вгодованістю тіла та збільшенням ваги [HR 1,03 (95% ДІ, 0,89–1,21)] (Таблиця 1). Також не було ніяких відмінностей, коли популяції були стратифіковані за статевими та віковими групами (Додаткові таблиці 2–4).
Обговорення
Ми виявили, що мутація FH була пов'язана з 20% зниженням ризику раку, пов'язаного з курінням, але відсутність зниження ризику загального раку після медіани 8,7 років спостереження. Результати свідчать про те, що лікування FH, призначене для зниження ризику ССЗ, може також зменшити ризик раку.
Раніше ми показували, що смертність від раку серед осіб із СР є подібною до смертності серед норвезького населення 13. Поточні дані, включаючи випадки, що не призвели до летального результату, з майже у вісім разів більше подій та відповідну контрольну сукупність підтримують і поширюють наші попередні висновки. Важливо, що значний знижений ризик раку, пов’язаного з курінням, у ЗГ узгоджується з результатами Реєстру Саймона Брума, що повідомляють про знижений ризик летального результату [стандартизований коефіцієнт смертності 0,70 (95% ДІ, 0,59–0,83)], головним чином, завдяки меншому ризику раку, пов'язаного з курінням, такого як рак дихальної системи та лімфатичної системи 14,15 .
Рак легенів, який найбільше сприяє розвитку раку, пов'язаного з курінням, є одним із найпоширеніших місць раку в Норвегії, особливо серед чоловіків 16,17. Наші результати показують, що чоловіки з ІХ у віці 40–69 років на початковому рівні мали на 31% нижчий ризик раку, пов’язаного з курінням, ніж їх відповідні контролі, що не стосувались ФГ. ACS вважає куріння сильним фактором ризику для онкологічних місць, включених до заздалегідь визначеної групи раку, пов'язаного з курінням 11. Отже, знижений ризик, який спостерігається у групі FH, швидше за все, спричинений меншим курінням у осіб із FH, ніж у контрольних груп. Дійсно, у 2014–15 рр. 9% субопроби населення ЗГ в цьому дослідженні були справжніми курцями 18, порівняно з 13% загальної сукупності 19, і подібні відмінності підтримуються іншими 20. Крім того, дослідження SAFEHEART повідомило, що 2404 дорослі особини з ІХ курили менше, ніж їх постраждалі брати та сестри 5. Ніл та його співробітники також припустили, що зниження смертності від раку при ЗГ може бути пов'язане з наслідками регулярного медичного контролю, включаючи ранню та постійну консультацію щодо способу життя з самого початку життя, що призводить до кращого прогнозу 14,15 .
Однак у цьому дослідженні випадки раку, пов'язані з неправильним харчуванням або фізичною неактивністю, не суттєво зменшились у популяції ІХ, за винятком тенденції до зниження ризику раку, пов'язаного з неправильним харчуванням, у жінок із СР у порівнянні з контролем, з РС 0,59 (95% ДІ, 0,35–1,01). Подальше вивчаючи ризик розвитку лише колоректального раку, на який припадає більшість ракових захворювань, пов’язаних з неправильним харчуванням серед норвезького населення, ми виявили показник HR у 0,55 (95% ДІ, 0,31–0,98) у жінок із ЗГ порівняно з контролем (n = 12/2850 для FH та n = 400/55547 для контролів відповідно). Колоректальний рак - друге місце за частотою онкологічних захворювань у норвезьких жінок 16. Однак ці результати пост-аналізу та невеликої кількості слід інтерпретувати з обережністю, і є необхідною додаткова інформація про фактори ризику колоректального раку. Ми не можемо виключити можливість того, що мутація FH як така може захистити від раку, але це менш правдоподібно з нинішньої біологічної точки зору.
Не було різниці в частоті захворюваності на рак, пов’язаний з алкоголем, а також на рак, пов’язаний із вгодованістю та збільшенням маси тіла, між популяцією FH та відповідними контролями. У цьому дослідженні середній вік при генетичному діагнозі та передбачуваному започаткуванні рекомендацій щодо способу життя та зниження рівня ліпідів у когорті FH становив 33 роки, 25-процентиль 17 років та 75-процентиль 47 років. Для тих, хто отримав діагноз FH пізно в житті, будь-який нездоровий спосіб життя перед діагностикою, можливо, вже вплинув на ризик розвитку раку, внаслідок чого будь-які зміни способу життя матимуть слабший вплив на ризик раку, ніж передбачалося. З іншого боку, також може бути так, що сприятливим змінам дієти та способу життя не легше дотримуватись для осіб з FH, ніж контролю.
Сильні сторони цього дослідження включають велику когорту генетично підтверджених FH та відповідних контролів та тривалий час спостереження. Оскільки мутація FH успадковується випадково від батьків-гетерозиготів у різних соціально-економічних шарах, немає необхідності пристосовуватися до соціально-економічного статусу. Крім того, використання реєстрів на основі популяції для збору кінцевих точок майже не забезпечило втрат для подальшого спостереження. Включення даних з NCoDR на додаток до CRN, дозволило нам врахувати смертність як конкуруючі події, а отже, посилити наші результати спостережуваного ризику раку в популяції FH. Кількість людських років спостереження становила 71253, що більше, ніж будь-яке інше дослідження, що вивчало ризик раку у осіб з генетично підтвердженим FH.
25000) діагностовано, поточна вибірка може не відображати загальну чисельність населення в Норвегії 9. Низький рівень бронювання (2,5%) до дослідження посилює репрезентативність результатів.
Висновок
Підсумовуючи, мутація FH та відповідне лікування асоціювались із зниженим ризиком розвитку раку, пов’язаного з курінням, у популяції FH порівняно з відповідними контролями, швидше за все, через меншу поширеність куріння серед популяції FH. Не було різниці у ризику розвитку загального раку та раку, пов’язаного з неправильним харчуванням, фізичною неактивністю, споживанням алкоголю та вгодованістю та збільшенням маси тіла між популяцією FH та контрольною популяцією.
- Дієта з низьким вмістом жиру може зменшити ризик раку молочної залози в Інтернеті
- Здорова рослинна дієта, пов’язана із значно меншим ризиком діабету 2 типу. Джерело харчування
- Як зменшити ризик раку молочної залози Кедри-Синай
- Інфекція вірусом гепатиту В та ризик розвитку носоглоткової карциноми в раку Південного Китаю
- Симптоми високого кров’яного тиску Додайте яблука у свій раціон, щоб знизити ризик гіпертонії