Галактоза
Галактоза (Gal) метаболізується до глюкозо-1-фосфату через шлях Лелуара для гліколізу, цей шлях підтримує пули UDP-цукрів для біосинтезу глікокон'югатів.
Пов’язані терміни:
- Лактоза
- Глюкоза
- Вуглеводи
- Ферменти
- Білки
- Полісахариди
- Глюконати
- Арабіноза
- Манноза
- Сахароза
Завантажити у форматі PDF
Про цю сторінку
ГАЛАКТОЗА
Виникнення
Галактоза є моносахаридом і має ту ж хімічну формулу, що і глюкоза, тобто C 6H12O6. За своєю структурою він подібний до глюкози, відрізняючись лише положенням однієї гідроксильної групи. Однак ця різниця надає галактозі різні хімічні та біохімічні властивості глюкозі.
Основним харчовим джерелом галактози є лактоза - дисахарид, що утворюється з однієї молекули глюкози плюс однієї з галактози. Лактоза міститься лише в молоці; після відлучення значна кількість харчової лактози міститься лише в молочних продуктах (табл. 1). Рівень лактози нижчий, ніж очікувалось, у деяких молочних продуктах, де її використовували мікроби, задіяні в обробці їжі.
Таблиця 1. Вміст лактози в молоці та молочних продуктах
| Коров’яче молоко | 4.7 |
| Козяче молоко | 4.6 |
| Людське молоко | 7.2 |
| Вершкове масло | Слід |
| Вершки | 2,0–3,2 |
| Сир (більшість видів) | Слід |
| Сир | 1.4 |
| Йогурт | 3,2–4,8 |
З Пола А.А. та Саутгейта DAT (1978) Макканса та Віддоусона `` Склад продуктів '', 4-е вид. Лондон: канцелярське бюро Її Величності.
Лактоза, побічний продукт молочної промисловості, може бути гідролізована з отриманням сиропу гідролізату лактози, який містить лактозу, галактозу та глюкозу. Цей сироп використовується як підсолоджувач для печива, кондитерських виробів та деяких молочних десертів. Таким чином, невелика кількість лактози та галактози може з’являтися в немолочній їжі. (Див. Лактоза.)
Окрім присутності в сиропі гідролізату лактози, моносахарид галактоза рідко зустрічається в раціоні, хоча вона була визначена як мікроелемент деяких насіння та бобових культур.
Харчування та здоров'я: галактоземія
Вступ
Галактоза - енергетична поживна речовина, а також необхідний основний субстрат для біосинтезу багатьох макромолекул в організмі. Галактоза є важливою складовою складних полісахаридів, які входять до складу клітинних глікокон'югатів, ключових елементів імунологічних детермінант, гормонів, структур клітинних мембран, ендогенних лектинів та багатьох інших глікопротеїдів. Крім того, галактоза вбудовується в галактоліпіди, які є важливими структурними елементами центральної нервової системи.
Метаболічні шляхи галактози важливі не тільки для забезпечення цих макромолекул, але й для запобігання накопиченню метаболітів галактози та галактози. Проблеми з метаболізмом галактози, що призводять до галактоземії, можуть спричинити різні клінічні прояви у людей.
Порушення метаболізму галактози
Діагностичні тести
Слід запідозрити дефіцит GALE, коли підвищена кількість еритроцитів галактози -1-фосфату, тоді як GALT є нормальним. Скринінг новонароджених дасть ненормальний результат, якщо він визначається підвищеним загальним рівнем галактози в крові при нормальній активності GALT. Діагноз підтверджується аналізом епімерази в еритроцитах. Батьки-гетерозиготи мають знижену активність епімерази, що може допомогти в оцінці. Подальші дослідження активності GALE у трансформованих лімфобластах та еритроцитах галактоза-1-фосфаті під час вживання та відключення дієтичної галактози можуть допомогти в подальшій характеристиці розладу. 97 У тих сім'ях, у яких є важка форма дефіциту GALE, секвенування генів GALE було найшвидшим методом визначення того, чи постраждали немовлята, які перебувають під загрозою чи ні.
Біосинтез вітамінів у рослинах, частина В
G l -галактозадегідрогеназа
l -GalDH каталізує NAD + -залежне окислення l -Gal при C1 з утворенням l -галактоно-1,4-лактону (Gatzek et al., 2002). Ємність ферменту, здається, відносно висока, оскільки екзогенно поставлений l -Gal та його продукт реакції l -галактонолактон (l -GalL) дуже швидко перетворюються в аскорбат, що призводить до значного збільшення розміру аскорбатного пулу (Davey et al., 1999; Wheeler та ін., 1998). Активність Arabidopsis l -GalDH кодується At4g33670. Докази його ролі в біосинтезі аскорбату отримані завдяки зменшенню рівня аскорбату у рослин, де експресія l -GalDH зменшилась шляхом антисенсорного придушення. Фермент має високу специфічність щодо l -Gal (Arabidopsis Km 0,4 мМ, шпинат Km 0,1 мМ) і значно нижчий Vmax і нижчу спорідненість до l -гулози (Km 4 мМ) та l -фукози (Km 56 мМ) (Gatzek et al., 2002; Mieda et al., 2004). Очищений шпинат l -GalDH конкурує за допомогою аскорбату (Mieda et al., 2004). Значення Ki 0,1 мМ значно перевищує виведену концентрацію аскорбату в цитозолі (табл. I), що свідчить про те, що фермент можна регулювати за допомогою інгібування зворотного зв'язку.
Таблиця I. Концентрації аскорбату (мМ) у внутрішньоклітинних відділах листкових клітин у рослин, вирощених під низьким або високим рівнем опромінення (одиниці: мкмоль фотонів м - 2 с - 1)
| Арабідопсис | 250 | 21 | 10 | 10 | 23 | 16 | 2 |
| 700 | 29 | 20 | 13 | 16 | 21 | 12 | |
| Ячмінь | 100 | 35 | 2 | п. д. | п. д. | п. д. | 0,6 |
| 500 | 61 | 10 | п. д. | п. д. | п. д. | 3 |
Концентрацію арабідопсису оцінювали на основі локалізації імунозолотого з аскорбатними антитілами, використовуючи дані Zechmann et al. (2010). Дані про ячмінь отримували шляхом неводного фракціонування (Rautenkranz et al., 1994). н.д., не визначено.
Летять моделі людських хвороб
3.3 Використання дрозофіли для аналізу диференціальних ролей GALE у розвитку
Роботи, описані в цьому розділі, належать Даенцеру, Сандерсу, Хангу та Фрідовичу-Кейлу (2012), якщо не зазначено інше.
3.3.1 Роз’єднання двох видів діяльності GALE у дрозофіли
GALE від людей і дрозофіли перетворює два набори субстратів: UDPgal/UDPglc та UDPgalNAc/UDPglcNAc (рис. 1). Щоб роз’єднати та перевірити ролі розвитку цих видів діяльності в індивідуальному порядку, Даенцер та його колеги створювали мух із активністю лише до одного чи іншого набору субстратів. Ця специфічність субстрату була досягнута шляхом ефективної заміни експресії dGALE на експресію будь-якого з двох генів прокаріотичної епімерази, кожен з яких кодує продукт, здатний взаємоперетворювати лише одну пару субстратів: eGALE, який взаємодіє лише UDPgal/UDPglc та wbgU, який взаємодіє лише UDPgalNAc/UDPglcNAc . Експресія цих мікробних трансгенів у дефіцитній dGALE дрозофілі призвела до того, що тварини мали лише ту чи іншу активність GALE.
3.3.2 Обидві заходи GALE відіграють важливу роль під час розвитку
Як пояснювалося раніше, Sanders et al. (2010) показали, що GALE є важливим для розвитку дрозофіли, і що дефіцитні dGALE тварини гинуть в ембріогенезі. Висловлюючи лише eGALE, лише wbgU або як eGALE, так і wbgU разом у зародках з дефіцитом dGALE, Daenzer та його колеги підтвердили, що активність GALE щодо обох пар субстратів є важливою для виживання дрозофіли. Зокрема, ні один мікробний трансген не дав змоги вижити, але разом вони це зробили, і далі, hGALE, який подібно до dGALE розпізнає обидві пари субстрату, також був достатнім.
3.3.3 Активність GALE щодо UDPgal/UDPglc необхідна для нормальної тривалості життя дорослої дрозофіли, яка зазнає дієтичної галактози
3.3.4 Дві дії GALE по-різному впливають на рівень метаболіту галактози
Хоча очевидно, що дрозофіла з порушеннями розвитку dGALE має різноманітні гострі та довгострокові наслідки, патофізіологія цих наслідків залишається незрозумілою. Даенцер та його колеги отримали деяке уявлення про патофізіологію, вивчаючи рівень метаболітів галактози у тварин з різними вадами. Наприклад, дрозофіла, у якої нокдаун dGALE відбувся на початку розвитку, накопичила дуже високий рівень Gal-1P під впливом галактози у вигляді личинок. Ці личинки також накопичували дуже високий рівень UDPgal. Подібним чином, личинки, дефіцитні лише за активністю щодо UDPgal/UDPglc, накопичували дуже високі рівні як Gal-1P, так і UDPgal, коли вони розвивались у присутності, але не у відсутність, високої дієтичної галактози. На відміну від цього, тварини, у яких недостатня активність GALE щодо UDPgalNAc/UDPglcNAc, не накопичували аномальних рівнів ні Gal-1P, ні UDPgal. Тим не менше, ці тварини були нежиттєздатними. Очевидно, що підвищений рівень Gal-1P та UDPgal не може бути єдиною причиною патофізіології при дефіциті GALE.
Вуглеводи, спирти та органічні кислоти
Обмін речовин
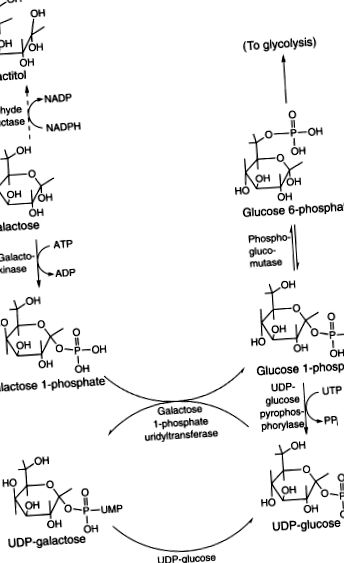
Гал переважно перетворюється на глюкозний л-фосфат, а потім у глюкозо-6-фосфат у печінці (рис. 6.14). Незначний альтернативний шлях існує, але його слід охарактеризувати (Berry et al., 2001). Початковим критичним етапом є фосфорилювання галактокіназою (EC2.7.1.6). Існують дві генетично відмінні ізоформи ферменту з різним розподілом по тканинах. Накопичення галактитолу в лінзах осіб з дефектною галактокіназою 1 може спричинити катаракту в дитинстві або на початку дорослого віку. Наступним етапом метаболізму Gal є перенесення UDP за допомогою UDP-глюкоза-гексоза-i-фосфат-уридилілтрансферази (EC2.7.7.12). UDP-глюкоза-4′-епімераза (EC5.1.3.2) епімеризує UDPGal до UDP-глюкози. Оскільки UDP-глюкоза знову забезпечує UDP для наступної молекули Gal 1-фосфату, це працює як автокаталітичний механізм із чистою конверсією Gal 1-фосфату в глюкозу 1-фосфат. Магнійзалежна фосфоглюкомутаза (EC5.4.2.2; дві ізоформи, PGM1 і PGM2) перетворює глюкозу 1-фосфат у легко метаболізується проміжний 6-фосфат глюкози. Альтернативно Gal може бути відновлений до галактитолу за допомогою НАДФН-залежної альдегідредуктази (альдозоредуктази, EC1.1.1.21), особливо за наявності надлишку Gal.
Малюнок 6.14. Метаболізм Гал.
Порушення метаболізму вуглеводів
93.4.1 Метаболізм галактози
Галактоза, що входить до складу лактози, є важливою поживною речовиною для новонароджених та немовлят. У грудному молоці людини вміст лактози становить близько 7 г/дл, а в коров’ячому молоці - приблизно 5 г/дл. У новонародженого немовляти лактоза може забезпечувати до 40% споживання калорій, але лише 3–4% у дорослого через пропорційно нижче споживання молока. Галактоза також є складовою багатьох глікопротеїдів, гліколіпідів та мукополісахаридів.
Основним шляхом метаболізму галактози був визначений шлях Лелуара (рис. 93-2). Галактоза фосфорилюється до галактозо-1-фосфату за допомогою ферменту галактокінази. Галактоза-1-фосфат обмінюється на глюкозо-1-фосфатну частину глюкози уридиндифосфату (UDPG), утворюючи уридиндифосфат галактозу (UDPGal) за допомогою галактозо-1-фосфат уридилтрансферази (трансферази або GALT). Вивільняється глюкоза-1-фосфат веде в шлях глюкози. Утворений UDPGal перетворюється в UDPG за допомогою ферменту UDPGal-4-епімерази (епімерази). Сума цих трьох ферментативних реакцій за участю галактокінази, трансферази та епімерази становить
РИСУНОК 93-2. Шляхи метаболізму галактози.
Галактоза + аденозинтрифосфат (АТФ) = Глюкоза-1-фосфат + аденозиндифосфат (АДФ).
UDPGal також використовується для синтезу галактозосодержащих складних вуглеводів. Невелика кількість галактози перетворюється в галактитол альдозоредуктазою і в галактонову кислоту галактозодегідрогеназою.
Ці три ферменти галактози в основному шляху широко розподілені в тканинах, включаючи еритроцити, лейкоцити, печінку, нирки, мозок, культивовані фібробласти шкіри, ворсинки хоріона та клітини навколоплідних вод. Генологічні локуси у людей галактокінази, трансферази та епімерази знаходяться на хромосомах 17, 9 та 1 відповідно (34–36) .
Дефіцит активності кожного з трьох ферментів призводить до метаболічних розладів, відомих як дефіцит галактокінази, дефіцит галактоза-1-фосфат-уридилтрансферази (галактоземія) та дефіцит UDPгалактоза-4-епімерази. Всі три порушення можна виявити шляхом скринінгу новонароджених на основі підвищеної кількості галактози або галактози-1-фосфату в плямах крові (картки Гатрі), за умови нормального споживання лактози у суміші новонародженого або годуванні груддю. Ідентифікація специфічного дефекту базується на аналізі ферментів в еритроцитах, за умови, що новонародженому не було переливання крові до забору зразка крові. Часто для виявлення дефекту трансферази застосовують точковий тест Бютлера для скринінгових лабораторій новонароджених (37). Деякі скринінгові лабораторії використовують автоматизований аналіз активності трансферази. Віднедавна всі три ферменти галактози тепер можна одночасно аналізувати за допомогою нового мультиплексного аналізу ферментів із використанням ультраефективної рідинної хроматографії – тандемної мас-спектрометрії (UPLC – MS/MS) (38) .
Гіпоглікемія
Галактоземія
Галактоза метаболізується за допомогою шляху Лелуара, що дозволяє їй пройти або глюконеогенез, або гліколіз. Початковим етапом на цьому шляху є перетворення β- d -галактози в α- d -галактозу за допомогою мутаротази. Потім α- d -галактоза фосфорилюється галактокіназою (кодується геном GALK1, розташований в хромосомі 17q25.1) у галактозо-1-фосфат (Gal1P). Потім уридилтрансфераза Gal1P (кодована GALT, на хромосомі 9p13.3) потім переносить групу уридилмонофосфату (UMP) з уридилдіфосфатної (UDP) -глюкози в Gal1P, утворюючи UDP-галактозу. Згодом UDP-галактоза-4′-епімераза (кодована GALE, на хромосомі 1p36.11) перетворює UDP-галактозу в UDP-глюкозу. 137
Галактоземія - це аутосомно-рецесивний розлад метаболізму галактози, що виникає внаслідок дефектів будь-якого з ферментів, що беруть участь у шляху метаболізму галактози. Класична галактоземія, також відома як галактоземія типу 1, внаслідок гомозиготної або складеної гетерозиготної мутації/делеції гена GALT, що призводить до зниження ферментної функції понад 95%, дуже поширена. Захворюваність на класичну галактоземію становить від 1/30 000 до 1/60 000 у західних країнах, 138 139 з більшою частотою у ірландських мандрівників (можливо, через збільшення спорідненості). Він рідше зустрічається в азіатських популяціях. Виявлено, що понад 120 мутацій GALT викликають галактоземію; додатково виявлено 173 патогенні мутації. 81 З них одне дослідження показало, що дві мутації - Q188R та K285N - становили понад 70% класичної галактоземії, пов’язаної з дисфункцією GALT у кавказької популяції, і що одна мутація, S135L, відповідала за 62% галактоземії серед чорношкірих; остання була пов’язана з кращими клінічними результатами. 140
- Синдром тріщин зуба - огляд тем ScienceDirect
- Діоген - огляд тем ScienceDirect
- Фронтотемпоральна деменція - огляд тем ScienceDirect
- Дистальна панкреатектомія - огляд тем ScienceDirect
- Щур, чутливий до солі Даля - огляд тем ScienceDirect