Енергетичний обмін
Пов’язані терміни:
- Глюкоза
- Жирні кислоти
- Лептин
- Ейкозаноїдний рецептор
- Ферменти
- Аденозинтрифосфат
- Інсулін
- Мітохондрія
- Окислювальний стрес
- Білок
Завантажити у форматі PDF
Про цю сторінку
ЕНЕРГЕТИЧНИЙ МЕТАБОЛІЗМ
Енергетичний метаболізм є центральним для життя, а головна функція дихальної системи - підтримка аеробних обмінних процесів в організмі. Незважаючи на цю важливу роль, енергетичний метаболізм погано інтегрований у діагностичну хронічну хворобу дихальних шляхів. Підвищена увага протягом останнього десятиліття була зосереджена на внеску енергетичного дисбалансу в патогенез втрати ваги, особливо у хворих на хронічну обструктивну хворобу легенів (ХОЗЛ). Кількість факторів сприяє кількості енергії, витраченої людиною: витрати енергії у спокої, фізична активність і меншою мірою термогенез, спричинений дієтою. Стаття стосується, зокрема, витрат енергії у спокої, а також загальних добових витрат енергії, виміряних у хворих на ХОЗЛ. Детально обговорюються фактори, що відповідають за збільшення витрат енергії у спокої, а також загальних витрат енергії. Споживання їжі, а також використання їжі є важливими компонентами для підтримки енергетичного балансу. Недавній прогрес у галузі енергетичного гомеостазу виявляє складність регуляторної нейроендокринної мережі. Детально розглядається роль анорексигенного та адипостатичного гормону лептину.
Енергетичний обмін
Метаболізм глікогену
Еритроцити та мозок мають абсолютну потребу в глюкозі для енергетичного обміну. Глюкоза всмоктується з кишечника лише на 2–3 год після їжі, і тому для підтримки постійного рівня глюкози в крові має існувати інше джерело глюкози. Коли рівень глюкози в крові підвищується після їжі, печінка може поглинати велику кількість глюкози, де вона перетворюється на глюкозо-6-фосфат, який може використовуватися для синтезу глікогену (глікогенезу). Коли запаси глікогену заповнені, глюкоза-6-фосфат може вступити в гліколіз або бути використаним для синтезу гліцерину для утворення жиру. Коли рівень глюкози в крові знижується, під час голодування між прийомами їжі глікоген розщеплюється в печінці та виділяється глюкоза (глікогеноліз). Під час голодування глікоген розщеплюється шляхом видалення одиниць глюкози у вигляді глюкози-1-фосфату з багатьох кінців молекули. Потім він ізомеризується до глюкозо-6-фосфату. Тільки печінка може виділяти вільну глюкозу, оскільки в м’язовій тканині не вистачає глюкозо-6-фосфатази. Вільна глюкоза, що виділяється печінкою, призначена для використання мозку та еритроцитів.
Глюкоза-6-фосфат, що виділяється в м’язовій тканині з глікогену, може потрапляти безпосередньо в гліколіз для виробництва енергії м’язом. Альтернативно, він може метаболізуватися до пірувату, а потім переамінуватися в аланін, який експортується з м’язів до печінки, де його можна використовувати як субстрат для глюконеогенезу.
У таблиці 2 наведено відносну важливість шляхів метаболізму енергії в різних тканинах тіла.
Таблиця 2. Короткий зміст відносної важливості різних метаболічних шляхів у посередницькому метаболізмі в різних тканинах
| Мозок | 25% споживання базального O2 |
| Метаболізує лише глюкозу, за винятком тривалого голодування, коли вона може адаптуватися до засвоєння та метаболізму кетонів | |
| Кров | У зрілих еритроцитів немає мітохондрій: енергія від анаеробного гліколізу: глюкоза → лактат |
| М'язи | Переважно метаболізують жирні кислоти та кетони, що виробляються з печінки. |
| Анаеробний гліколіз глюкози із запасів глікогену | |
| Аеробне дихання глюкози глікогеном або жирними кислотами/кетонами | |
| Печінка | Переважно окислення амінокислот для утворення АТФ |
| Найважливіша тканина для підтримки глюкози в крові шляхом глюконеогенезу з амінокислот і лактату (через цикл Корі) та гліцерину, а також через розпад запасів глікогену | |
| Синтез жирних кислот та синтез ліпопротеїдів для транспорту | |
| Виробництво кетонів в обігу | |
| Ділянка пентозо-фосфатного шляху для утворення НАДФН + Н + | |
| Жирова тканина | Призначений для зберігання жиру |
| Може синтезувати жир з глюкози | |
| Нирки | Глюконеогенез |
| Окислення амінокислот для утворення АТФ |
ЕНЕРГЕТИЧНИЙ МЕТАБОЛІЗМ
Резюме
Як описано в попередніх абзацах, людина отримує свою енергію з їжею. Потрапляючи в організм, макромолекули, що знаходяться в їжі, зазнають низку дегенеративних реакцій, що дають необхідні субстрати, щоб сприяти продовженню процесу, відомого як енергетичний метаболізм. Результатом цієї дуже точної серії хімічних та біологічних реакцій є перетворення енергії у вільному вигляді в енергію, яка може бути повністю використана людським організмом. Вуглеводи розкладаються до простих цукрів, жири - до жирних кислот, а білки - до амінокислот. Зрештою, повне окислення цих молекул дає ацетил КоА, який діє як зв'язок із циклом ТСА.
У циклі TCA ацетил КоА повністю окислюється до СО2 та Н2О. Протягом усього циклу виділяються атоми водню та їх електрони. Потім атоми водню зв’язуються з іншими сполуками, в результаті чого утворюються три молекули NADH, одна FADH2 та одна GTP. Ці нові молекули містять енергію, спочатку знайдену в ацетил КоА. Для виробництва АТФ NADH і FADH2 переносять електрони з циклу ТСА через електронно-транспортний ланцюг, відомий як окисне фосфорилювання. Процес закінчується виробництвом АТФ та H2O. Зміна окисного фосфорилювання може погіршити виробництво АТФ і натомість розсіювати енергію у вигляді тепла. За це відповідають роз’єднуючі білки.
Серотонін
Енергетичний метаболізм та його регулювання
Діагностика та лікування мітохондріальних захворювань
Загальні рекомендації
Енергетичний обмін порушений у пацієнтів з мітохондріальними енцефаломіопатіями, тому слід уникати перенапруження до стомлення та виснаження. Показано, що аеробне кондиціонування покращує фізичні вправи у пацієнтів з мітохондріальними міопатіями. Спеціальний дієтичний режим не рекомендується, але пацієнтам рекомендується уникати тривалого голодування та часто їсти легкі страви. Слід виключити вплив потенційних факторів навколишнього середовища, таких як вживання алкоголю та тютюну в LHON. Лихоманка агресивно лікується ацетамінофеном, і слід уникати аспірину. Коли необхідне лікування антибіотиками, слід уникати левоміцетину та тетрацикліну через токсичність для мітохондрій.
Енергетичний метаболізм та метаболічне націлювання нейробластоми
Сепіде Амінзаде-Гохарі,. Барбара Кофлер, у нейробластомі, 2019
Анотація
Енергетичний метаболізм відноситься до всіх реакцій, пов’язаних з утворенням аденозинтрифосфату (АТФ) з поживних речовин, включаючи як аеробне дихання (присутній кисень), анаеробне дихання (бродіння), так і обмін жирних кислот та амінокислот. У нормоксичних умовах нормальні клітини використовують аеробне дихання для окислення глюкози за допомогою окисного фосфорилювання мітохондрій. З іншого боку, ракові клітини воліють зброджувати глюкозу до лактату навіть при наявності кисню (ефект Варбурга) і демонструють змінений обмін ліпідів та амінокислот. У цій главі розглядаються метаболічні особливості нейробластоми (НБ), які дозволяють пухлині підтримувати рівень АТФ та біомасу, необхідні для підтримки високої проліферації, та висвітлює нові метаболічні цілі в терапії НБ.
Вагітність: енергетичні потреби та метаболічні адаптації
Енергетичний метаболізм під час вагітності у людини розглядався більше 60 років, починаючи з ранніх робіт, що оцінювали внесок метаболізму плода в загальні енергетичні витрати вагітності. Відтоді акцент робиться на виділенні та кількісному визначенні різних компонентів гестаційних потреб у енергії та на розробці відповідних рекомендацій щодо енергетичних потреб вагітних жінок з метою кількісного визначення середніх кількостей. Ці міжіндивідуальні варіації метаболічних реакцій на вагітність дедалі більше визнаються біологічно значущою «пластичністю», яка має справжнє адаптивне значення, дозволяючи жінкам переносити вагітність на термін у широкому діапазоні харчових умов. Наслідки таких адаптацій вивчаються як частина гіпотез захворювання дорослих на внутрішньоутробне та дитяче походження.
Концептуальні передумови та біоенергетичні/мітохондріальні аспекти онкометаболізму
Мартін Пелтьє,. Річард М. Зігель, у Методи в ензимології, 2014
1.1 Енергетичний обмін та регуляція імунних клітин
Енергетичний метаболізм забезпечує належну функцію імунної системи, оскільки імунні клітини потребують енергії, щоб підтримувати життєздатність клітин та виконувати певні імунні функції. Це включає споживання енергії на рухові функції (міграція та фагоцитоз), обробку та презентацію антигену, активаційні функції (передача сигналів та проліферація) та ефекторні функції (синтез антитіл, секреція цитокінів та цитотоксичність) (Buttgereit, Burmester, & Brand, 2000). Імунні клітини дуже пристосовані до середовища, в якому вони циркулюють та є домом під час запальних реакцій. Вони часто відрізняються за своїми основними метаболічними станами та реакціями на активуючі подразники. Адаптовані метаболічні відповіді мають вирішальне значення для виживання та функціонування клітин. Нездатність метаболізму відповідати клітинним потребам може призвести до порушення функції та апоптозу, тоді як надлишок метаболічної функції може призвести до виживання клітин, підвищеної функціональності та гіперреактивності, що призведе до аутоімунних та запальних захворювань (Jacobs et al., 2008; Rathmell, Elstrom, Cinalli, & Thompson, 2003).
Біоенергетика сну
Регіональний метаболізм церебральної глюкози під час сну
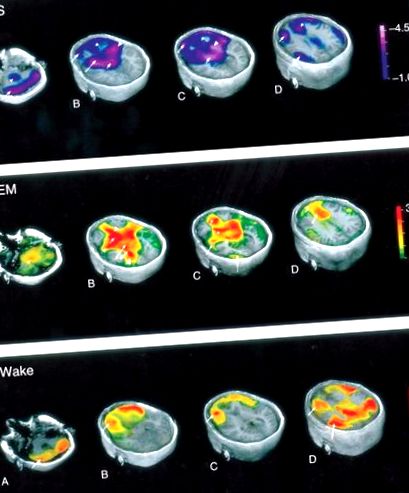
Малюнок 5. Карти мозку, що ілюструють зміни регіонального мозкового кровотоку (rCBF) на різних стадіях сну та неспання. Змінено з дозволу Braun AR, Balkin TJ, Wesenten NJ, et al. (1997) Регіональний мозковий кровотік протягом циклу сон-неспання. Дослідження H2 (15) O PET. Мозок 120 (Pt 7): 1173–1197.
Висновки про метаболічну активність за допомогою методів нейровізуалізації, що вимірюють мозковий кровотік, передбачають, що мозковий кровотік корелює з нейрональною активністю, яка в свою чергу корелює з метаболічною активністю. Відбувається глобальне зниження мозкового кровотоку під час сну NREM. Зниження кровотоку під час НРЕМ-сну спостерігається у спинному мозку, довгастому мозку, таламі, базальних гангліях, базальному передньому мозку, передньому гіпоталамусі, передній лобовій корі, передній порожнистій корі та прекунеї. Регіональне зменшення кровотоку можна згрупувати за трьома основними мозковими областями - підкірковими структурами, кортикальними структурами та іншими областями.
Інтенсивна нейрональна активність, високоенергетичний метаболізм і посилений приплив крові до мозку характеризують швидкий сон. Порівняно з неспанням, під час швидкого сну спостерігається посилений кровотік в полярній корі, скронево-потиличній зонах, базальному передньому мозку, мозочку та хвостатому ядрі. Знижений регіональний кровотік спостерігається в дорсолатеральній префронтальній корі (DLPF), задній поперечній звивині, прекунеусі та нижній тім’яній корі. Педункулопонтінові тегментальні (PPT) і латеродорзальні тегментальні (LDT) ядра проектують холінергічні нейрони дорсально до таламуса і вентрально до базального переднього мозку, де вони опосередковують активацію кори.
Метаболізм бактеріальної енергії
Вступ до енергетичного обміну
Енергетичний метаболізм інтегрований з іншими метаболічними процесами, такими як хемотаксис, засвоєння поживних речовин, секреція полімерів, стікання відходів метаболітів та токсичних сполук. Центральним компонентом більшості бактерій є протон (H +), що переміщує АТФазу. У ферментативних бактеріях це перетворює АТФ, отриманий в результаті фосфорилювання на рівні субстрату, в рушійну силу протона (pmf), що складається з двох компонентів: електрохімічного градієнта протона ΔpH та мембранного потенціалу Δμ. У бактерій, які отримують енергію за допомогою дихання, електрони передаються по дихальному ланцюгу, що складається з цитохромів та флавопротеїдів; у конкретних точках цього процесу відбувається поділ заряду, і протони переміщуються по цитоплазматичній мембрані, створюючи pmf. H + -ATPase є оборотною, тому можна використовувати pmf для генерування ATP.
Бактерії виявляють вражаючу різноманітність у своїй здатності використовувати метаболіти для виробництва енергії та перемикання з одного способу виробництва енергії на інший. Це найбільш очевидно показано у факультативних аеробах, таких як кишкова паличка, які можуть використовувати аеробне дихання з киснем як кінцевий акцептор електронів, але також можуть використовувати альтернативні акцептори електронів, такі як нітрат, фумарат, оксид триметиламіну (TMAO) та диметилсульфоксид (DMSO). Також кишкова паличка може точно налаштувати дихальний ланцюг, використовуючи альтернативні цитохромоксидази відповідно до концентрації кисню, що оточує клітину.
Інші бактерії більш обмежені. Такі анаероби, як Bifidobacterium longum, колонізатор кишечника людини, отримують енергію шляхом бродіння.
- Синдром тріщин зуба - огляд тем ScienceDirect
- Діоген - огляд тем ScienceDirect
- Фронтотемпоральна деменція - огляд тем ScienceDirect
- Дистальна панкреатектомія - огляд тем ScienceDirect
- Щур, чутливий до солі Даля - огляд тем ScienceDirect