Диференціальна реакція орексигенних нейропептидів на голодування у нащадків матерів із ожирінням
Кафедра фармакології Школи медичних наук Університету Нового Південного Уельсу, Сідней, Новий Південний Уельс, Австралія
Кафедра фармакології Школи медичних наук Університету Нового Південного Уельсу, Сідней, Новий Південний Уельс, Австралія
Кафедра фармакології Школи медичних наук Університету Нового Південного Уельсу, Сідней, Новий Південний Уельс, Австралія
Кафедра фармакології Школи медичних наук Університету Нового Південного Уельсу, Сідней, Новий Південний Уельс, Австралія
Анотація
Вступ
Апетит регулюється складною гомеостатичною мережею, що включає центральні та периферійні компоненти для підтримки енергетичного балансу ((1), (2)). Гіпоталамус вважається головним інтегратором і процесором периферичної метаболічної інформації. Потік сигналів, що регулюють метаболізм у мозку, залежить від нейрональних взаємодій, які впливають на вироблення або вивільнення нейромедіаторів ((3)). Дугоподібне ядро гіпоталамуса (Arc) містить нейрони, що експресують орексигенні пептиди, нейропептид Y (NPY) і пов'язаний з гуті білок (AgRP), а також ті, що експресують анорексигенний пептид проопіомеланокортин (POMC) та кокаїн та амфетамін, що регулюються між собою, (1)). Надходження гормонів, що відображають ожиріння та енергетичний баланс (лептин на основі жиру та інсулін підшлункової залози), інтегрується в гіпоталамус для регулювання годування.
Дослідження на мишах-мутантах вказують на те, що надмірна експресія орексигенних нейропептидів сприяє ожирінню або гіперфагічному фенотипу. Експресія гіпоталамуса потужного стимулятора живлення NPY збільшується в кілька разів при дефіциті лептину об/об і дефіцит рецепторів лептину дб/дб мишей, і в обох спостерігається надмірна експресія AgRP об/об і db/db мишей ((4), (5)). Однак у дієтичних моделей гризунів, що страждають ожирінням, особливо у тих, що використовують смачні дієти, існує очевидна розбіжність між гіперфагічним фенотипом та рівнями як орексигенних, так і анорексигенних регуляторів апетиту. Як у щурів, так і у мишей, тривале харчування з високим вмістом жиру (HFD) викликало помітне підвищення рівня лептину в плазмі крові зі зниженими концентраціями гіпоталамусового NPY та збільшенням продукту розщеплення пептидів POMC, гормону, стимулюючого α-меланоцити (α-MSH ) ((6), (7), (8)). Здається, гіперфагія у цих тварин не регулювалася цими основними центральними регуляторами.
Голод викликає складну гормональну та нервову реакцію. Експресія мРНК NPY збільшується у відповідь на голодування або хронічне обмеження їжі та зменшується протягом 6–24 год ad libitum повторне подавання ((9), (10), (11), (12), (13)). Експресія AgRP також додатково збільшується у людей із ожирінням об/об і дб/дб миші під час посту ((4), (5), (12)). Рівень мРНК POMC помітно знижується у тварин, що голодують, і відновлюється повторним годуванням, або підвищується при екзогенному введенні лептину ((12), (14)).
Епідемія ожиріння впливає на наступне покоління ((15)). Показано, що ожиріння матері схильне до переїдання, підвищеного ожиріння та непереносимості глюкози ((16), (17)). Однак основні нервові механізми незрозумілі. Раніше ми виявили зниження рівня гіпоталамусу NPY та підвищення рівня мРНК POMC у потомства від ожирілих дам на 20 день після пологів у стані вільного вигодовування ((18)), що аналогічно змінам у дієтичному ожирінні у дорослих ((6), (7), (8)). Голод є головним рушієм поведінки годування. Тому важливо розуміти, як ожиріння матері впливає на реакцію цих регуляторів апетиту та гормонів на голодування. Ми висунули гіпотезу, що збільшення кількості гіпоталамічних орексигенних нейропептидів у відповідь на нічне голодування було б більшим у потомства ожирених дам, ніж у худих, що призвело б до гіперфагії.
Методи та процедури
Ожиріння матері
Безпородних самок щурів Спрег-Доулі (8 тижнів, Центр тваринних ресурсів, Каннінг-Вейл, Австралія) утримували при температурі 20 ± 2 ° C і витримували цикл 12:12 год світло/темно (світло світиться о 06:00). Щурів віднесли до двох груп з рівною масою тіла. Контрольну групу годували лабораторною чау (Gordon's Specialty Stockfeeds, NSW, Австралія; 11 кДж/г енергії, 14% жиру, 21% білка, 65% вуглеводів), а другій групі смакували - HFD (15,33 кДж/г, середня енергія 34% жиру (насичені жири 17%), 18% білка, 50% вуглеводів). HFD складався з модифікованої чау з високим вмістом жиру (лабораторна чау, сухе молоко, підсолоджене згущене молоко та насичені тваринні жири) та надзвичайно смачна їжа в їдальні, така як м’ясні пироги, тістечка та печиво (4-5 різних видів на день) відомої калорійності ((6), (7), (18)). Самок щурів годували або чау, або HFD протягом 5 тижнів перед спарюванням з дорослими самцями, отриманими з того ж джерела. Під час лактації дамби продовжували дотримуватися тієї ж дієти. Дослідження було схвалено Комітетом з етики тварин Університету Нового Південного Уельсу.
Голодування та збір проб
Дамби засмічені нормально. У післяпологовий день 19 половина цуценят-самців з кожного посліду були відокремлені від своїх матерів о 17:00 і розміщені разом зі своїми однолітками поруч із початковою домашньою кліткою. Їм було дозволено вільний доступ до води без їжі. Інші щури залишились на дамбах. Наступного ранку цуценят, що голодували впродовж ночі, збирали в період з 08:00 до 900 годин, а тих, хто не голодував між 0930 і 1030 годинами. Щурам проводили глибоку анестезію (кетамін/ксилазин 180/32 мг/кг, внутрішньочеревно). Після вимірювання довжини носо-анального (N-A) крові видаляли серцевою пункцією та вимірювали глюкозу в крові (вимірювач Accu-Chek; Roche Diagnostics, Nutley, NJ); плазма зберігалася при -20 ° C. Цуценят вбивали декапітацією, а цілий гіпоталамус видаляли для вимірювання мРНК після корональних зрізів на хіазмі зорового нерва та каудальній гіпоталамічній борозні. Гіпоталамічну ділянку розсікали, розрізаючи гіпоталамічні борозни, потім трохи вище третього шлуночка. Були розсічені та зважені різні ліжка жирової тканини, а також органи (серце, печінка, нирки) та скелетні м’язи (extensor digitorum longus, soleus та tibialis). Довжину гомілки вимірювали як маркер росту.
Вимірювання споживання молока та чау після відлучення
Споживання молока вимірювали в окремій когорті, оскільки відокремлення щенят від матерів може вплинути як на дамб, так і на щенят. На післяпологовий день 10, вага тіла цуценят реєструвалася після 2-годинної розлуки з їх матерями, і їх тримали разом з однолітками при 31 ° C. Збільшення ваги, зафіксоване через 2 години після повернення до матері, послужило непрямим показником прийому молока, представленого як випитий мілілітр. Споживання чау після відлучення вимірювали в іншій когорті 22-денних тварин (2 дні після відлучення) шляхом ретельного зважування всієї їжі, що залишилася після 24-годинного періоду.
Вимірювання гормону плазми
Концентрації лептину та інсуліну в плазмі крові вимірювали за допомогою комерційно доступних наборів для радіоімунологічного аналізу (Linco, St Charles, MO). Розраховано параметр оцінки моделі гомеостазу (HOMA): HOMA = інсулін у плазмі натще (нг/мл) × глюкоза в плазмі натще (ммоль/л)/(22,5 × 0,0417); чим більше значення HOMA, тим вищий рівень інсулінорезистентності ((19)).
Кількісна ПЛР у режимі реального часу
Загальну мРНК гіпоталамусу виділяли за допомогою реагенту TRIzol (Invitrogen Australia, Мельбурн, Австралія) відповідно до інструкцій виробника. Очищену загальну РНК використовували як шаблон для генерування первинноцепочечного комплементарного синтезу ДНК з використанням M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant Kit (Promega, Madison, WI). Заздалегідь оптимізовані зонди/праймери Applied Biosystem (Фостер-Сіті, Каліфорнія) використовували для кількісної ПЛР у реальному часі (Eppendorf Realplex 2; Eppendorf AG, Гамбург, Німеччина). Цільову мРНК мітили FAM, а 18S рРНК мітили VIC. Експресія гена визначалася кількісно в одній реакції мультиплексування, де ген, що представляв інтерес, був стандартизований до 18S рРНК. Потім окрему пробу з контрольної групи довільно призначали як калібратор, по відношенню до якої всі інші зразки виражали як кратну різницю.
Статистичні методи
Результати виражаються як середнє значення ± s.e.m. Вага тіла дамб та HOMA щенят аналізували неспареними студентами т‐Тест. Інші дані були проаналізовані за допомогою двостороннього ANOVA з подальшим post hoc Тести найменшої різниці значень Фішера.
Результати
Материнський ефект
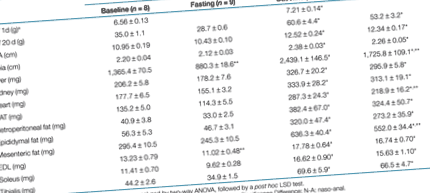
На 1-й день життя цуценята, народжені з ожирених дам, були на 10% важчі, ніж з худих дамб (Таблиця 1, P У 9 та 5 разів більша у цуценят із ожирених дамб. При стандартизації за масою тіла всі ці відмінності залишались значними. Ожиріння матері мало впливало на рівень глюкози в крові та рівень інсуліну в плазмі у нащадків (Малюнок 1a, b), тоді як рівень лептину в плазмі крові більш ніж втричі збільшився у цуценят від ожирілих дам (Малюнок 1c).
 |
Глюкоза в крові та інсулін у плазмі та лептин у цуценят від худих та ожирених дамб на вихідному рівні (відкриті бари, n = 8) і після нічного голодування (закриті бари, n = 8). Результати виражаються як середнє значення ± s.e.m. Дані аналізували двосторонній ANOVA, а потім a post hoc Тест ЛСД. *P
Коли тварини знаходились у годуванні, експресія мРНК гіпоталамусу NPY та AgRP у цуценят від ожирілих дам було трохи нижче, ніж у цуценят від худих дамб, не досягаючи статистичної значущості (NPY P = 0,07, Малюнок 2a, b), тоді як експресія мРНК POMC була значно збільшена у цуценят від ожирених дам порівняно з худими дамами (Малюнок 2в). Експресія рецептора NPY Y1 (Малюнок 3а) було збільшено у щенят від ожирілих дам, без суттєвих змін у експресії мРНК рецептора α-MSH, рецептора меланокортину-4 (MC4R) (P = 0,07, Малюнок 3b). Однак експресія мРНК нижчої мішені MC4R, однозначного гена 1 (Sim1), була значно знижена на 45% у цуценят від ожирілих дам (P
експресія мРНК гіпоталамуса (a) NPY, (b) AgRP та (c) POMC у цуценят від худих і огрядних дамб на базовій лінії (відкриті бруски, n = 8) і після нічного голодування (закриті бари, n = 8). Результати виражаються як середнє значення ± s.e.m. Дані аналізували двосторонній ANOVA, а потім a post hoc Тест ЛСД. *P
експресія мРНК гіпоталамусового рецептора NPY Y1, MC4R та Sim1 у цуценят від худих і ожирілих дамб на вихідному рівні (відкриті смуги, n = 8) і після нічного голодування (закриті бари, n = 8). Результати виражаються як середнє значення ± s.e.m. Дані аналізували двосторонній ANOVA, а потім a post hoc Тест ЛСД. *P
експресія мРНК гіпоталамусових Ob-Rb та STAT3 у цуценят від худих і ожирілих дамб на вихідному рівні (відкриті бари, n = 8) і після нічного голодування (закриті бари, n = 8). Результати виражаються як середнє значення ± s.e.m. Дані аналізували двосторонній ANOVA, а потім a post hoc Тест ЛСД. *P
Ефект голодування
Нічне голодування призвело до зниження маси тіла на 18 і 12% у цуценят з худих і ожирілих дам, відповідно (Таблиця 1). З органів, яким відбирали зразки, голодування постраждало лише на печінку, зменшившись на 35 та 30% у цуценят з худих і ожирілих дам, відповідно (P
Обговорення
Ожиріння матері є важливим фактором ризику ожиріння у дітей. Дослідження на людях припускають, що внутрішньоматкові фактори можуть бути більш важливими, ніж генетичні фактори, у зміні експресії генів у відповідь на HFD, що може мати тривалий вплив після пологів. Голод є головним рушієм харчової поведінки як у людей, так і у тварин. Це дослідження досліджувало вплив існуючого ожиріння матері на центральні регулятори апетиту у потомства та реакцію на нічне голодування.
Довготривале ожиріння матері призвело до збільшення маси тіла, розміру тіла та більш сильного ожиріння у нащадків під час відлучення, що узгоджується з нашими попередніми спостереженнями ((18)). У цьому дослідженні більш високе споживання молока після 2-годинної сепарації, швидше за все, пов’язано з посиленням голоду, а не будь-яким ефектом, пов’язаним зі стресом, оскільки на постнатальний день 8 поділ матері викликав суттєві зміни кортикостерону через 8, але не через 4 години ((20 )). Таким чином, швидший набір ваги у цуценят від порожніх потомків може бути частково обумовлений гіперфагією. В результаті лептин у плазмі крові був значно підвищений. NPY, AgRP і POMC сильно виражені в дузі гіпоталамуса. Як адаптація до підвищеного ожиріння і концентрації лептину в плазмі, коли тварини перебували в насиченому стані, лише анорексиген POMC був суттєво підвищений у нащадків від ожиріних дам, що схоже на зміни, що спостерігаються у дорослих дієтичних ожирілих тварин ((21 )). Однак мРНК рецептора Y1 також була регульована в немолодий стан. Оскільки рецептор NPY Y1 не тільки опосередковує ефекти живлення NPY, але й регулює витрати енергії ((22)), це може призвести до зменшення витрат енергії в насиченому стані.
У нащадків від ожиріних дамб зміни регуляторів апетиту в насиченому стані недостатні для пояснення підвищеного споживання молока під час вигодовування та споживання енергії незабаром після відлучення. У дорослих щурів концентрація NPY підвищується перед їжею і значно зменшується під час прийому їжі, тоді як α ‐ MSH протидіє NPY, щоб заважати годуванню ((28)). Таким чином, необхідно порівняти зміни регуляторів апетиту в голодному стані між щенятами з худих і ожирілих дамб.
Щури - нічні тварини, які споживають більшість свого щоденного споживання протягом ночі. Після нічного голодування маса тіла, печінки та м’язових мас, а також рівень глюкози в крові та плазми лептину та інсуліну значно знижувались у всіх цуценят. Вплив голодування на масу тіла пов'язаний із швидкістю росту у віці відлучення та перериванням нічного годування. Оскільки надлишок глюкози зберігається у вигляді глікогену в печінці та м’язах і використовується як паливо під час енергетичного дефіциту, зменшена маса печінки та м’язів може відображати мобілізацію накопиченого глікогену для підтримки мінімальних рівнів глюкози.
Рецептор Y1 експресується в Arc, PVN, латеральному ядрі гіпоталамуса, дорсомедіальному та вентромедіальному ядрі гіпоталамуса ((33)). Нечисленні дослідження вимірювали експресію рецепторів Y1, з одним повідомленням про зменшення кількості рецепторів Y1, розподілу та експресії мРНК в дузі під час голодування ((34)). Це може відображати регіональні відмінності. У цьому дослідженні ми вимірювали загальну експресію мРНК рецептора гіпоталамусу Y1, включаючи PVN, де NPY чинить сильний вплив на годування.
Знижений вихідний рівень Ob-Rb та STAT3 нижче за течією можуть бути початковим кроком до стійкості до лептину, який зазвичай спостерігається у тварин із ожирінням та людей. Дійсно, було показано, що ожиріння матері призвело до стійкості до лептину у нащадків ще до того, як вони потрапили під дію HFD ((38)). Це пояснює, чому в насиченому стані високий рівень лептину у нащадків від ожирілих дам не суттєво пригнічував як NPY, так і AgRP. Незважаючи на те, що Ob-Rb та STAT3 суттєво не змінювались після голодування, спостерігалося ще більш помітне зниження рівня лептину в плазмі під час голодування. Як зазначено вище, це може сприяти збільшенню експресії мРНК NPY та AgRP.
Після відлучення від материнського ожиріння материнське ожиріння збільшило кількість орексигенних регуляторів гіпоталамусу і мало реакції анорексигенних регуляторів на нічне голодування порівняно з потомством худих дамб. Ці зміни можуть безпосередньо сприяти гіперфагії та швидшому зростанню нащадків із ожирених дамб.
Подяка
Ця робота отримала грантове фінансування від Національної ради з питань охорони здоров’я та медичних досліджень Австралії Маргарет Морріс.
Розкриття інформації
Автори не заявили про конфлікт інтересів.
- С-пептид натще - корисний інструмент для діагностики цукрового діабету II типу при ожирінні із зайвою вагою
- Частота порушень рівня глюкози натще у родичів першого ступеня хворих на цукровий діабет II типу та
- Дієтичне харчування у хворих на цукровий діабет із ожирінням - MedCrave онлайн
- Швидке катання на велосипеді Чи є користь від пісного велосипедиста?
- Дієта, фізична активність та поведінкові втручання для лікування надмірної ваги або ожиріння