Зв’язок між хворобою Бехтерева, хворобою Крона, Клебсієла, та споживання крохмалю
1 Група аналітичних наук, Кінгс-коледж, 150 Стемфорд-стріт, Лондон SE1 9NH, Великобританія
2 Відділення патології та мікробіології, Меморіальна лікарня королів Едварда VII, 7-точка Фінгер-роуд, Педжет DV04, Бермуди
Анотація
І хвороба Бехтерева (АС), і хвороба Крона (ХД) є хронічними та потенційно інвалідизуючими взаємопов’язаними станами, які були включені до групи спондилоартропатій. Результати великої кількості досліджень підтверджують думку про наявність ентеропатичного збудника, Klebsiella pneumoniae, є найбільш вірогідним пусковим фактором, що бере участь у ініціації та розвитку цих захворювань. Збільшення споживання крохмалю генетично сприйнятливими особами, такими як ті, що мають алелотипи HLA-B27, може спровокувати захворювання як в АС, так і в КР, посилюючи ріст та увічнення Клебсієла мікроби в кишечнику. Вплив підвищеного рівня цих мікробів призведе до утворення підвищеного рівня антитіл-Клебсієла антитіла, а також аутоантитіла проти перехресно реактивних власних антигенів із наслідком патологічних уражень кишечника та суглобів. Отже, зменшення крохмалесодержащих продуктів при щоденному вживанні з їжею може мати сприятливий терапевтичний ефект на хворобу, особливо якщо застосовуватись разом із наявними в даний час медичними методами лікування пацієнтів з АС та ХР.
1. Вступ
Анкілозуючий спондилоартрит (AS) розглядається як прототип серонегативних спондилоартропатій (SpA), які включають групу станів, пов’язаних із спондилітом. Інші хвороби SpA включають реактивний артрит, псоріатичний артрит, недиференційований SpA та артрит, асоційований із запальними захворюваннями кишечника (IBD), що включає хворобу Крона (CD) та виразковий коліт (UC) [1]. SpAs - це взаємопов’язані стани, що мають спільні певні клінічні, лабораторні, рентгенологічні та генетичні прояви, такі як запальний біль у спині, спричинений спондилітом/сакроілеїтом, а також асиметричний олігоартрит, ентезопатія, передній увеїт, позитивний сімейний анамнез та асоціація з генами HLA-B27, але без позитиву щодо ревматоїдних факторів.
Незважаючи на те, що у хворих на КД зазвичай притаманні клінічні особливості ураження кишечника, характерним явищем у хворих на АС та спондилітозний КР є прогресуючий запальний біль у спині з іншими асоційованими з SpA ознаками або без них [2].
Як АС, так і КД впливають на ранні вікові групи та мають поширення у всьому світі. У Сполученому Королівстві є принаймні один мільйон осіб, які страждають деякими особливостями АС. Негативний вплив АС на зайнятість [3] та психологічний [4] статус пацієнтів із цим захворюванням добре встановлений. Хвороба при КР може також впливати на соціальний статус та працездатність пацієнтів, особливо у жінок [5]. Через ці негативні наслідки для загального стану здоров'я та добробуту пацієнтів з АС та ХР, з певними недоліками медичних процедур, що використовуються в даний час, пошук причинного фактора та альтернативний терапевтичний захід, що передбачає викорінення причини, може бути корисним у ведення пацієнтів з цими захворюваннями.
2. Генетичне тло AS та CD
Позитивна сімейна історія є одним із ключових моментів у визначенні характеристик пацієнтів із SpA. У сімейному дослідженні пробандів АС та здорового контролю серед ісландської популяції було показано, що є дані, які можуть підтвердити існування загальних генетичних компонентів для АС та ВЗК. Дослідження продемонструвало співвідношення ризику 3,0 та 2,1 у родичів першого та другого ступеня відповідно щодо виникнення АС у сім'ях пробандів із ВЗК та при виникненні ВЗК у сім'ях пацієнтів з АС [6]. У більш недавньому дослідженні було показано, що існує генетичне перекриття аутоімунних захворювань, включаючи також АС та ВЗК [7]. Отже, виявляється, що певні загальні генетичні фактори можуть впливати на розвиток обох захворювань на АС та КР.
Частота асоціації алелотипів HLA-B27 у пацієнтів з АС розглядається як найсильніший генетичний зв’язок із будь-яким захворюванням, яке зустрічалось у галузі ревматології [8]. Цей генетичний зв’язок був виявлений на початку 1970-х років, коли було виявлено, що понад 95% пацієнтів з АС мають HLA-B27, тоді як частота цього гена в загальній популяції була нижче 10% [9, 10]. Інші хвороби групи SpA мають нижчий, але різний ступінь асоціації з цим алелотипом. Наприклад, частота цього алелотипу у хворих на ВЗК/КР без асоційованого артриту порівнянна з частотою нормальної популяції, але зростає до 40–60% у пацієнтів із спондилітом/сакроілеїтом [11]. Ці дані показують, що пацієнт зі спондилоартропатією, який страждає на ураження хребта, має більш високі шанси володіти генами HLA-B27, ніж у пацієнтів із ураженням лише периферичних суглобів. Окрім HLA-B27, інші гени, незалежно від того, знаходяться вони в межах або поза зоною основного комплексу гістосумісності, також були залучені до етіопатогенезу як AS [12], так і CD [13].
3. Зв'язок між AS та CD
З цих результатів видно, що як HLA-B27, так і запалення кишечника відіграють ключову роль у розвитку SpA, особливо АС та CD, і що основний етіопатогенетичний процес ініціюється генетичними та екологічними (переважно мікробними) факторами.
4. Докази субклінічних мікробних інфекцій при АС та КР
Перші докази епідеміологічного зв’язку між інфекцією та SpA були виявлені на початку ХХ століття, коли тріада симптомів, що складаються з уретриту, кон’юнктивіту та артриту, що називається синдромом Рейтера, була виявлена у групи солдатів, які жили в негігієнічних умовах під час Перша світова війна після кількох випадків зараження [23]. Однак цей стан пізніше було визнано формою реактивного артриту, якому, як відомо, передують інфекції ентерогенними або урогенітальними бактеріями [24].
Попередні оглядові аналізи показали, що результати молекулярних, імунологічних та мікробіологічних досліджень можуть встановити зв'язок між субклінічними Клебсієла інфекції та етіопатогенез як АС [25, 26], так і КР [14, 27]. Докази цих посилань узагальнені наступним чином.
4.1. Клебсієла і як
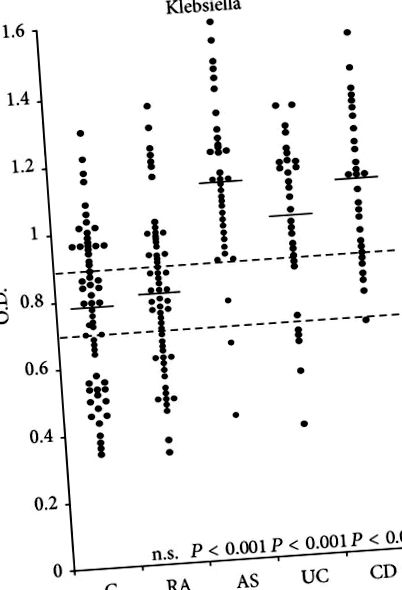
Добре задокументовано, що існує сильний зв’язок між запаленням кишечника [46] та/або АС [47, 48]. Рівень загального [49] та секреторних імуноглобулінів IgA [50] зростав у більшості пацієнтів з АС. Більше того, є дані про підвищений рівень IgA, особливо секреторних антитіл IgA проти Клебсієла антигени [51–53] або Клебсієла перехресно реактивні антигени [54] у активних пацієнтів з АС. Результати цих досліджень пов'язують Клебсієла, колаген та HLA-B27 до AS можуть пояснити деякі переважні характерні клінічні, генетичні та імунологічні особливості, які є у пацієнтів із цим захворюванням (табл. 1).
4.2. Клебсієла та компакт-дискКрім того, експериментальні дослідження Nagakute в Японії показали, що індукований колагеном ентероколіт [63] та артрит [64] спостерігались у тварин при імунізації гомологічними екстрактами товстої кишки та колагенами разом з Клебсієла ліпополісахариди. 5. Зв'язування етіопатогенного механізму Клебсієла до AS та CDМолекулярна мімікрія або гіпотеза перехресної реактивності вважається головним механізмом, який може зв’язувати Клебсієла з ініціацією та розвитком АС та спондилітичного асоційованого КР [65]. Докази, отримані щодо інших захворювань, таких як ревматична лихоманка [66] та первинний біліарний цироз [67], вказують на те, що молекулярна мімікрія - це більше, ніж епіфеномен, завдяки чому гуморальні та/або клітинні імунні відповіді послідовно виявляються щодо цільових тканин у патологічних місцях у пацієнтів ці умови. Види перехресно реактивних антитіл виробляються наступним чином Клебсієла інфекції визначатимуть анатомічне розташування патологічних уражень, особливо при АС. Деякі антитіла реагують з HLA-B27, антигеном, який експресується в більшості суглобових тканин всередині синовіальних суглобів, тоді як інші антитіла реагують з типами I, III та IV колагену, які утворюють важливий компонент тканин хребта, де розташовані патологічні ураження. Прив'язка цих Клебсієла перехресно реагуючі антитіла, коли вони присутні у високих титрах, запускають запальні каскади, такі як система комплементу, разом з продукцією різних цитокінів, що призводить до патологічних змін із подальшим фіброзом, кальцифікацією та новим утворенням кісток, що призводить до розвитку класичної АС. Більше того, підвищений рівень експресії антигену HLA-B27 в цільових тканинах у пацієнтів з АС [68] зробить ці молекули більш доступними і, отже, збільшить шанс їх зв'язування з антитілами-Клебсієла перехресно реактивні антитіла. 6. Крохмальні та кишкові мікробиОсновний субстрат, необхідний для росту мікробних агентів товстої кишки, включає крохмаль і складні вуглеводи, які зазвичай знаходяться у значній кількості в кишечнику. У дослідженні, проведеному групою з Міннесоти з використанням водневих дихальних тестів як показника поглинання вуглеводів у здорових людей, було встановлено, що до 20% тестової їжі крохмалю доступна для метаболізму мікрофлорою товстої кишки [69] . Також було встановлено, що до 10% спожитого крохмалю може уникнути всмоктування в тонкій кишці [70], що вказує на те, що значна частина харчового крохмалю досягає товстого кишечника. В іншому експериментальному дослідженні було показано, що значне збільшення загальної бактеріальної популяції ентеробактеріальних мікробних агентів було помічено у фекаліях щурів, яких годували дієтами, що містять стійкий картопляний крохмаль, порівняно з тими, хто приймав швидкозасвоюваний восковий кукурудзяний крохмаль [71]. 7. Клебсієла та ферменти, що розщеплюють крохмальКрохмаль або високомолекулярні полісахариди спочатку повинні бути гідролізовані до більш дрібних субстратів, щоб транспортуватися до клітин. Для здійснення цього гідролітичного та транспортного процесу бактерії зазвичай використовують свої ферменти, що руйнують вуглеводи, такі як пуллуланази та ізоамілази [72]. Молекули крохмалю, які складаються приблизно з 20% амілози та 80% амілопектинових полімерів глюкози (рис. 2), каталізуються амілазами, циклодекстриназами, глюкозидазами та іншими ферментами крохмального розчинення, такими як бактеріальні пуллуланази [73]. Амілоза - це лінійний полімер, що складається з α-(1 → 4) зв'язки між залишками глюкози, і вони можуть легко гідролізуватися амілазами, присутніми в травних ферментах. Однак амілопектин є розгалуженим полімером, що складається з лінійних послідовностей амілозних ланцюгів, пов'язаних між собою α-(1 → 6) бічний ланцюг, що створює розгалужену структуру (рис. 3), яку можна розбити Клебсієла пуллуланази, але не ферментами травлення. Отже, травлення крохмалю в тонкій кишці обмежене нездатністю просвічувальних травних ферментів в кишечнику порушуватися α-(1 → 6) зв'язків амілопектину і тим самим призводить до утворення "твердого крохмалю", який накопичується в товстій кишці. Клебсієла може вижити в суворих середовищах, використовуючи деякі з продуктів розщеплення ферментів, які необхідні для захисту, підтримки та виживання цих мікробів. Окрім інших ферментативних продуктів, таких як нітрогеназа редуктаза, Клебсієла може також виробляти ферменти пуллуланази, що гідролізують крохмаль і дегранізують. Клебсієла може використовувати крохмаль як єдине джерело вуглецю та енергії за допомогою двох метаболічних шляхів. Перший передбачає позаклітинну деградацію до лінійних мальтодекстринів шляхом гідролізу глікозидних зв’язків через пов’язану з клітинною поверхнею пуллуланазу, а потім подальше розщеплення глікозидних зв’язків під дією позаклітинної глікозилтрансферази [74]. Частина загального харчового крохмалю, що вживається людиною щодня, протистоїть травленню амілазою підшлункової залози в тонкому кишечнику, таким чином, досягаючи товстої кишки [75]. Ця форма неперетравленого або стійкого крохмалю зазвичай ферментується мікрофлорою кишечника людини, забезпечуючи джерелом енергії та вуглецю понад 400 видів бактерій, що містяться в товстій кишці [76]. Група з Лос-Анджелеса показала, що середня кількість фекалій Клебсієла концентрація у осіб, які приймали дієту з високим вмістом вуглеводів/з низьким вмістом білка, була в сорок разів більшою, ніж у тих, хто харчувався з низьким вмістом вуглеводів/з високим вмістом білка [77]. Так само середня кількість Клебсієла було виявлено, що при інкубації з простими вуглеводними продуктами, такими як сахароза, лактоза та глюкоза, в десять разів вище, ніж з одинадцятьма різними амінокислотами [78]. Ці результати вказують на те, що складні вуглеводи, такі як продукти, що містять крохмаль, необхідні для росту, розмноження та стійкості багатьох ентеробактеріальних засобів, включаючи Клебсієла мікроби у товстій кишці. 8. Потенціал для використання дієти з низьким вмістом крохмалю у хворих на АС та КРСучасні медичні терапевтичні засоби, що застосовуються у пацієнтів з АС [79] та КД [80], включають нестероїдні протизапальні та імунодепресивні препарати, а також біологічні засоби. Однак ці методи лікування не можуть скасувати існуючі деструктивні ураження хребта і можуть бути пов'язані зі шкідливими побічними ефектами [81, 82]. Отже, реалізація інших терапевтичних заходів, особливо тих, що включають засоби для ефективного знищення збудників за допомогою споживання дієти з низьким вмістом крохмалю та, можливо, антибіотиків, разом із застосовуваними в даний час медичними методами лікування, може мати сприятливий ефект у лікуванні пацієнтів з АС та ХР. Ці дані підтверджують причинний ефект високого споживання крохмалю та сприятливий ефект від низького споживання крохмалю у пацієнтів із SpA, особливо з AS або IBD. Наприклад, у попередньому дослідженні на групі хворих на UC, аналіз вмісту хірургічно видалених ілеоцекальних областей показав, що ілеостомічна рідина містила значну кількість моносахаридів та дисахаридів [83]. Ці прості вуглеводні продукти, виявлені в ілеостомічній рідині, здається, отримують із крохмалю. В іншому проспективному лонгітюдному дослідженні вплив дієтичних факторів досліджували у групі італійських пацієнтів із ВЗК та групі здорових контролерів, які добре узгоджувались за віком, статтю та місцем проживання. Результати показали, що пацієнти з CD та UC мають підвищене споживання загальних вуглеводів та крохмалю із значно вищим відносним ризиком порівняно зі здоровими особами [84]. У подальшому оглядовому аналізі літератури щодо добового споживання дієт та їх зв'язку з мікробною флорою кишечника у хворих на ВЗК було показано, що значний обсяг даних свідчить про зв'язок між підвищеним споживанням вестернізованої вуглеводної їжі та підвищеною мікробністю кишечника. навантаження та виникнення ВЗК [85]. У лонгітюдному відкритому дослідженні, проведеному в групі з 36 пацієнтів з активним АС в «Лондонській клініці АС», більшість пацієнтів продемонстрували зниження швидкості осідання еритроцитів і загальної концентрації IgA, а також зменшення їх споживання для протизапальні ліки після дев'ятимісячного спостереження після зменшення споживання крохмалю в їжі [86]. Здається, що як при ВЗК, так і при АС, взаємодія між мікрофлорою кишечника та слизовою може сприяти розвитку цих захворювань. Ці результати підтверджують думку, що збільшення основної маси потенційно патогенних організмів, таких як Клебсієла в каловій мікрофлорі через велике споживання крохмалю може допомогти в ініціюванні та розвитку як АС, так і CD. Отже, здається, що виключення дієти, що містить складні вуглеводи, такі як крохмаль, але не прості вуглеводівмісні продукти, такі як глюкоза або сахароза, може стримувати ріст Клебсієла і може покращити процес захворювання та активність у пацієнтів з АС та CD. 9. ВисновкиПоказано, що AS та CD є двома взаємопов'язаними станами, в основному на основі існуючих генетичних та імунологічних особливостей. Основним патогенетичним механізмом, який може пояснити цей зв'язок, є "молекулярна мімікрія" або "перехресна реактивність" між Клебсієльна пневмонія і цільові тканини. Здається, що крохмаль є основним джерелом Клебсієла зростання в товстій кишці. Отже, збільшення споживання продуктів, що містять крохмаль, генетично сприйнятливими особами, такими як ті, що мають гени HLA-B27, може призвести до ініціації та розвитку АС або пов'язаного з спондилітом CD. Дієтичні маніпуляції у вигляді споживання дієти з низьким вмістом крохмалю можуть бути включені в лікування пацієнтів з АС або СD, особливо коли вони використовуються разом із сучасними лікувальними терапевтичними заходами. ПодякаЦе дослідження було підтримано Опікунами лікарні Middlesex та Американськими друзями Королівського коледжу Лондона. Список літератури
|