Знижене співвідношення M1-подібних/M2-подібних макрофагів у розширенні здорової жирової тканини під час інгібування SGLT2
Предмети
Анотація
Вступ
Ожиріння стало однією з головних проблем охорони здоров'я останніх десятиліть, будучи ключовим фактором ризику діабету 2 типу, серцево-судинних захворювань, дисліпідемії, гіпертонії та деяких видів раку, що призвело до збільшення смертності. У той час як лікування ожиріння та профілактика захворювань, пов’язаних із ожирінням, не завжди є успішними, підгрупа осіб із ожирінням має низький ризик метаболічних ускладнень. «Метаболічно здорове ожиріння» (MHO) представляє таку підгрупу осіб із ожирінням, які виявляють надмірне накопичення жирової тканини без несприятливих метаболічних ефектів, включаючи резистентність до інсуліну, непереносимість глюкози та дисліпідемію 1. Особи MHO характеризуються підвищеною здатністю до накопичення жиру жирової тканини з протизапальним фенотипом та зменшенням відкладення ектопічного жиру в печінці та скелетних м’язах; ці морфологічні та функціональні зміни в жировій тканині, отже, пригнічують розвиток інсулінорезистентності та кардіометаболічних захворювань.
Інгібітори натрію-глюкози котранспортер 2 (SGLT2) є пероральними протидіабетичними препаратами, які сприяють виведенню глюкози з сечею, блокуючи її реабсорбцію в проксимальних канальцях нирок. Раніше ми повідомляли, що інгібітор SGLT2 іпрагліфлозин (Ipra) сприяє розширенню епідидимальної жирової тканини (Epi) без погіршення системного метаболізму глюкози/ліпідів та жирового запалення у мишей із ожирінням 2,3. Цей стан підвищеної жирової маси зі збереженою метаболічною придатністю називають «здоровим розширенням жирової тканини», що схоже на жирову тканину, виявлену у осіб, що страждають на МГО.
У цьому дослідженні ми продемонстрували, що Іпра сприяла розширенню здорової жирової тканини, пов’язаному зі зниженим співвідношенням М1-подібних/М2-подібних банкоматів. Наше спостереження передбачало, що зміна M1-подібного/M2-подібного співвідношення банкоматів може призвести до того, що адипоцити індукують здорове розширення жирової тканини під час гальмування SGLT2, а ширше - це може запропонувати нові уявлення про механізми розширення жирової тканини, які можуть бути терапевтичними цілями. при пов'язаних із ожирінням супутніх метаболічних захворюваннях.
Матеріали і методи
Експерименти на тваринах
Метаболічний аналіз
Рівні глюкози в крові вимірювали за допомогою глюкометра (Glutest Pro R). Концентрацію інсуліну та вільних жирних кислот у сироватці крові вимірювали за допомогою імуноферментного аналізу (Morinaga, Йокогама, Японія) та ферментативного методу (Wako, Osaka, Japan), відповідно. Рівні бета-гідроксибутирату (BHB) визначали за допомогою колориметричного методу (ab83390, Abcam). Концентрації загального холестерину, тригліцеридів (TG) та аланінамінотрансферази (ALT) у сироватці крові вимірювали за допомогою Fuji Dry-chem 7000 V (Fujifilm Corporation, Токіо, Японія). Для тестів на толерантність до глюкози (GTT) мишей голодували протягом 16 годин із вільним доступом до води з подальшим внутрішньочеревним введенням глюкози (2 г/кг). Ми вимірювали концентрації глюкози в крові через 0, 15, 30, 60 та 120 хв після ін’єкції. Невимірна висока концентрація глюкози (> 600 мг/дл) була зафіксована при 600 мг/дл. Всі аналізи, за винятком GTT, проводили в режимі ad libitum.
Гістологія
Жирову тканину фіксували в 4% розчині параформальдегідфосфатного буфера протягом 24 годин при кімнатній температурі. Депарафінізовані зрізи (2 мкм) інкубували з протеїназою К протягом 5 хв для отримання антигену. Ендогенну пероксидазну активність блокували 0,3% H2O2 у метанолі протягом 30 хв. Для оцінки інфільтрації макрофагів та виявлення ІЛ використовували щуряче антитіло до F4/80 (клон: A3-1, розведення 1: 1000: AbD Serotec) та кроляче антиполіклональне антитіло IL-15 (1 мкг/мл, PeproTech). -15 експресують клітини в жировій тканині відповідно. Кількість коронкоподібних структур підраховували в 15 різних полях (× 200) на слайд і виражали як середнє число на поле. Позитивну площу IL-15 вимірювали в 15–18 різних полях (× 200) на слайді, використовуючи Image J. Розмір адипоцитів визначали кількісно за допомогою програми Фіджі (Image J) Adiposoft 1.13, як описано раніше 3 .
Культура клітин
Клітини 3T3-L1 були придбані у ATCC і зберігались у модифікованому Дульбекко середовищі Eagle (DMEM), що містить 10% телячої сироватки. Через два дні після досягнення 100% злиття клітини інкубували в DMEM, що містить 10% бичачої сироватки плода (FBS), 5 мкг/мл інсуліну, 0,5 мМ ізобутилметил ксантину та 0,25 мкМ дексаметазону (0 день). Через 2 дні середовище замінювали DMEM, що містить 10% FBS і 5 мкг/мл інсуліну (день 2). Потім живильне середовище кожні 2 дні замінювали DMEM, що містить 10% FBS. Диференційовані адипоцити стимулювали рекомбінантним мишачим IL-15 (50 або 250 нг/мл, Peprotech) у дні 10, 12 та 14, як описано раніше 14 із деякою модифікацією. На 15 день диференціації клітини фіксували 4% розчином параформальдегідфосфатного буфера протягом 2 год при кімнатній температурі і промивали 60% ізопропанолом протягом 1 хв. Фіксовані клітини фарбували відфільтрованим розчином Олійно-червоного O протягом 2 год при кімнатній температурі. Для кількісної оцінки вмісту ліпідів Oil Red O елюювали 100% ізопропанолом, а поглинання екстрактів вимірювали при 540 нм за допомогою мікропланшетного зчитувача (Bio-Rad Laboratories, Hercules, CA, USA).
Для виділення перитонеальних макрофагів 12-тижневим самцям мишей WT інтраперитонеально вводили 3% -ний тіогліколят Brewer. Через чотири дні макрофаги збирали шляхом перитонеального промивання з використанням холодного DMEM, що містить 2% FBS. Клітини культивували протягом 3 год у DMEM, що містив 0,25% бичачого сироваткового альбуміну (BSA) та 1% пеніциліну/стрептоміцину. Культури двічі промивали забуференним фосфатом фізіологічним розчином (PBS) для видалення неадгезивних клітин, попередньо оброблених BHB (1 або 10 мМ) у культуральному середовищі та стимулювали ліпополісахаридом (LPS, 1 нг/мл), IL-4 (10 нг/мл, Biolegend), або IL-13 (10 нг/мл, Biolegend) протягом ночі.
Виділення адипоцитів та клітин судинної фракції судин
Епі зважували, подрібнювали і розщеплювали у 15 мл розчину колагенази типу 2 (2 мг/мл, Вортінгтон) протягом 20 хв при 37 ° С при обережному струшуванні. Суміш для травлення центрифугували при 500 g протягом 3 хв. Плавучі адипоцити збирали для екстракції рибонуклеїнової кислоти (РНК), а гранули, що містять клітини судинної фракції строми (SVF), суспендували в PBS. Суспензію пропускали через 100-мкм нейлоновий сітчастий фільтр (BD Falcon) і центрифугували при 500 g протягом 3 хв для осадження клітин SVF.
Виділення лейкоцитів периферичної крові
Зразки крові отримували з хвостової вени за допомогою капілярних трубок. Кров змішували з 0,5 М етилендіамінтетраоцтовою кислотою (EDTA), лізували за допомогою лізингового буфера ACK і центрифугували при 500 g протягом 3 хв.
Проточна цитометрія та сортування клітин
Ізольовані клітини SVF або лейкоцити ресуспендували в 200 мкл PBS, що містить 0,25% BSA, 0,2 мМ EDTA та 1% пеніциліну/стрептоміцину. Клітини попередньо інкубували протягом 7 хв при 4 ° C у блоці Fc (CD16/32, BD Biosciences), а потім фарбували протягом 15 хв кон'югованими флуорофором антитілами при 4 ° C. Були використані такі антитіла: анти-CD45 (клон: 30-F11, Biolegend), анти-F4/80 (клон: BM8, Biolegend), анти-CD11b (клон: M1/70, Biolegend), анти-CD11c (клон: N418, Biolegend), анти-CD206 (клон: C068C2, Biolegend), анти-CCR2 (клон: SA203G11, Biolegend), анти-Ly6G/Ly6C (клон: RB6-8C5, Biolegend) та анти-CD115 (клон: AFS98, Biolegend) 15. Проточний цитометричний аналіз проводили за допомогою FACSCantoII (BD Biosciences). Сортування клітин проводили за допомогою FACSAriaII (BD Biosciences). Дані аналізували за допомогою програмного забезпечення FlowJo (v9.4.10, Tree Star).
Аналіз експресії генів
Загальну РНК екстрагували за допомогою Qiazol (QIAGEN). Синтез кДНК та кількісну ланцюгову реакцію полімерази в реальному часі (ПЛР) проводили, як описано раніше 16 .
Аналіз мікрочипів
Загальну РНК, вилучену з Епі, очищали за допомогою набору для очищення RNeasy MinElute (QIAGEN). Аналіз мікрочипів проводили в GeneticLab Co (Саппоро, Японія), використовуючи GeneChip Mouse Gene 2.0 ST Array (Affymetrix). Результат був проаналізований за допомогою Affymetrix Transcriptome Analysis ConsoleTM GeneticLab Co. Аналіз генної онтології проведено з використанням ресурсів біоінформатики DAVID 6.8.
Вестерн-блот-аналіз
Жирові тканини епідидимуму лізували, набиваючи кульки в буфер для лізису (2% SDS, 4 М сечовини, 1 мМ EDTA, 150 мМ NaCl, 50 мМ Tris pH 8,0), обробляли ультразвуком і центрифугували. Лізати відокремлювали 8% SDS-PAGE і переносили на мембрани PVDF. Вестерн-блот проводили з використанням фосфо (Ser473) - Akt антитіла (9271, Cell Signaling Technology) та Akt антитіла (9272, Cell Signaling Technology) з подальшим виявленням ECL (GE Lifescience). Інтенсивність смуги визначали кількісно за допомогою програмного забезпечення NIH Image J.
Статистичний аналіз
Всі дані були проаналізовані за допомогою Graph Pad Prism 6 і представлені як середнє значення ± стандартна похибка середнього значення. Значення р
Результати
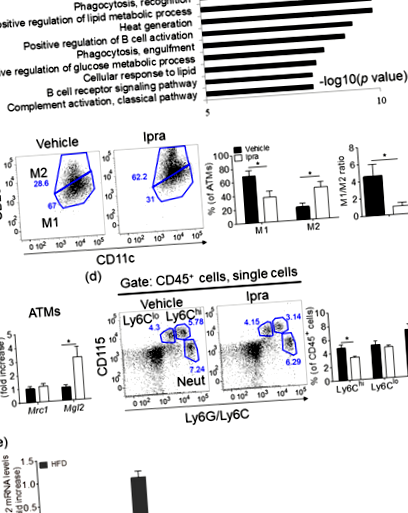
Ipra індукує розширення жирової тканини зі зниженим співвідношенням M1-подібних/M2-подібних банкоматів у мишей WT, що харчуються HFD
Фармакологічне зменшення М2-подібних банкоматів шляхом блокування передачі сигналів рецептора фактора-1, що стимулює колонію, не впливає на розширення жирової тканини у мишей, що харчуються HFD, які отримували Іпра
Дефіцит CCR2 посилює розширення здорової жирової тканини, спричинене Ipra, у мишей, що харчуються HFD
Тіло кетонів послаблюється Il15 підвищення регуляції в M1-поляризованих макрофагах
Що стосується можливого фактора, який гальмує Il15 Експресія в клітинах SVF під час лікування Ipra ми зосередили увагу на кетоновому тілі BHB, концентрація якого в сироватці крові збільшена у мишей, оброблених Ipra 2. BHB значно ослаблений Il15 індукція в M1-поляризованих перитонеальних макрофагах (рис. 4г), не впливаючи Il1b, Іл6, або Тнфа індукція в M1-поляризованих перитонеальних макрофагах (додаткова фігура 5c). У мишей HFD, які отримували Ipra, тоді як обробка GW2580 не змінила концентрацію BHB у сироватці крові, миші CCR2 KO показали збільшення концентрації BHB у сироватці крові (рис. 4д).
IL-15 пригнічує накопичення ліпідів у клітинах 3T3-L1 з Pck1 регулювання
Відповідно до попереднього звіту 14, рекомбінантний IL-15 дозозалежно пригнічував накопичення ліпідів у адипоцитах 3T3-L1 (рис. 4f), у поєднанні зі зниженою експресією ліпогенних генів, таких як Pck1, Фасн, і Scd1 (Рис. 4g). Серед цих ліпогенних генів, Pck1, повідомляється, що кодує фосфоенолпіруваткарбоксикіназу (PEPCK) опосередковує гліцеронегенез в адипоцитах, сприяючи тим самим накопиченню TG шляхом повторної етерифікації жирних кислот. Повідомляється, що посилена реестерифікація жирних кислот шляхом надмірної експресії PEPCK в жировій тканині призводить до розширення жиру без резистентності до інсуліну 20, що свідчить про те, що накопичення ТГ, залежне від PEPCK, може сприяти здоровому розширенню жирової тканини. В адипоцитах з епі мишей, оброблених Іпра, Pck1 експресія була значно збільшена щодо мишей, оброблених носієм (рис. 4h). Подібний результат був отриманий у Epi від мишей CCR2 KO, оброблених Ipra (додаткова фігура 5e). У контрасті, Pck1 експресія зменшилась у епі індукованих HFD мишей із ожирінням порівняно з мишами, що годували SD (додаткова фігура 5f).
Іпра змінює підвид кераміду та сфінгомієліну в жировій тканині мишей, що харчуються HFD
Ми провели ліпідомічне профілювання Epi, щоб оцінити, чи здорове розширення жиру супроводжувало змінені ліпідні профілі, включаючи окремі класи ліпідів. Лікування препаратом Іпра знижувало керамід (CER) [FA24: 1] та сфінгомієлін (SM) [FA24: 1], а також збільшувало SM [FA18: 0] у мишей, що годувались HFD (Додаткова фігура 6a). Дефіцит CCR2 у мишей, що годувались HFD, під час лікування Іпра також мав подібні ефекти на підвиди CER та SM у Epi (додаткова фігура 6b). Іпра мало впливала на ди- та триацилгліцерин або підвиди вільних жирних кислот у епі мишей, що годували HFD (дані не наведені).
Кетогенні дієтичні фенокопії розширення жирової тканини у мишей, які отримували лікування Іпра
Нарешті ми дослідили, чи можуть кетонові тіла викликати розширення жиру без погіршення системного метаболізму глюкози в природних умовах, і чи супроводжує це зниження Il15 як це спостерігається у культивованих M1-поляризованих перитонеальних макрофагах (рис. 4г). Восьмитижневих самців WT мишей годували кетогенною дієтою протягом 4 тижнів; через 2 тижні кетогенної дієти рівень ВГБ у сироватці крові значно підвищувався порівняно з контрольною дієтою (рис. 5а). Кетогенна дієта не змінила ваги тіла у мишей WT порівняно з тими, кого годували контрольною дієтою (рис. 5b). Кетогенна дієта значно збільшила вагу Епі (рис. 5в), не викликаючи гіперглікемії або гіперінсулінемії (рис. 5г). Крім того, кетогенна дієта значно придушена Il15 вираз із збільшеним Pck1 вираз в Епі (рис. 5д). Аналіз ліпідоміки підтвердив, подібно до дефіциту Іпра та CCR2, кетогенна дієта знизила CER [FA24: 1] та SM [FA24: 1], а також збільшила SM [FA18: 0] в Epi (додаткова фігура 6c).
Обговорення
З урахування попередніх робіт, що повідомляли про вплив інгібіторів SGLT2 на мишей, що харчуються HFD, вплив інгібіторів SGLT2 на масу тіла та ожиріння різниться в ході досліджень; лікування тофогліфлозином пригнічувало збільшення маси тіла, індуковане HFD, а також прогресування стеатозу печінки, коли його вводили протягом 20 тижнів, починаючи з початку годування HFD 22. Навпаки, 4-тижневе лікування ремогліфлозином після 11-тижневого годування HFD послаблює стеатоз печінки без зміни збільшення маси тіла 23. Інші звіти показали, що люзеогліфлозин знижував масу печінки та рівень АЛТ у сироватці крові у мишей, які отримували STZ та отримували HFD, не впливаючи на збільшення маси тіла 24. У сукупності, хоча точні механізми залишаються невідомими, ці спостереження дозволяють припустити, що протокол дослідження, особливо в терміни введення інгібіторів SGLT2 під час годування HFD та мишачої моделі, може вплинути на збільшення маси тіла у мишей.
Як і на гризунах, дослідження на людях показало, що інгібітор SGLT2 емпагліфлозин викликав адаптивне збільшення споживання енергії у пацієнтів з діабетом 2 типу, що спричинило значно меншу втрату ваги, ніж очікувана від енергії, що розсіюється через глікозурію 25. Це свідчить про те, що інгібування SGLT2 в основному викликає подібні біологічні реакції апетиту та споживання енергії у людини та мишей. Хоча попередні дослідження на людях 26,27,28 постійно показували, що лікування інгібіторами SGLT2 знижує масу тіла в середньому, наші попередні дані продемонстрували, що приблизно 20% пацієнтів, які отримували Іпра, не досягли більш ніж 1% зниження маси тіла 2. Хоча дослідження на людях переважно описують втрату ваги при лікуванні інгібіторами SGLT2, вплив інгібіторів SGLT2 на масу тіла та ожиріння в дослідженнях на мишах був змінним.
Повідомляється, що інші протидіабетичні засоби, такі як тіазолідиндіон 10, інгібітор дипептидилпептидази-4 та метформін 30, мають прямий вплив на банкомати, викликаючи зсув домінуючого М2. Однак, враховуючи низький рівень експресії Slc5a2 у макрофагах, адипоцитах, клітинах SVF та жировій тканині Іпра навряд чи матиме прямий вплив на такі клітини або тканину. В контексті супутніх метаболічних захворювань, пов’язаних із ожирінням, було показано, що гіперглікемія впливає на дію IL-4 на М2-подібну поляризацію в макрофагах, що оцінюється зниженою експресією генів, пов’язаних з М2, і зниженою функціональною активністю аргінази 31. Отже, поліпшення гіперглікемії можна розглядати як один із механізмів зміни M1-подібного/M2-подібного співвідношення банкоматів у мишей, які отримували Іпра.
Серед генів, пов’язаних з М1, в жировій тканині, змінених лікуванням Іпра, Il15 суттєво знижується у режимі SVF мишей, оброблених Іпра. Відповідно до попереднього звіту 35, імунофарбування IL-15 в Epi передбачає, що банкомати вважаються клітинним джерелом IL-15 у SVF. Il15 Як повідомляється, абляція у мишей призводить до значного збільшення ваги, незалежно від апетиту; примітно, у мишей не спостерігається асоційованого із ожирінням запалення, що характеризується збільшенням сироваткового IL-6 та концентрацією фактора некрозу пухлини-α 36. Крім того, згідно з нашими спостереженнями, лікування диференційованих людських адипоцитів рекомбінантним IL-15 призвело до зменшення відкладення ліпідів, що свідчить про його прямий інгібуючий ефект на адипогенез 14. Хоча патологічне значення IL-15 для розширення здорової жирової тканини вимагає подальших досліджень, індуковане Іпро регулювання Il15 у клітинах SVF, можливо, в банкоматах, схоже, сприяє розширенню адипоцитів паракринним способом.
Оскільки кондиціоноване середовище жирової тканини у мишей, які годували ІФР HFD, збільшувалось Mrc1 і Mgl2 експресія в перитонеальних макрофагах порівняно з мишами, які отримували HFD, що отримували носій, речовини, що походять з жирової тканини, а також кетонове тіло вважаються можливими відмінними та унікальними факторами для індукованої Іпра функціональної модуляції банкоматів. Відомо, що різні сигнальні молекули, що виділяються з відмираючих клітин, діють як хемоаттрактанти і впливають на імунні реакції 39,40,41. У жировій тканині ми раніше показали, що індукований макрофагами лектин С-типу (Mincle), датчик збудника для Мікобактерії туберкульозу, локалізується в банкоматах, що складають CLS, і активується ендогенним лігандом, що виділяється з відмираючих адипоцитів 42. Активація мінкла індукує запальні реакції та вироблення позаклітинного матриксу в макрофагах, що може погіршити запалення жирової тканини та обмежити HFD-індуковану гіпертрофію адипоцитів, щоб інгібувати ектопічне накопичення ліпідів. Отже, речовини з відмираючих та/або мертвих адипоцитів також пропонуються локально впливати на характер банкоматів, а знижена загибель адипоцитів, спричинена Іпра, може впливати на фенотипи банкоматів.
На закінчення, це дослідження розкрило механізми, опосередковані ATM, за допомогою яких інгібування SGLT2 сприяло здоровому розширенню жирової тканини. Крім того, ATM пропонують бути потенційними терапевтичними цілями для пов'язаних із ожирінням метаболічних супутніх захворювань через зміни, які вони індукують в характеристиках жирової тканини.
- Ліполіз жирових тканин, що повторно переглядається (знову!) Залучення лактату в антиліполітичну дію інсуліну -
- Гірка диня покращує глікемічний контроль та запалення в жировій тканині ожиріння та діабетика
- Жирова тканина, дієта та старіння - ScienceDirect
- Дієта з високим вмістом жиру збільшує жирову тканину кісткового мозку (МАТ), але не змінює трабекулярність або
- Підтипи рецепторів ангіотензину регулюють оновлення і реконструкцію жирової тканини - Тюрин-Кузьмін -