Захисний ефект тривалого пригнічення ангіотензину II
Анотація
природний процес старіння пов'язаний з поступовою модифікацією і, зрештою, втратою функції органу. Ці зміни є загальними для всіх видів. Загалом існує взаємозв'язок між структурними та функціональними змінами, пов'язаними зі старінням. У ссавців такі дегенеративні процеси, як артеріосклероз, розвиток старечих бляшок у мозку та заміщення функціональної паренхіми фібросполучною тканиною в різних органах, вважаються проявами старіння (19, 41).
Ультраструктурно зменшення кількості клітинних органел, таких як мітохондрії, є загальним процесом старіння (13, 21, 36). Довічне виробництво вільних радикалів може зіграти головну роль у зменшенні кількості, як у структурних, так і в функціональних модифікаціях мітохондрій (6, 20, 38). Широко постулюється, що активні форми кисню (АФК) спричинені причинно-наслідковим процесом старіння (19, 20). У цьому сенсі попередні дані (4, 17) підтвердили, що активність синтази оксиду азоту (NOS) в аорті та оксиду азоту (NO) з віком зменшується, тоді як хронічне тривале введення інгібіторів ангіотензину II (ANG II) підтримує ендотеліальна активність NOS у старих тварин. Більше того, було виявлено, що мітохондрії із сердець вікових щурів, хронічно оброблених інгібіторами ANG II, мали підвищену активність NOS та зменшували утворення пероксиду водню порівняно з контролем (10).
Система ренін-ангіотензин (RAS) завдяки своєму активному агенту ANG II надає велику різноманітність фізіологічних дій, що включають регуляцію артеріального артеріального тиску, гомеостаз натрію та води та стимуляцію інших ендокринних систем. Деякі дії здійснюються як ендокринна система. За останні кілька десятиліть величезна кількість інформації розкрила безліч шкідливих серцево-судинних та ниркових ефектів, пов’язаних із надлишком АНГ II. Зараз відомо, що цей пептид діє як паракринний, аутокринний та внутрішньокринний фактор, механізми дії якого варіюються від збудження або пошкодження цілих органів до впливу на ріст та функцію клітин, зміни внутрішньоклітинних сигнальних шляхів та сприяння змінам позаклітинного матриксу. Нещодавно шкідливі ефекти ANG II у серці були пов’язані з активацією адаптерного білка p66 Shc (18).
Протягом останніх років ми досліджували шкідливі наслідки старіння на органи-мішені у звичайних самців щурів Wistar. Одночасно ми проаналізували захисний ефект хронічного пригнічення ANG II або за допомогою CEI (еналаприл), або AT1RB (лозартан), що вводиться після відлучення від цих змін. Наведені результати описують серцево-судинні зміни, спричинені старінням у нормальної щури, та захисний ефект, який спостерігається в цій системі внаслідок тривалого інгібування ANG II кожним із цих фармакологічних засобів. Більше того, ми також визначили вплив кожного лікування на тривалість життя у нормальних щурів.
Щури та експериментальний дизайн для лікування наркотиками
Самців щурів Wistar використовували та отримували догляд відповідно до та за ліцензією, наданою нашим Інституційним комітетом з догляду та використання тварин та відповідно до Посібник з догляду та використання лабораторних тварин (Національний інститут охорони здоров’я, переглянутий у 1996 р.). Тварини (n = 120) були випадково розділені на три рівні групи після відлучення: 1) контроль (водопровідна вода для пиття), 2) лозартан (30 мг · кг −1 · день -1 у питній воді), та 3) еналаприл (10 мг · кг -1 раз на добу -1) (обидва препарати від Merck, Rahway, NJ). Щурів утримували групами по п’ять осіб у клітці з 12: 12-годинним циклом світло-темрява та діапазоном температур 20–22 ° C. Чау-чау та питний матеріал були у вільному доступі.
Вимірювання систолічного артеріального тиску та ваги серця та аорти
Систолічний артеріальний тиск (SBP) вимірювали один раз на місяць протягом усього експериментального періоду у свідомих щурів при 30 ° C за допомогою плетизмографії хвостових манжет, використовуючи датчик тиску (Narco Biosystems, Houston, TX), підключений до осцилографа. Споживання води та масу тіла визначали двічі на тиждень для коригування прийому препарату. Після 6 місяців лікування 10 тварин з кожної групи вбивали під пентобарбітальною анестезією (40 мг/кг). Подібним чином, після 18 місяців, 10 щурів від кожної групи було вбито. Серце, аорту та брижову артерію вирізали, очистили та зважили. Після видалення передсердь правий шлуночок відокремлювали та зважували.
Довжина хвоста
Довжина хвоста як міра зростання (14) вимірювалась стандартною метричною лінійкою від заднього проходу тварини до кінчика хвоста тим самим експериментатором для забезпечення рівномірності.
Гістологічна оцінка
Для гістологічного визначення лівий шлуночок і та ж частина грудної аорти були виділені, вміщені в 10% формальдегід і вбудовані в парафін. Гістологічні зрізи фарбували гематоксилін-еозином та трихромом Массона. Колаген III типу також оцінювали за допомогою імуногістохімії (ІГХ) у лівому шлуночку. Його кількісно визначали за допомогою моноклональних антитіл типу III до колагену (Biogenex, San Ramon, CA), у розведенні 1: 100. Ширину аорти оцінювали за допомогою IHC, використовуючи моноклональні антитіла до α-актину (Sigma, Сент-Луїс, Міссурі).
Морфометричний аналіз проводили в обох тканинах; до них належали поперечний діаметр кардіоміоцитів і ширина судини. Було зроблено двадцять гістологічних зрізів кожного органу та проаналізовано 10 судинних структур на кожен гістологічний зріз.
Гістологічні зрізи аналізували за допомогою світлового мікроскопа Nikon E400 (Nikon Instrument Group, Мелвілл, Нью-Йорк). Для оцінки було використано програмне забезпечення Image-Pro Plus 4.5.1.29 (Media Cybernetics, Silver Spring, MD) 1) ширина аорти та площа аорти, 2) діаметр міокардіоцитів і площа поперечного перерізу, і 3) субендокардіальний та субперикардіальний фіброз.
Аналіз проводив один дослідник, засліплений експериментальними групами.
Морфометричні прийоми
Ширина аорти.
Поперечний переріз посудини вимірювали перпендикулярною лінією, що йде від зовнішнього до внутрішнього периметра. Отримані дані виражаються в мікрометрах.
Аортальна область.
Виміряно чотири протилежні ділянки аорти на посудину, за винятком адвентиції. Отримані дані виражаються в квадратних міліметрах.
Діаметр і площа перерізу міокардіоцитів.
П'ять зображень міокарда були випадково отримані. Було досліджено десять послідовних клітин кожного зображення на загальну кількість 50 міокардіоцитів на тварину. Діаметр і площа міокардіоцитів оцінювали в × 400.
ДІАМЕТР МІОКАРДІОЦИТІВ.
Поздовжній та поперечний діаметри кожної клітини отримували та усереднювали. Результати виражаються в мікрометрах.
ПОПЕРЕКЛАСНА МІОКАРДІОЦИТОВА.
Програмне забезпечення обчислювало поверхню кожної комірки. Результати виражаються в квадратних мікрометрах.
Оцінка фіброзу серця.
Трихром і колаген III Массона використовували для визначення серцевого фіброзу (× 100). Ступінь тяжкості серцевого фіброзу оцінювали в 10 областях міокарда, 5 із субендокарда та 5 із області субепікарда. Інтенсивність фіброзного процесу виражалася у відсотках від загальної площі тканини, зайнятої забарвленою тканиною.
Тривалість життя
Щурів, що залишились у кожній групі, використовували для визначення часу виживання. Потім за всіма тваринами стежили до моменту смерті. За станом усіх тварин щодня стежив ветеринар. Під час дослідження окремі щури були евтаназовані відповідно до критеріїв ветеринарного лікаря: пухлини, що погіршують рух, кровотеча з виразки живота або стопи, респіраторні інфекції або досягнення стану, що вмирає (неможливість їсти чи пити або важке дихання). У всіх випадках, коли просили евтаназії, датою евтаназії вважали дату смерті.
Статистика
Усі дані представлені як середні значення ± SE; a P значення −1 · день −1).
Таблиця 1. Зміни маси тіла протягом усього експериментального періоду у контрольних та лікуваних нормальних щурів
Дані (у г) виражаються як середні значення ± SE для n = 20 щурів/група.
* P -1 день 1 протягом 1 місяця) та стабілізується у віці 6 місяців (10 мл 100 г -1 день 1). Він збільшувався при застосуванні еналаприлу протягом усього експериментального періоду, 31 ± 2% через 6 місяців та 28 ± 3% через 18 місяців.
Ваги серця, лівого шлуночка та аорти були нижчими в обох групах оброблених тварин порівняно з нормальними контрольними щурами на 6 (табл. 2) та 18 (табл. 3) міс. Коли вага органу нормалізувалась за масою тіла, у щурів, які отримували еналаприл, зникали відмінності через нижчу масу тіла, що свідчить про те, що в цьому випадку ця взаємозв'язок була недостатньо.
Таблиця 2. Вага тіла та органів у 6-місячних контрольних та лікуваних звичайних щурів
Дані виражаються як середні значення ± SE для n = 10 щурів/група. BW, маса тіла; HW, вага серця; LVW, вага лівого шлуночка; RVW, вага правого шлуночка; AoW, маса аорти; ЩЕЛЬ, вага брижової артерії.
Таблиця 3. Вага тіла та органів у 18-місячних контрольних та лікуваних звичайних щурів
Дані виражаються як середні значення ± SE для n = 10 щурів/група.
Таблиця 4. Систолічний артеріальний тиск протягом усього експериментального періоду у контрольних та лікуваних щурів
Дані (у мм рт. Ст.) Виражаються як середнє значення ± SE для n = 20 щурів/група.
Рис. 1.Гістологічні мікрофотографії аорти через 18 міс. Імуномаркірування актину проти α-гладкої мускулатури, збільшення 400 ×. Репрезентативні мікрофотографії показують відмінності щодо ширини аорти в контрольній групі, еналаприлі та лозартані.
Таблиця 5. Ширина та площа аорти, діаметр і площа поперечного перерізу міоцитів у 6- та 18-місячних контрольних та оброблених нормальних щурів
Дані виражаються як середні значення ± SE для n = 10 щурів/група. D, діаметр; CSA, площа перерізу.
* P
Рис.2.Гістологічні мікрофотографії міокарда через 18 міс. Трихром Массона, збільшення 400 ×. Репрезентативні мікрофотографії показують відмінності щодо площ поперечного перерізу міоцитів у контрольній групі, групах еналаприлу та лозартану.
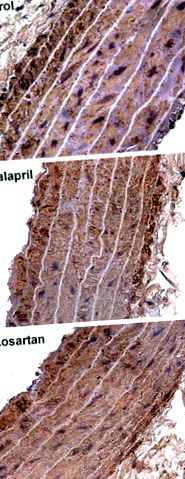
Рис.3.Гістологічні мікрофотографії міокарда через 18 міс. Імуномаркування проти колагену III, збільшення 400 ×. Репрезентативні мікрофотографії показують відмінності щодо площ поперечного перерізу міоцитів та фіброзу у контрольних групах, групах еналаприлу та лозартану.
Таблиця 6. Зміни у відсотках субперикардіального та субендокардіального фіброзу та колагену III у серцях 18-місячних контрольних та лікуваних нормальних щурів
Дані (у%) виражаються як середні значення ± SE для n = 10 щурів/група. Spe, субперикардіальна; Сен, субендокардіальний.
* P Shc ген. Водночас остання надає стійкість до окисного стресу (34). Вважається, що рецептор AT1 активує внутрішньоклітинну передачу сигналів, контрольовану факторами росту та їх рецепторами тирозинкінази; цей нижній механізм містить p66 Shc адаптерний білок, який може відігравати роль у старінні клітин. Недавня доповідь на стор Shc -нокаутовані миші пропонують фундаментальну роль цього гена в опосередкованому ANG II ремоделюванні серця (18). Інші висновки свідчать про те, що активація RAS може бути важливою для фізіологічних змін у віці серця (23); попередні дані показали, що CEI зменшують приріст апоптотичних клітин серцевої тканини, пов'язаних із старінням (22).
Зв'язок між ANG II та пошкодженням судин, схоже, також пов'язана з окислювальним стресом. Експериментальні дані демонструють, що посилене утворення АФК за рахунок активації NAD (P) H-оксидази є обов'язковим етапом ефектів ANG II (7, 35, 46). Зростаючі докази вказують на те, що АФК функціонують як важливі внутрішньо- та міжклітинні другі вісники для модуляції сигнальних каскадів, що призводять до пошкодження судин при серцево-судинних захворюваннях (43); в іншому недавньому звіті зазначено, що ANG II сприяє запаленню судин шляхом індукування передчасного старіння клітин гладких м’язів судин in vivo та in vitro (27).
Важливою знахідкою цього дослідження є тривалий термін життя обох груп оброблених щурів, що підтверджує попередні результати у мишей (12). Чітких відмінностей у причині смерті не вдалося виявити ні у контрольних, ні у лікуваних тварин. Єдиним доказом погіршення стану тіла у всіх випадках була втрата ваги, яка почалася пізніше у лікуваних тварин. Таким чином, серцево-судинний захист не може бути безпосередньо пов'язаний з продовженням максимального терміну життя. Незважаючи на це, було постульовано, що p66 Shc є частиною шляху передачі сигналу, який регулює апоптотичні реакції на стрес і тривалість життя ссавців, а рівні експресії цього гена корелюють із тривалістю життя мишей (44). Окислювальний стрес бере участь у цьому шляху; таким чином можна припустити, що інгібування RAS має загальну антиоксидантну та протизапальну дію (37) і завдяки цим діям може продовжити максимальний термін життя щурів. У цьому сенсі стійкість до окисних пошкоджень постулюється як один із факторів збільшення мишачого життя.
На закінчення, ці дослідження продемонстрували, що хронічне тривале інгібування RAS або з CEI, або з AT1RB викликає однаковий і значний захисний ефект на шкідливий процес старіння серцево-судинної системи та істотне продовження тривалості життя в нормі Щур Вістар. Захист визначали за допомогою функціонального та структурного аналізу. Підвищена активність NOS в ендотелії аорти та мітохондріях серця може свідчити про зниження механізмів окисного стресу навіть на рівні мітохондрій. Стійке зниження окисного навантаження може пояснювати захисний ефект. ANG II індукує надмірне вивільнення супероксидного радикала судин, що утворюється в результаті стимуляції NADPH-оксидази, яка інактивує NO. Інгібування ANG II послаблює окислювальний стрес та покращує розширення судин. Низький рівень окисного стресу може бути ключем до зменшення запальних процесів та виробництва цитокінів та факторів росту. Цей шлях зменшить фіброз і збереже функцію та структуру в аналізованих органах-мішенях і може залучитись до тривалого життя.
Ці дослідження були підтримані грантом PIP 02363/04 від Національної дослідницької ради Аргентини (CONICET). Н. Бассо та Н. А. Терраньо є членами CONICET.
СНОПКИ
Витрати на публікацію цієї статті були частково сплачені за рахунок оплати сторінок. Тому стаття має бути позначена цим «реклама”Відповідно до 18 U.S.C. Розділ 1734 виключно для зазначення цього факту.
Автори визнають професійну допомогу Нори Палії як ветеринарного лікаря та доктора Інеса Стелли в гістологічній оцінці тканин.
Поточні адреси: N. A. Terragno, 2-й відділ фармакології, Медичний факультет, Університет Буенос-Айреса, Парагвай 2155, Po 16, сектор M, C1121ABG, Буенос-Айрес, Аргентина; Л. Фердер, кафедра фізіології та фармакології. Медична школа Понсе, вул. Доктора Ана Перес Маршан, поштова скринька 7004, Понсе, Пуерто-Рико 00732-7004.
- Фенольні кислоти сучасних та стародавніх зерен Вплив на модель клітин in vitro - Truzzi - 2020 - Journal
- Вивчення ефекту проти ожиріння через пригнічення активності ліпази підшлункової залози Diospyros kaki
- Онтогенетичні кореляти дієти в мадагаскарських лемурах - Годфрі - 2004 - Американський журнал фізики
- Захисна дія грудного вигодовування проти інфекції сечовивідних шляхів
- Ожиріння займає центральний етап Етичний журнал Американської медичної асоціації