Дослідження ефекту проти ожиріння через пригнічення активності ліпази підшлункової залози шкірки плодів та цитрусових нешиу діоспірос какі
Гьо-Нам Кім
1 Департамент харчової науки та біотехнологій, Університет Кюнгнам, Кьонсангнам-до 51767, Республіка Корея
Мі-Рае Шін
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Сун Хо Шін
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Ах Реум Лі
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Джу Янг Лі
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Бу-Іль Сео
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Мін Йонг Кім
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Тае Хун Кім
3 Департамент харчових наук та біотехнологій, Університет Тегу, 201 Daegudae-ro, Gyeongsangbuk-do 712-714, Республіка Корея
Чон Сук Но
4 Департамент харчової науки та харчування, Університет Тонмён, Пусан 48520, Республіка Корея
Людина Хі Рі
5 Коледж ветеринарної медицини, Національний університет Кюнгпук, Тегу 41566, Республіка Корея
Сон-Су Ро
2 Коледж корейської медицини, Університет Тегу Хаані, Кьонсан 38610, Республіка Корея
Анотація
Ліпаза підшлункової залози є ферментом, відповідальним за перетравлення і всмоктування тригліцеридів, оскільки її пригнічення є одним із найбільш широко вивчених методів, що застосовуються для визначення потенційної активності природних продуктів для пригнічення поглинання жиру в їжі. Зменшення споживання енергії з харчових жирів за рахунок пригнічення цього ферменту може бути чудовою стратегією для профілактики та лікування ожиріння. Інгібуючу активність на фермент ліпази підшлункової залози плодів діоспіроса какі та екстракту шкірки цитрусового нешиу (PCM) оцінювали in vitro та вивчали його ефекти проти ожиріння на основі аналізу показників ліпідів у сироватці крові на мишах з високим вмістом жиру (HFD-). in vivo. PCM вводили перорально у дозі 50 і 200 мг/кг маси тіла протягом 6 тижнів. Крім того, активність панкреатичної ліпази оцінювали за допомогою орлістату (позитивний контроль). PCM виявляв інгібуючий ефект на активність ліпази зі значенням IC50 507,01 мкг/мл. Більше того, триацилгліцерин у сироватці крові, загальний рівень холестерину та маса вісцерального жиру були значно знижені порівняно з контрольними мишами HFD у мишей, оброблених PCM 200 мг/кг (p рівень LDL-холестерину m g/d L = TC - холестерин HDL - TG 5 .
2.4. DPPH Радикальна активність PCM
Визначення антиоксидантної активності PCM проводили методом вилучення радикалів DPPH за методом Park et al. [24]. 100 мкл етанольного розчину PCM (пробіл: 100 мкл етанолу) додавали до 100 мкл етанольного розчину DPPH (60 мкМ) за допомогою 96-лункового планшета. Аскорбінову кислоту (стандартний зразок) готували для восьми концентрацій (0,5, 1, 2, 5, 10, 20, 50 та 100 мкг/мл). PCM готували для шести концентрацій (5, 10, 20, 50, 100 та 200 мкг/мл). Реакційну суміш інкубували в темряві при 25 ° С протягом 30 хв. Оптичну щільність визначали, використовуючи пристрій зчитування мікропланшетів нескінченний M200 PRO (Tecan, Австрія). Суміш вимірювали спектрофотометрично при 540 нм. Антиоксидантну активність кожного зразка виражали через IC50 (мікромолярна концентрація, необхідна для інгібування утворення радикалів DPPH на 50%, розрахована з кривої інгібування log-дози). Активність поглинання радикалів розраховували у відсотках, використовуючи таке рівняння:
2.5. ABTS - радикальна активність PCM
Активність поглинання радикалів ABTS різних екстрактів вимірювали згідно модифікованого методу Re et al. [25]. Вихідний розчин ABTS розчиняли у воді до концентрації 7,4 мМ. Катіон радикалу ABTS (ABTS) отримували шляхом взаємодії вихідного розчину ABTS з 2,45 мМ персульфатом калію і дозволяючи суміші стояти протягом 14 годин при кімнатній температурі в темряві. Розчин ABTS розбавляли етанолом для отримання поглинання 0,70 ± 0,02 при 750 нм. Після додавання 95 мкл розведеного розчину ABTS (750 нм = 0,70 ± 0,02) до 5 мкл зразка суміш залишали при кімнатній температурі на 15 хв у темряві. Поглинання при 750 нм вимірювали, використовуючи пристрій зчитування мікропланшетів нескінченний M200 PRO (Tecan, Австрія). Заготовку готували таким же чином, за винятком того, що замість зразка використовували дистильовану воду. Активність поглинання радикалів розраховували у відсотках, використовуючи таке рівняння:
2.6. Вимірювання інгібітора ліпази підшлункової залози свиней
Активність ліпази підшлункової залози була змінена на основі методу, про який раніше повідомляли Kim et al. [26]. Коротко, ферментний буфер готували додаванням 6 мкл розчину свинячої панкреатичної ліпази (Sigma-Aldrich) у буфер, що містить 10 мМ MOPS (морфолінпропансульфонова кислота) і 1 мМ EDTA, рН 6,8, до 169 мкл буфера Tris (100 мМ Tris-HC1 і 5 мМ CaCl2, рН 7,0). Потім або 20 мкл PCM у досліджуваній концентрації (100, 250, 500 та 1000 мкг/мл) або орлістат (0,1, 0,25, 0,5 та 1 мкг/мл) змішували з 175 мкл ферментного буфера та інкубували протягом 15 хв при 37 ° C з 5 мкл розчину субстрату [10 мМ p-NPB (п-нітрофенілбутират) в диметилформаміді]. Ферментативні реакції давали можливість тривати протягом 35 хв при 37 ° С. Активність ліпази визначали шляхом вимірювання гідролізу p-NPB до p-нітрофенолу. Збільшення поглинання світла при 405 нм вимірювали за допомогою зчитувача мікропланшетів, модель нескінченного M200 PRO (Tecan, Австрія). Інгібування активності ліпази виражалося як відсоток зменшення OD при інкубації ліпази свинячої підшлункової залози з досліджуваними сполуками. Інгібування ліпази (%) розраховували за такою формулою:
де A - активність без інгібітора, a - негативний контроль без інгібітора, B - активність з інгібітором, b - негативний контроль з інгібітором. Результати були виражені у середньому (n = 4).
2.7. Загальний вміст фенолу та флавоноїдів
Загальний вміст фенольних речовин PCM був визначений м’якою модифікацією за методом Folin-Ciocalteu [27]. 10 мкл PCM і дистильовану воду 790 мкл добре струшували, а потім змішували з 50 мкл реагенту Фоліна-Чіокальтеу протягом 1 хв. Після цього додавали 150 мкл 20% розчину карбонату натрію (Na2CO3) і суміш струшували протягом 2 год при 20 ° C. Нарешті, поглинання отриманого кольору вимірювали при 765 нм. Загальний вміст фенолу виражали у мг еквівалентів галової кислоти на грам екстракту. Представлені значення є середнім значенням за три вимірювання. Флавоноїд витягували та визначали кількісно шляхом адаптації методу Lister et al. [28]. PCM 50 мкл і 500 мкл діетиленгліколю добре змішували. Потім додавали 1 н NaOH 5 мкл і суміш інкубували протягом 1 год при 37 ° С. Нарешті, поглинання отриманого кольору вимірювали при 420 нм. Вміст флавоноїдів виражали у мг еквівалентів нарінгіну на грам екстракту. Представлені значення є середнім значенням за три вимірювання.
2.8. Статистичний аналіз
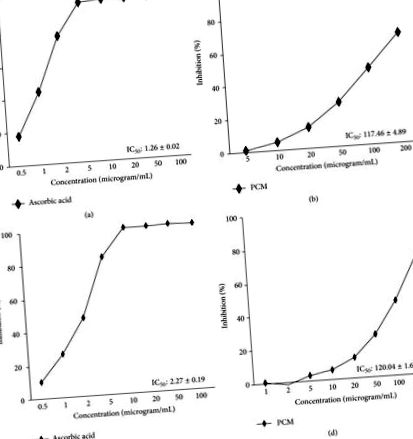
Дані виражаються як середнє значення ± SEM. Статистичні порівняння оцінювали за допомогою одностороннього аналізу ANOVA з подальшим тестом багаторазового порівняння Даннета (SPSS 18.0 для Windows, SPSS Inc., США), а значення p 1 (a) та 1 (b), IC50 активності PCM у збиванні радикалів виявлено 117,46 ± 4,89 мкг/мл, а значення IC50 аскорбінової кислоти (позитивний контроль) як позитивний контроль становило 1,26 ± 0,02 мкг/мл. Було визначено, що розраховане значення IC50 PCM щодо радикала ABTS становило 120,04 ± 1,67 мкг/мл, а значення IC50 аскорбінової кислоти як позитивного контролю становило 2,27 ± 0,19 мкг/мл (рис. 1 (c) та 1 (d)).
Активність прибирання радикалів DPPH (a, b) та активність прибирання радикалів ABTS (c, d). (а, в) аскорбінова кислота та (б, г) РСМ, екстракт плодів діоспірос какі та екстракт шкірки цитрусового уншіу. Кожен експеримент проводився у трьох примірниках. В якості стандартної проби використовували аскорбінову кислоту.
Більше того, фенольна сполука або флавоноїд виконує функцію іншого антиоксидантного агента шляхом хелатування окисно-відновних-активних іонів металів, інактивації ліпідних ланцюгів вільних радикалів та уникнення перетворення гідропероксиду в реакційноздатні оксирадикали [30, 31]. Загальний вміст фенолу вимірювали як еквіваленти галової кислоти (GAE) з посиланням на стандартну криву (y = 0,023x + 0,30 і R 2 = 0,997) і виявили, що становить 29,90 ± 0,14 мг GAE/г екстракту PCM. Вміст флавоноїдів становив 18,33 ± 0,08 мг еквіваленту нарінгіну (NE)/г екстракту PCM, відповідно до стандартної кривої (y = 0,0195x + 0,04 і R 2 = 0,9999). Загальний вміст фенолу виражали як еквіваленти галової кислоти, а вміст флавоноїдів - як еквіваленти рутину або нарінгіну, варіюючи залежно від стану екстракту або стадії розвитку. Однак молода хурма, використана в цьому експерименті, перевищує стару хурму, яку використовував інший дослідник, у двох змістах на основі нашого сучасного дослідження [32, 33].
Інгібування панкреатичної ліпази за допомогою PCM. Орлістат використовували як позитивний контроль. PCM, екстракт плодів діоспірос какі та екстракт шкірки цитрусового уншіу.
- Дослідження впливу харчових волокон пшеничних висівок на реологічні властивості тіста -
- Дослідження, щоб дізнатись про вплив елевіту (харчової добавки, що містить кілька вітамінів та мінералів
- Дослідження для оцінки впливу на параметри системного запалення та захворювань та безпеку
- Захисна дія тривалого пригнічення ангіотензину II Американський журнал фізіології-Серце і
- Ліпаза підшлункової залози та пов'язаний з нею білок 2 регулюються дієтичними поліненасиченими жирами під час