Вправа послаблює транскрипційну активацію метаболічних генів скелетних м’язів, спричинену голодуванням
Лабораторія Джона Б. Пірса,
Лабораторія Джона Б. Пірса,
Кафедра клітинної та молекулярної фізіології, Медичний факультет Єльського університету, Нью-Хейвен, Коннектикут 06519
Анотація
Голодування викликає поступове посилення ліпідного обміну в скелетних м’язах. Для визначення ефекту голодування на транскрипційну регуляцію генів, важливих для метаболічного контролю в скелетних м'язах, що складаються з різних типів клітковини, ядра контрольних та натщесерцевих (24 та 72 год) щурів піддавали аналізу ядерного запуску за допомогою RT-PCR -заснована техніка. Пост збільшився (P скелетні м'язи, завдяки своїй масі та загальній енергетичній потребі, є основною тканиною, яка відповідає за очищення дієтичної глюкози та ліпідів від кровообігу і, таким чином, відіграє ключову роль у підтримці загального метаболічного гомеостазу (33, 42). Зростаюче визнання того, що тонкі зміни в енергетичному балансі, якщо розглядати їх протягом тривалого періоду часу, представляють значний фактор ризику розвитку таких метаболічних відхилень, як резистентність до інсуліну, гіпертригліцеридемія, ожиріння та інсулінонезалежний цукровий діабет, посилили пошук для специфічних клітинних сигнальних та регуляторних білків, які можуть впливати на метаболічний контроль у скелетних м’язах (32).
Більшість успіхів у нашому розумінні того, як гострі виклики посередницькому метаболізму можуть бути сприйняті та реагувати на них на молекулярному рівні, виникли внаслідок роботи в печінці, нирках та жировій тканині. Наприклад, перехід із режиму годування в стан натщесерце різко активує транскрипцію ряду генів, що кодують ферменти, з обмежувальною швидкістю в печінковому глюконеогенезі, окисленні жирних кислот та кетогенезі. За допомогою молекулярних досліджень на трансгенних мишах та різних системах клітинних культур детальна характеристика регуляторних елементів у промоторних областях цих генів призвела до ідентифікації ключових сигнальних білків та факторів транскрипції, які реагують на різні харчові та/або гормональні маніпуляції (13, 19,30).
Матеріали.
Самців щурів Спраг-Доулі виводили власними силами або купували у лабораторії Чарльз Рівер (Вілмінгтон, Массачусетс). Усі щури розміщувались індивідуально в кімнаті з температурою (22 ° C) і світлом (темно з 9:00 до 21:00), і їм надавали вільний доступ до їжі (дієта для гризунів Purina) і води. Радіомарковані сполуки були придбані у Amersham Pharmacia Biotech. Всі інші хімічні речовини були молекулярно-біологічного класу і були придбані у Boehringer Mannheim, GIBCO-BRL, Promega або Sigma Chemical.
Експериментальний дизайн.
На момент кожного експерименту щури важили 340–360 г. На початку темного циклу (9:00 ранку) у експериментальних щурів видаляли їжу і затримували її на 24 або 72 год, зберігаючи вільний доступ до води. Контрольні щури продовжували мати вільний доступ до їжі та води. У другому наборі експериментів метаболічний попит збільшувався під час голодування (24 год), коли щури виконували два 2-годинні вправи бігової доріжки (18 м/хв, нахил 5 °), починаючи через 1 та 6 год після видалення їжі (тобто, 10:00 та 15:00). Щурів вбивали на позначці 24 години (~ 16 год після останнього вправи) і порівнювали з додатковими контрольними щурами, що голодували 24 години. По завершенні експериментів щурів знеболювали (35 мг/кг внутрішньовенно пентобарбіталу натрію) і поміщали на грілку для підтримки температури тіла під час операції.
Ізоляція ядер.
Визначення швидкості транскрипції методом RT-PCR.
RT зароджуваної РНК проводили за допомогою Superscript II RNase H - системи (GIBCO-BRL) відповідно до інструкцій виробника. Коротко, 18 мкл РНК змішували з 1,5 мкл оліго (dT) 12–18 (500 нг/мкл), нагрівали до 70 ° С протягом 10 хв і швидко охолоджували на льоду протягом 5 хв. Після спінінгу конденсації 6 мкл 5-кратного реакційного буфера (250 мМ Трис, рН 8,3, 375 мМ KCl і 15 мМ NaCl), 3 мкл 0,1 М DTT і 1,5 мкл dNTP суміші (по 10 мМ dATP, dCTP, dGTP та dTTP) були додані до кожного зразка. Після 2-хвилинної попередньої інкубації при 42 ° C додавали 1,0 мкл Суперскрипту II і зразки інкубували при 42 ° C протягом 50 хв. Фермент інактивували інкубацією при 70 ° С протягом 15 хв. Щоб врахувати відмінності у вмісті ядер серед зразків перед запущеною реакцією, продукти RT розбавляли безнуклеазним H2O на основі відносного вмісту геномної ДНК у кожному препараті ядер (див. Нижче). Середній об'єм був встановлений на рівні 150 мкл.
Таблиця 1. Праймери та умови реакції, що використовуються для ПЛР на ядерній РТ-РНК
UCP3, роз'єднуючий білок 3; LPL, ліпопротеїн-ліпаза; CPT I, карнітинпальмітоїлтрансфераза I; LCAD, довголанцюгова ацил-КоА дегідрогеназа; MCAD, середньоланцюгова ацил-КоА дегідрогеназа; HK II, гексокіназа II; [MgCl2], концентрація MgCl2; AT, температура відпалу.
Виділення та кількісне визначення геномної ДНК.
Щоб виправити початкові відмінності вмісту ядер серед зразків, геномну ДНК виділили з частини кожного зразка ядер того самого дня, коли відбулася реакція ядерної обкатки. 20-мкл аліквоти ядер поміщали в 380 мкл травного буфера (10 мМ Трис, рН 8,0, 100 мМ NaCl, 25 мМ ЕДТА, 0,5% SDS та 100 мкг протеїнази К) та інкубували при 50 ° С протягом ∼ 6 год. Після додавання додаткових 380 мкл безнуклеазної H2O ДНК виділяли екстракцією рівним об'ємом фенол-хлороформ-ізоаміл OH (25: 24: 1), розділяючи центрифугуванням (12000 g, 4 ° C) і випав з одержаної водної фази додаванням 1 10 об. 3 М NaOAc -, 100 мкг тРНК (для полегшення візуалізації гранул ДНК) і 2,5 об.% 100% EtOH. ДНК гранулювали (12000g, 10 хв, 4 ° C), промивали 70% EtOH і ресуспендували в 50 мкл 10 мМ трис та 1 мМ EDTA (ТЕ, рН 8,0) протягом ночі при 4 ° C. Відносне кількісне визначення геномної ДНК (початковий вміст ядер) визначали методом ПЛР-ампліфікації гена β-актину. Ці дані використовувались для коригування кінцевих розведень відповідних продуктів реакції RT із ядерних обтікаючих реакцій (до ПЛР, див. Вище) для врахування невеликих відмінностей у початковому вмісті ядер у зразках.
Визначення загальної транскрипційної активності.
Вплив голодування на загальну транскрипційну активність.
Щоб визначити потенційний вплив голодування на загальну транскрипційну активність скелетних м’язів, частина ядер з кожного зразка піддавалась ядерній реакції обкатки, в якій холодний UTP замінювали на [32 P] UTP. Загальну радіоактивність ізольованої ядерної РНК, нормалізованої до геномної ДНК, приймали за індекс загальної транскрипційної активності. Як показано на рис. 2, голодування значно зменшило загальну транскрипційну активність на 20–53% у підошовному та білому м’язах черевного м’яза. Зниження було очевидним протягом перших 24 годин і не було подальшим зниженням через 72 години. Незважаючи на те, що відповіді були дещо різними, голодування також мало тенденцію (P = 0,051) для зменшення загальної транскрипційної активності в червоному м’язі шлунково-кишкового тракту. Голодування не впливало на загальну транскрипційну активність м’яза підошви. 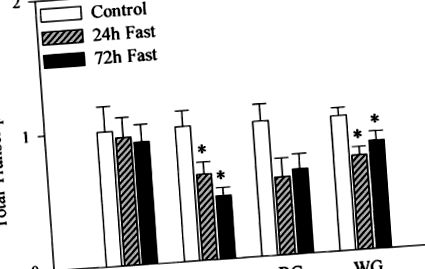
Рис.2.Загальна транскрипційна активність скелетних м’язів у контрольних щурів, що голодували 24 та 72 години. Аликвоти ядер, виділених із підошви (Sol), плантарису (PL) та червоного (RG) та білого шлунково-м’язового (WG) м’язів, піддавали ядерному обробному аналізу у присутності [32 P] UTP, як описано у матеріалах та методах . Загальне утворення транскриптів РНК визначали за допомогою рідинної сцинтиляційної спектрометрії, нормалізували до вмісту геномної ДНК для врахування змін вмісту ядер і виражали щодо контролю. Значення є середніми ± SE. * Значно (P
Середня швидкість транскрипції β-актинового гена, визначена за допомогою ядерного аналізу RT-PCR, також знизилася при голодуванні в плантарі (6,7–14,7%), червоному гастрокнемії (27–32%) та білому гастрокнемії (43– 50%, P
Рис.3.Ядерний аналіз запущених ядер, виділених із зазначених м'язів контрольних, щурів, що голодували 24 години та 72 години. Показано негативне зображення продуктів ПЛР (забарвлене бромідом етидію), отримане в результаті ядерного аналізу на основі RT-PCR, що представляє відносну швидкість транскрипції генів для роз’єднання білка-3 (UCP3), ліпопротеїнової ліпази (LPL), м’язів карнітину. пальмітоїлтрансферази I (CPT I), довголанцюгової ацил-КоА дегідрогенази (LCAD), середньоланцюгової ацил-КоА дегідрогенази (MCAD), гексокінази II (HKII) та β-актину (β-A). Показаний аналіз кожного гена для окремого набору зразків на м'яз.
Рис.4.Дані кількісної оцінки змін швидкості транскрипції, спричинених голодуванням, представлені на рис. 3. Короткий зміст зображення та статистичний аналіз (n = 9–14 щурів/група) зміни швидкості транскрипції для зазначених генів (визначених на рис. 3) у м’язах підошви, PL, RG та WG контрольних, 24-годинних та 72-годинних щури. Всі дані були нормалізовані на β-актин і були виражені щодо контролів (встановлених на 1.0) як значення ± SE. Зверніть увагу, що через великі зміни в транскрипції файл р-вісь для UCP3 більша, ніж для всіх інших генів. * Значно (P
Використовуючи голодування як метаболічну проблему, метою цього дослідження було перевірити гіпотезу про те, що підвищений попит та/або пропозиція жирних кислот у скелетних м’язах викликає адаптивну реакцію, що включає координатну транскрипційну активацію генів, що кодують білки, необхідні для транспорту та окислення жирних кислот. На підтвердження цієї гіпотези, швидкість транскрипції генів LPL, CPT I та LCAD суттєво зросла у 1,7–2,0 раза, 2,1–3,0 та 1,7–3,7 рази відповідно за 24– 72 год голодування (рис. 4). Ніяких відмінностей між щурами, що голодували від 24 до 72 годин, не виявлено. Порівняно з LCAD, зміни швидкості транскрипції гена MCAD не були настільки різкими або узгодженими зі значною активацією (у 2,0–2,3 рази), яка була очевидною лише у білих м’язах шлунково-кишкового тракту. Голодування не впливало на швидкість транскрипції генів LPL, CPT I, LCAD або MCAD у м’язі підошви. Для порівняння генів метаболізму жиру також була визначена швидкість транскрипції гена гексокінази II, яка виявилася значно збільшеною лише через 72 години голодування в підошві (у 2,0 рази), червоному гастрокнемії (в 1,8 рази), і білі шлунково-м’язові (в 1,5 рази) м’язи.
Вплив підвищеного метаболічного попиту на регуляцію транскрипції під час голодування.
Рис.5.Ядерний пробіговий аналіз ядер, виділених із зазначених контрольних м'язів, 24-годинне голодування (F) або 24-годинне голодування + вправи (FE; 2 × 2-годинні напади бігової доріжки, виконані протягом початкових 8 годин ) щури. Показано негативне зображення продуктів ПЛР (забарвлене бромідом етидію), отримане в результаті ядерного аналізу на основі РТ-ПЛР, що представляє відносну швидкість транскрипції зазначених генів (визначено на рис. 3). Показаний аналіз кожного гена для окремого набору зразків на м'яз.
Рис.6.Вплив збільшення метаболічного попиту на реакції транскрипції до 24 годин голодування. Короткий зміст зображення та статистичний аналіз (n = 6–14 щурів/група), представлених на рис. 5 змін у швидкості транскрипції для зазначених генів (визначених на рис. 3) у м’язах підошви, PL, RG та WG натощак (24 год) або натощак (24 h) + вправлені (2 × 2-годинні вправи бігової доріжки, виконувані протягом початкових 8 год) щури. Всі дані були нормалізовані на β-актин і були виражені щодо контролів (встановлено на 1.0, дані не показані) як середнє значення ± SE. Зверніть увагу, що через великі зміни в транскрипції файлр-вісь для UCP3 більша, ніж для всіх інших генів. * Значно (P
Основною метою цього дослідження було перевірити гіпотезу, що серйозна метаболічна проблема скелетних м'язів, така як голодування, викликає координаційну адаптивну реакцію в транскрипційній регуляції генів з критичною роллю в метаболізмі субстрату. Результати цього дослідження демонструють, що голодування індукує координатне збільшення швидкості транскрипції ряду метаболічно пов’язаних генів, зокрема, в швидко скельованих скелетних м’язах. Головним серед відповідей було різке збільшення частоти транскрипції гена UCP3 у м’язах плантарису, червоного шлунково-кишкового та білого шлунково-м’язового суглобів протягом 24 годин після видалення їжі. Транскрипційна активація кількох генів, необхідних для метаболізму ліпідів, також відбулася у відповідь на голодування, що передбачає загальний механізм регуляції. Дивно, проте, доданий метаболічний попит, накладений фізичними вправами, виконаними протягом перших годин після видалення їжі, фактично послабив транскрипційну активацію, виявлену лише за 24 години голодування, що свідчить про наявність протилежних регуляторних механізмів.
Підошвовий м’яз щурів складається переважно з повільних волокон, які сильно покладаються на окислювальний метаболізм. Показано, що мРНК LPL збільшується на ~ 50% у м’язі підошви після 1 дня голодування (21). Навпаки, швидкість транскрипції LPL в цьому дослідженні не змінювалась у м’язі підошви, що свідчить про те, що зміни експресії LPL, спричинені голодуванням у м’язах, що складаються переважно з повільних окисних волокон, можуть залучати механізми посттранскрипційного контролю.
Підводячи підсумок, результати цього дослідження демонструють, що голодування викликає помітне збільшення транскрипції гена UCP3 та координатне збільшення транскрипції декількох генів, необхідних для метаболізму ліпідів у швидко стискаються червоних та білих скелетних м'язах, що, ймовірно, відображає посилену залежність м'язів на метаболізм жирних кислот під час голодування. Дивно, проте, збільшення метаболічних потреб у скелетних м’язах протягом перших 8 годин 24-годинного голодування значно послаблює транскрипційну активацію кількох метаболічних генів, пов’язаних з метаболізмом ліпідів у червоних скелетних м’язах, підвищуючи можливість того, що голодування та фізичні вправи можуть викликати протидію механізми регулювання.
Ми дякуємо докторам. Генріт Пілеґард та Девід Кемерон-Сміт за корисні обговорення та огляд рукопису.
СНОПКИ
Ця робота була підтримана грантом Єльського дослідницького ендокринологічного центру діабету та Національним інститутом артриту та опорно-рухового апарату та грантом AR-45372.
Витрати на публікацію цієї статті були частково сплачені за рахунок оплати сторінок. Тому стаття має бути позначена цим «реклама”Відповідно до 18 U.S.C. §1734 виключно для зазначення цього факту.
ЛІТЕРАТУРА
ПРИМІТКИ АВТОРА
Адреса для запитів на передрук та іншої кореспонденції: П. Д. Нойфер, Лабораторія Джона Б. Пірса, Єльський університет. Школа медицини, 290 Конгрес-пр., Нью-Гейвен, CT 06519 (електронна пошта: [електронна пошта захищена] org).
- Фізичні вправи зі зниженням ваги та дієта з високим або низьким глікемічним індексом знижують метаболізм
- Дієтичні та фізичні вправи регулюють SIRT3 та активують AMPK та PGC-1α у скелетних м’язах
- Фітнес та ваше здоров'я Фізичні, психічні та відновлювальні переваги Інституту фізичних вправ для
- Веб-магазин метаболізму вітамінів та мінералів Enhancer
- Невідповідність між власним звітом та фактичним споживанням калорій та фізичними вправами у людей, що страждають ожирінням - PubMed