Вплив періодичного голодування на інфаркт міокарда, викликаний ремоделюванням серця
Анотація
Передумови
Інформації про роль періодичного голодування (ПП) у патологічному переробці серця недостатньо. Ми порівняли ефекти ІФ до та після інфаркту міокарда (ІМ) на реконструкцію серця та виживання серця щурів.
Методи
Щурів Wistar з перервами голодували (їжа була доступна через день) або годували довільно протягом 12 тижнів, а потім поділяли на три групи: AL - годували довільно; AL/IF - годується AL до ІМ та IF після ІМ; і ІФ - годується ІФ до і після ІМ. Ехокардіограму проводили до ІМ та через 2 та 12 тижнів після операції. Ізольовані серця оцінювали в препаратах Лангендорфа.
Результати
До операції вага тіла (БТ) була нижчою за ІФ, ніж АЛ. Остаточний показник BW був нижчим за AL/IF та IF, ніж AL. Періопераційна смертність не змінювалася між AL (31,3%) та IF (27,3%). Загальна смертність була нижчою за ІФ, ніж за АЛ. До операції показники ехокардіографії не відрізнялись між групами. Через два тижні після операції розмір ІМ не відрізнявся між групами. Через дванадцять тижнів після ІМ товщина діастолічної задньої стінки лівого шлуночка (ЛШ) була нижчою за AL/IF та IF, ніж за AL. Відсоток варіації ехокардіографічних параметрів між дванадцятьма та двома тижнями показав, що розмір ІМ зменшився у всіх групах, і зменшення було вищим у ІФ, ніж у АЛ/ІФ. У препаратах Лангендорфа об'єм ЛШ при нульовому кінцевому діастолічному тиску (V0; AL: 0,41 ± 0,05; AL/IF: 0,34 ± 0,06; IF: 0,28 ± 0,05 мл) і при 25 мм рт.ст. кінцевому діастолічному тиску (V25; AL: 0,61 ± 0,05; AL/IF: 0,54 ± 0,07; IF: 0,44 ± 0,06 мл) був нижчим у AL/IF та IF, ніж AL та V25 був нижчим у IF, ніж AL/IF. Співвідношення V0/BW було нижчим у IF, ніж AL, а співвідношення вага/V0 LV було більшим у IF, ніж AL. Діаметр міоцитів був меншим у AL/IF та IF, ніж AL (AL: 17,3 ± 1,70; AL/IF: 15,1 ± 2,21; IF: 13,4 ± 1,49 мкм). Концентрація гідроксипроліну міокарда та експресія генів ANP, Serca 2a та α- та β-міозину важкого ланцюга не відрізнялися між групами.
Висновок
Періодичне голодування, розпочате до або після ІМ, зменшує гіпертрофію міоцитів та розширення ЛШ. Фіброз міокарда та експресія гена плода не модулюються режимами годування. Користь стає більш очевидною, коли періодичне голодування починається до, а не після ІМ.
Передумови
Поширеність надмірної ваги та ожиріння зросла протягом останніх десятиліть у багатьох частинах світу [1], і ожиріння асоціюється з кількома супутніми захворюваннями та збільшенням смертності [2]. Багато дієтичні режими використовуються для зменшення маси тіла та збереження здорової маси тіла. Щоденне обмеження калорій є, мабуть, найпоширенішою формою обмеження дієти [3]. Зовсім недавно періодичне голодування стало підходом до обмеження енергії у людей [4]. Хоча дані спостережень щодо взаємозв'язку між тривалим періодичним голодуванням та ризиком кардіометаболічних захворювань є обмеженими, є дані, що як чергування, так і періодичне голодування може бути ефективним для зниження ваги [3, 5]. Повідомлялося про сприятливий вплив на серцево-судинні фактори ризику, включаючи зменшення жиру в організмі та загального рівня холестерину та тригліцеридів [3,4,5].
Періодичне голодування оцінювали у експериментальних тварин за різними сценаріями. Зазвичай мишей і щурів позбавляють їжі через день і годують за бажанням у наступні дні [6]. Навіть за відсутності вираженої втрати ваги тіла, періодичне голодування було пов’язане з продовженням тривалості життя, поліпшенням регуляції глюкози [7, 8], нейрозахистом для втрати пам’яті [9,10,11], нефропротекцією [6] та підвищеною стійкістю клітин до різний тип стресу [12].
Інформації про роль періодичного голодування у патологічному переробці серця недостатньо. Щури, яким піддавались періодичному голодуванню як до, так і після інфаркту міокарда, продемонстрували ослаблення як при реконструкції серця, так і при дисфункції лівого шлуночка [13, 14]. Однак чи подібні сприятливі наслідки періодичного голодування, розпочатого до та після інфаркту міокарда, досі незрозуміло. У цьому дослідженні ми порівняли ефекти періодичного голодування до та після інфаркту міокарда на реконструкцію та виживання серця щурів.
Методи
Експериментальні групи
Двомісячні самці щурів Вістар були придбані в Центральному будинку тварин, медичній школі Ботукату, ЮНЕСП. Тварин розміщували в кімнаті з контрольованою температурою та циклом світло/темрява. Експериментальний дизайн був схвалений Комітетом з етики експериментів на тваринах Медичної школи Ботукату, ЮНЕСП, Іспанія, Бразилія.
Щурів розподіляли випадковим чином, щоб їх годували або щодня (за бажанням, AL) або через день (періодичне голодування, IF) зі стандартною дієтою щурів. Після 12 тижнів цих режимів годівлі всіх щурів піддавали перев’язуванню коронарних артерій і створювали наступні три групи: годували ad libitum (AL); годували дозвільно перед ІМ та з перериванням голодували після ІМ (AL/IF); і періодично голодували до і після ІМ (ІФ). Структури серця та функцію лівого шлуночка (ЛШ) оцінювали за допомогою трансторакальних ехокардіограм перед індукцією ІМ та через 2 та 12 тижнів після операції. В кінці експерименту після анестезії серця виймали і монтували в апарат Лангендорфа (AL, n = 8; AL/IF, n = 9; ЯКЩО, n = 13). Всім тваринам, що залишились, знеболювали пентобарбітал (50 мг/кг, внутрішньочеревно) та евтаназували шляхом торакотомії та видалення серця. Правий та лівий шлуночки розтинали, зважували, заморожували у рідкому азоті та витримували при - 80 ° C для молекулярних аналізів. Оскільки перфузія in vitro може змінити тканину міокарда, серця, що використовуються в препаратах Лангендорфа, не піддавалися додатковій оцінці.
Інфаркт міокарда
Після анестезії ксилазином (10 мг/кг) та кетаміном (70 мг/кг) індукували ІМ, як описано в нашій лабораторії [15, 16].
Ехокардіографічне дослідження
Щурів злегка знеболювали за допомогою внутрішньочеревної ін’єкції кетаміну (50 мг/кг) та ксилазину (1 мг/кг). Ехокардіограму проводив той самий сліпий дослідник (КО), використовуючи ехокардіограф (General Electric Medical Systems, Vivid S6, Tirat Carmel, Ізраїль), обладнаний багаточастотним зондом 5,0–11,5 МГц, згідно з описаним раніше методом [17,18,19, 20]. Розмір ІМ оцінювали за допомогою двовимірного зображення, що вимірює кінцевий діастолічний периметр ендокарда ураженого міокарда відносно загального периметра ендокарда ЛШ.
Ізольоване дослідження ЛШ - підготовка Лангендорфа
Через добу після ехокардіографічної оцінки щурів знеболювали тіопенталом натрію (50 мг/кг, внутрішньочеревно) та гепарином (2000 МО, внутрішньочеревно) та евтаназували за допомогою торакотомії. Після вилучення сердець їх встановили в апарат Лангендорфа згідно з методикою, описаною раніше [21,22,23]. Після запису функціональних даних серця відшарували, передсердя та великі судини видалили, а шлуночки розділили та зважили [23].
Морфологічний аналіз
Забарвлені гематоксиліном та еозином предметні стекла з тканини ЛШ використовувались для вимірювання приблизно 50 діаметрів кардіоміоцитів як нижньої відстані між межами міоцитів, проведеними по ядру [24,25,26].
Гідроксипролін міокарда
Кількісно визначали концентрацію гідроксипроліну в лівому шлуночку для оцінки вмісту колагену в міокарді згідно з раніше описаним методом [27,28,29]. Коротше кажучи, зразки міокарда сушили та гідролізували протягом ночі при 100 ° C 6 N HCl (1 мл/10 мг сухої тканини). Аликвоти по 50 мкл знову сушили в концентраторі Speedvac. Після додавання 1,0 мл деіонізованої води та 1,0 мл буферного буфера калію (рН 8,7) зразки окислювали 0,3 мл розчину хлораміну Т протягом 20 хв. Додавання 1 мл 3,6 М тіосульфату натрію зупинило процес окислення. Потім розчин насичували 1,5 г KCl. Пробірки нагрівали в окропі протягом 20 хв. Після екстракції водного шару 2,5 мл толуолу 1,5 мл екстракту толуолу додавали до 0,6 мл реагенту Ерліха і давали забарвлення розвиватися протягом 30 хв. Поглинання зчитували при 565 нм щодо заготовки реагенту. В якості заготовки та контролю використовували деіонізовану воду та стандарт гідроксипроліну (20 мкг/мл).
Експресія гена
Для оцінки програми фетального гена ми проаналізували саркоплазматичну сітку кальцію АТФазу (Serca 2a), важку ланцюг α- та β-міозину міокарда та експресію передсердної натрійуретичної пептиду (ANP) за допомогою RT-PCR у реальному часі, як описано раніше [30,31, 32,33]. Коротко кажучи, загальну РНК екстрагували, солюбілізували у Н2О без РНКази, інкубували в ДНКазі I (Invitrogen Life Technologies), кількісно визначали та зворотно транскрибували. Аликвоти кДНК подавали на ПЛР у режимі реального часу з використанням 10 мкл 2X TaqMan® Universal PCR Master Mix (Applied Biosystems) та 1 μL індивідуального аналізу (20X), що містить сенси та антисмислові праймери та Taqman (Applied Biosystems, Foster City, CA, EUA ) зонд, специфічний для наступних генів: Serca2a (аналіз Taqman Rn00568762; посилання на наступний Genbank NM_017290), α-міозин (важкий поліпептид міозину 6, серцевий м'яз, альфа; аналіз Taqman Rn00568304_m1; посилання наступний Genbank NM_017239) β-міозин (важкий поліпептид міозину 7, серцевий м’яз, бета; аналіз Такмана Rn00568328_m1; посилання на наступне Genbank NM_017240.1) та натрійуретичний попередник пептиду типу А (аналіз Такмана Rn00561661_m1; посилання сек. 6 Genbank NM_0. Потім проводили ампліфікацію та аналіз; реакції проводились у трьох примірниках. Після нормалізації експресії даних до циклофіліну (аналіз Такмана Rn00690933_m1; Посилання наступне Genbank NM_017101), результати обчислювали методом КТ (2 -ΔΔCT).
Статистичний аналіз
Дані виражаються як середнє значення ± стандартне відхилення або медіана та 25-й та 75-й процентилі відповідно до нормального чи ненормального розподілу. Порівняння між групами проводили шляхом дисперсійного аналізу (ANOVA), доповненого тестом Тукі або тестами Крускала-Уолліса та Данна для нормального та ненормального розподілу відповідно. Смертність оцінювали за допомогою лог-рангового тесту (Каплан Мейєр). Статистичне значення було прийнято на рівні стор
Результати
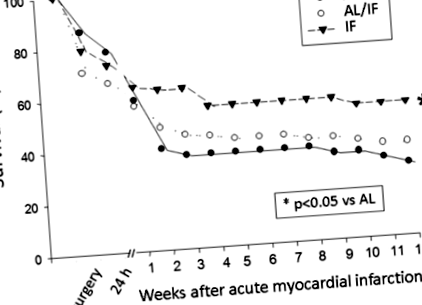
Початкова вага тіла (ЧМ) не відрізнялася між групами (табл. 1). До хірургічного втручання показник ЧЖ був нижчим у IF, ніж у групах AL та AL/IF. Наприкінці експерименту AL/IF та IF мали нижчий показник BW, ніж AL. Рівень смертності після операцій, включаючи перші 24 год після операції, не змінювався між групами AL (31,3%) та IF (27,3%). Наприкінці експерименту рівень смертності був нижчим за IF, ніж AL (рис. 1).
Криві Каплана-Мейєра для виживання щурів після індукції інфаркту міокарда. AL: живлення ad libitum; AL/IF: ad libitum до інфаркту міокарда (ІМ) та з перервами натощак після ІМ; ЯКЩО: періодично голодували до і після ІМ
До операції ехокардіографічні параметри будови та функції серця не відрізнялись між AL та IF (дані не наведені). Ехокардіографічні дані через два тижні після індукції ІМ наведені в таблиці 2. Час ізоволюмічної релаксації в абсолютних та нормалізованих до частоти серцевих скорочень показниках був вищим у групах ІФ, ніж АЛ та АЛ/ІФ. Дані ехокардіографії через 12 тижнів після ІМ наведені в таблиці 3. Товщина діастолічної задньої стінки ЛШ була нижчою у AL/IF та IF, ніж у AL. Час уповільнення електронної хвилі був нижчим у AL/IF, ніж AL і IF. Розмір інфаркту міокарда не відрізнявся між групами. Відсоток варіації (Δ) ехокардіографічних параметрів між дванадцятьма та двома тижнями після інфаркту розраховували як [(кінцеве значення мінус початкове значення)/початкове значення] X 100 (Таблиця 4). Δ BW збільшено у всіх групах; приріст був вищим у IF, ніж AL/IF. Δ ІМ розмір зменшився у всіх групах; зменшення розміру ІМ було вищим при ІФ, ніж АЛ/ІФ.
Дані ізольованих функціональних досліджень серця представлені в таблиці 5 та на рис. 2. V0 та V25 були нижчими у AL/IF та IF, ніж AL та V25 були нижчими у IF, ніж AL/IF; при нормуванні до BW V0 був нижчим за IF, ніж AL (рис. 2). Вага LV, нормований до V0, був більшим за IF, ніж AL (Таблиця 4).
Діаметр міоцитів був меншим у AL/IF та IF, ніж AL (AL 17,3 ± 1,70; AL/IF 15,1 ± 2,21; IF 13,4 ± 1,49 мкм; стор Таблиця 6 Експресія генів
Обговорення
Новим дизайном цього дослідження є порівняння періодичного голодування, розпочатого до та після інфаркту міокарда при реконструкції серця щурів.
Вже давно показано, що обмеження калорій збільшує тривалість життя у гризунів [34]. Помірне обмеження калорій асоціювалось із затримкою серцевого старіння, покращеною реконструкцією серця, спричиненою перевантаженням, та кращою ішемічною толерантністю міокарда [35,36,37,38,39]. З іншого боку, сильне обмеження калорій погіршує структурно-функціональні параметри у спонтанно гіпертонічних щурів [40]. Лише нещодавно параметри серцево-судинної системи були проаналізовані у гризунів при періодичному голодуванні. Періодичне голодування у нормальних щурів дало суперечливі результати. Кастелло та ін. [41] спостерігав захист від вікових запалень, фіброзу та окисного стресу в серцях щурів. На відміну від цього, посилений фіброз з діастолічною дисфункцією та зменшений серцевий резерв спостерігалися через шість місяців голодування чергуванням днів [42].
Маса тіла у щурів з періодичним голодом, як правило, нижча, ніж у аналогів, що харчуються за винятком [13, 14]. У цьому дослідженні групи AL/IF та IF мали вагу тіла приблизно на 18% нижче, ніж AL. Однак маса тіла не відрізнялася між щурами, які піддавались періодичному голодуванню протягом 12 і 24 тижнів, що свідчить про те, що втрата маси тіла після періодичного голодування обмежена.
Раніше ми характеризували індукований інфарктом міокарда реконструкцію серця у щурів з великими розмірами інфаркту, що зазвичай характеризується як зона інфаркту, що перевищує 40% загальної площі ЛШ [15, 43, 44]. Через шість місяців після індукції ІМ щури з великим ІМ мають дилатацію ЛШ та лівого передсердя, збільшення діастолічної товщини задньої стінки ЛШ та систолічну та діастолічну дисфункцію [15, 31, 43]. Режим годування в цьому дослідженні не змінив розмір ІМ, оскільки всі групи мали великі розміри інфаркту. Ця знахідка відрізняється від даних Ахмета та ін. [13], який виявив менший розмір інфаркту у щурів з переривчастим голодом через 24 год після індукції ІМ. Наша перша оцінка розміру ІМ була проведена через два тижні після ІМ. На цей час смертність була нижчою у IF, ніж у групах AL та AL/IF. Отже, можливо, щури з більшим розміром ІМ у групах AL та AL/IF вже загинули до нашого першого оцінювання. Смертність протягом 12 тижнів після інфаркту була нижчою при ІФ, ніж при АЛ; група AL/IF мала середню смертність і не відрізнялася як від груп AL, так і від IF.
Через два тижні після індукції ІМ ехокардіографічні параметри не відрізнялись між групами, за винятком більш високого часу ізоволумічної релаксації в групі ІФ. Через дванадцять тижнів після ІМ товщина діастолічної задньої стінки ЛШ була нижчою за AL/IF та IF, ніж за AL, показуючи, що періодичне голодування послаблює гіпертрофію міокарда. Ця знахідка була підтверджена меншим діаметром міоцитів як в групах AL/IF, так і в IF. При порівнянні змін ехокардіографічних показників між дванадцятьма та двома тижнями після інфаркту ІФ мав краще перероблення, ніж АЛ та АЛ/ІФ. Це характеризувалось зменшенням E Е-хвилі та Δ МІ розміру та збільшенням Δ Е-хвилі уповільнення (EDT). Оскільки співвідношення E/A зростає, а EDT зменшується при великих інфарктах [43], зміни цих параметрів між обома оцінками свідчать про сприятливий вплив періодичного голодування на діастолічну функцію.
Результати препаратів Лангендорфа підтвердили кращий ефект періодичного голодування, починаючи його перед ІМ. V0 і V25 були нижчими в обох групах з переривчастим голодуванням, а V25 були нижчими в IF, ніж AL/IF. Ці параметри вказують на об’єм ЛШ при нульовому та 25 мм рт.ст. кінцевому діастолічному тиску відповідно. Крім того, співвідношення ваги ЛШ/V0 було вищим, а співвідношення V0/ваги тіла нижчим у IF, ніж AL, що свідчить про переважання концентричного над ексцентричним ремоделюванням у групі IF. Ці дані показують, що, незважаючи на однаковий розмір ІМ і, отже, однаковий ступінь пошкодження міокарда, спричиненого ішемією, періодичне голодування зменшує розмір порожнини ЛШ, послаблюючи таким чином серцеве ремоделювання, і це послаблення було більш інтенсивним при IF, ніж AL/IF.
Як потенційні механізми, що впливають на ослаблення серцевого ремоделювання, ми оцінювали експресію міокарда фетальних генів та серцевий фіброз. Цікаво, що покращення серцевого ремоделювання не було пов’язане зі змінами в експресії фетальних генів α- та β-міозину важкої ланцюга, передсердного натрійуретичного пептиду або Serca 2a. Вважається, що реактивація програми фетального гена бере участь у несприятливому переробці серця та патогенезі серцевої недостатності [45]. Таким чином, наші результати показують, що зміни програм фетального гена не модулюються періодичним голодуванням. Так само на концентрацію гідроксипроліну міокарда, маркер інтерстиціального фіброзу, дієти не впливали. Вплив періодичного голодування на фіброз міокарда суперечливий, оскільки у здорових щурів спостерігався як підвищений [42], так і зменшений [40] фіброз.
Ослаблення серцевого ремоделювання раніше спостерігали у щурів, які піддавались періодичному голодуванню до індукції ІМ [13], або через два тижні після ІМ [14]. Як зазначили Ахмет та ін. [13] повідомлялося, періодичне голодування зменшило розмір ІМ, що послаблює всі аспекти серцевого ремоделювання. Однак навіть у щурів з подібними розмірами ІМ періодичне голодування зменшує апоптоз міоцитів та інфільтрацію нейтрофілів у зоні ризику ішемії порівняно із режимом ad libitum [13].
Періодичне голодування розпочато через два тижні після ІМ, прискорило проангіогенні та каскадні виживання клітин [14]. Наскільки нам відомо, це перше дослідження, яке показало, що наслідки періодичного голодування, розпочатого до ІМ, є більш очевидним, ніж коли його починають після ІМ. Хоча обидва режими знижували смертність, лише коли їх починали до ІМ, періодичне голодування досягло статистичної значущості. Обидва режими голодування зменшували гіпертрофію міоцитів та розширення ЛШ. Однак у групи IF також були дані про зменшення розміру ІМ, концентричне ремоделювання, що переважало над ексцентричним, та кращий розвиток діастолічної функції, ніж щури AL/IF. Потрібні додаткові дослідження для з'ясування механізмів послаблення індукційного інфаркту міокарда ремоделювання серця.
Висновок
Періодичне голодування, розпочате до або після інфаркту міокарда, зменшує гіпертрофію міоцитів та розширення лівого шлуночка у щурів. Фіброз міокарда та експресія гена плода не регулюються схемами годування. Користь стає очевиднішою, коли періодичне голодування починається до, ніж після інфаркту міокарда.
- Олія MCT та періодичне голодування Вичерпне керівництво
- Я схудла при СПКЯ з переривчастим голодування, рослинна дієта
- Стратегії прийому їжі можуть допомогти вам схуднути Постійні дієти під час посту - NDTV Food
- Плани здорової дієти, які найкраще підходять для періодичного голодування
- Дієта Дженніфер Еністон Ось як колишній Бред Пітт слідує періодичному голодуванню - Мікі Новини