Вплив олії гранатових кісточок на метаболічний стан хворих на цукровий діабет 2 типу
Захра Фагіхімані
1 Відділ клінічного харчування та дієтології, Національний науково-дослідний інститут харчування та харчових технологій, Університет медичних наук Шахіда Бехешті, Тегеран, Іран
2 Ісфаханський дослідницький центр ендокринної системи та обміну речовин, Університет медичних наук Ісфахана, Ісфахан, Іран
Парвін Мірміран
1 Відділ клінічного харчування та дієтології, Національний науково-дослідний інститут харчування та харчових технологій, Університет медичних наук Шахіда Бехешті, Тегеран, Іран
Гольбон Сохраб
1 Відділ клінічного харчування та дієтології, Національний науково-дослідний інститут харчування та харчових технологій, Університет медичних наук Шахіда Бехешті, Тегеран, Іран
Біджан Ірадж
2 Ісфаханський дослідницький центр ендокринної системи та обміну речовин, Університет медичних наук Ісфахана, Ісфахан, Іран
Елхам Фагіхімані
2 Ісфаханський дослідницький центр ендокринної системи та обміну речовин, Університет медичних наук Ісфахана, Ісфахан, Іран
Анотація
Передумови:
Швидке збільшення поширеності цукрового діабету є серйозною проблемою для здоров'я у світі. Нові дані визначили, що патогенезом цукрового діабету є хронічне запалення низького ступеня, що спричиняє резистентність до інсуліну. Олія насіння граната (PSO) має протизапальну дію; хоча це може зменшити резистентність до інсуліну та покращити глікемію при цукровому діабеті. Це дослідження було розроблене для дослідження впливу PSO як природного харчового компонента на метаболічний стан пацієнтів із цукровим діабетом 2 типу.
Методи:
У рандомізованому подвійному сліпому клінічному дослідженні 80 пацієнтів (28 чоловіків) з діабетом 2 типу були випадковим чином розподілені до груп втручання та контролю. Група втручання споживала капсули PSO, що містять 1000 мг PSO двічі на день (2000 мг PSO), тоді як контроль проводився плацебо протягом 8 тижнів. Учасники дотримувались своїх попередніх режимів харчування та вживання ліків. Дієтичні фактори та метаболічні фактори, включаючи ліпідний профіль, цукор у плазмі натще та інсулін, аналізувались на початковому рівні та через 8 тижнів.
Результати:
Учасники двох груп втручання та контролю були подібними щодо антропометричних та дієтичних факторів на початковому рівні та після випробування (Р> 0,05). Середній рівень загального холестерину, тригліцеридів, ліпопротеїдів холестерину низької щільності та ліпопротеїдів високої щільності суттєво не відрізнявся між групами після випробування (Р> 0,05). Споживання PSO суттєво не впливало на рівні таких параметрів, як рівень цукру в крові натще (FBS), інсулін, HbA1c, аланінтрансфераза та оцінка моделі гомеостазу - резистентність до інсуліну.
Висновки:
Споживання 2000 мг PSO на день протягом 8 тижнів не впливало на ФБС, інсулінорезистентність та ліпідний профіль у хворих на цукровий діабет.
ВСТУП
Зараз цукровий діабет досяг рівня епідемії як у країнах, що розвиваються, так і в розвинених. За оцінками, поширеність цукрового діабету становить приблизно 387 мільйонів людей у всьому світі. [1,2] В результаті пандемії можуть виникнути макро- та мікросудинні ускладнення, спричинені цукровим діабетом, що може бути основною загрозою для загальне здоров'я населення у всьому світі з величезними економічними та соціальними витратами. [3,4] Останні дані свідчать про можливу роль слабко запального запалення у патогенезі цукрового діабету. Інсулінорезистентність та цукровий діабет зазвичай характеризуються збільшенням окисного стресу та прозапальних цитокінів. [5,6,7] Як результат, більшість методів лікування в основному були зосереджені на потенційних антиоксидантних або протизапальних ефектах. [8,9,10 ] У цьому контексті природні дієтичні компоненти пропонують просту, але ефективну альтернативну терапевтичну стратегію.
Серед різних природних дієтичних компонентів гранатовий сік останнім часом приділяється велика увага як функціональний протизапальний засіб. [11,12] Високий вміст поліфенолів у гранатовому соку може пояснити його протизапальну дію. Протягом багатьох років численні дослідження були присвячені екстракту граната та його потенційним протизапальним ефектам. Однак олія насіння граната (PSO) може також мати протизапальну дію, і мало досліджень вивчало його потенціал. [13,14]
PSO складається з високого вмісту кон'югованої ліноленової кислоти (9-цис, 11-транс, 13-цис) октадекатрієнової кислоти або пунікової кислоти (основний біоактивний інгредієнт). [15,16]
Висновки різних досліджень in vivo та in vitro щодо ефективності PSO суперечливі. Сучасні дослідження показують, що PSO може покращити діабет 2 типу, покращуючи резистентність до інсуліну та ожиріння у щурів з дієтою з високим вмістом жиру [17]. У дослідженні in vitro пунінова кислота покращувала профілі глюкози в плазмі натощак (FPG) та ліпідних профілів. [18] Наша мета у цьому дослідженні - представити ретельне дослідження PSO та його потенціалів як можливого природного дієтичного компонента для поліпшення резистентності до інсуліну, глюкози в плазмі, дисліпідемії та артеріального тиску у хворих на цукровий діабет.
МЕТОДИ
Це дослідження було рандомізованим, подвійним сліпим, плацебо-контрольованим клінічним випробуванням. Вісімдесят пацієнтів (28 чоловіків та 52 жінки), віком 52 ± 6,8 років, з діабетом 2 типу були включені за зручністю вибірки з медичної документації пацієнтів у Ісфаханський центр ендокринного та метаболізму; всі пацієнти отримували пероральні гіпоглікемічні засоби. Критерії включення були такими: Бажання вступити до дослідження; Цукровий діабет 2 типу (протягом 5–10 років); вік від 35 до 65 років; індекс маси тіла між 20 і 30. Критеріями виключення були такі: куріння, вагітність, будь-яке інше хронічне захворювання, прийом естрогену, прогестерону та кортикостероїдів або антиоксидантних добавок або інсуліну як ліки від діабету, будь-які дієти для схуднення за останній місяць; пацієнти з важкою гіперглікемією (FPG> 250); ниркова недостатність; хвороба серця; і печінкова недостатність.
Враховуючи запропоновану формулу, враховуючи похибку типу 1 5%, потужність дослідження 80% та виходячи з попередніх публікацій, нам потрібно було 33 людини в кожній групі. Оскільки у нас можуть бути деякі зниклі, ми додали кількість кожної групи до 40 осіб. На початковому рівні учасники були стратифіковані за статтю та розподілені випадковим чином у дві групи: групи втручання (PSO, n = 40) та групи контролю (плацебо, n = 40), використовуючи контейнери з порядковим номером. Асистент виконав рандомізацію. І слідчий, і учасники були засліплені щодо рандомізації.
Письмова інформована згода була отримана від кожного з обраних пацієнтів. Етичний комітет Національного науково-дослідного інституту харчування та харчових технологій (Тегеран, Іран) схвалив протокол цього дослідження. Клінічне випробування було зареєстровано в Іранському реєстрі клінічних випробувань (IRCT201409031640N15).
Всі демографічні дані та історія хвороби на початковому етапі були задокументовані.
Група втручання споживала капсули PSO, що містять 1000 мг PSO двічі на день (2000 мг PSO), тоді як контролі приймали капсули плацебо протягом 8 тижнів.
Випробовуваним рекомендували дотримуватися своїх попередніх режимів харчування та фізичної активності та вживання ліків.
Дієтичне споживання суб'єктів реєстрували за допомогою 3-денного згадування про дієту (2 робочі дні та 1 вихідний день) на початковому рівні та наприкінці дослідження. Дієти пацієнтів аналізували за допомогою програмного забезпечення Nutritionist IV (N-Squared Computing, Сан-Бруно, Каліфорнія, США).
Вимірювання
Зразки венозної крові (10 мл) отримували у кожного учасника на початковому етапі та наприкінці 8 тижнів втручання після 12–14 год нічного голодування. Зразки крові центрифугували при 4000 об/хв протягом 10 хв і їх зразки плазми поділяли на аликвоти. Зразки заморожували при -70 ° C для подальших оцінок.
Концентрація FPG визначається методом колориметрії за допомогою наборів Pars Azmoon (Тегеран-Іран). Рівні HbA1C вимірювали за допомогою іонообмінної хроматографії (LDN, Німеччина). Рівень інсуліну визначали методом ІФА (Dia Plus, США). Тригліцериди плазми (TG), загальний холестерин, ліпопротеїн-холестерин високої щільності (HDL-C) та ліпопротеїн-холестерин низької щільності (LDL-C) вимірювались ферментативно за допомогою автоаналізатора за допомогою наборів Pars Azmoon (Тегеран-Іран). Оцінка моделі гомеостазу - резистентність до інсуліну (HOMA-IR), розрахована як: (Глюкоза [ммоль/л] × інсулін [мкУ/мл]/22,5).
Вагу тіла учасників вимірювали на початковому рівні та наприкінці 8 тижнів втручання.
Відповідність
Щоб з'ясувати відповідність пацієнта, ми надали кожному пацієнту фіксовану кількість капсул PSO та рекомендували повернути невикористані капсули в кінці дослідження.
Відповідність лікуванню визначали на основі кількості повернутих капсул кожним пацієнтом. Показник становив 90% для досліджуваного населення.
Олія насіння граната та капсули плацебо
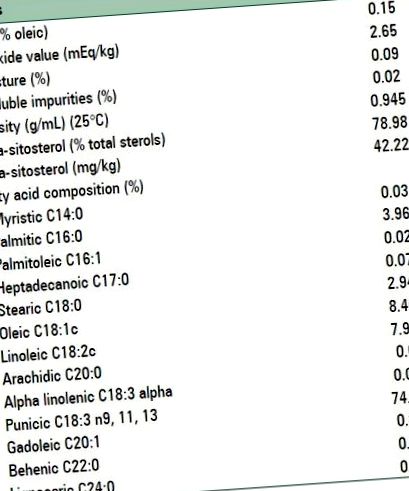
Склад PSO наведено в таблиці 1. PSO та плацебо було підготовлено Zahravi Inc., Тегеран, Іран. Капсули плацебо містили середньоланцюговий триацилгліцерин.
Таблиця 1
Склад олії насіння граната
На підставі хімічного аналізу основний вміст жирних кислот у PSO був таким; Пунінова кислота (ПА) (18: 3) 74,48%; олеїнова кислота (18: 2) 8,46%; пальмітинова кислота (16: 0) 3,96%; стеаринова кислота (18: 0) 2,94%; і мікроелементи (1%) інших жирних кислот. Вміст антиоксиданту Вітамін Е в неочищеній PSO становив 36 · 90 мг/100 г; який витримували при холодній температурі, щоб запобігти окисленню, доки його не сформулювали в капсулах.
Статистичний аналіз
Це намір лікувати клінічне випробування. Результати виражаються як середнє значення ± SD для кількісних змінних та n (%) для якісних змінних, а відмінності вважалися значущими при P ≤ 0,05.
Статистичний аналіз даних проводили за допомогою програмного забезпечення SPSS версії 21.0 (Чикаго, Іллінойс, США). Якісні змінні порівняно між двома досліджуваними групами за допомогою критерію хі-квадрат. Нормальність кількісних параметрів була визначена за допомогою критерію Колмогорова – Смірнова. Для порівняння кількісних параметрів протягом періоду до та після втручання, в межах та між групами використовували парний t-тест.
Для порівняння середніх значень змінних після випробування та визначення основного ефекту лікування застосовували загальну лінійну модель (ANCOVA) із 8-тижневими значеннями (тривалістю випробування) як залежними змінними, вихідними значеннями як коваріатами та групою лікування як фіксований коефіцієнт.
РЕЗУЛЬТАТИ
Базові характеристики пацієнтів суттєво не відрізнялись між групами, які отримували ПСО, та середнім віком у групі плацебо 52 ± 6,8 (роки), а в групі плацебо - 48 ± 85 (роки). У групі PSO 26% людей були жінками та 22% людей у групі плацебо були жінками. Тривалість діабету становила 7,8 ± 2,2 (роки) та 7,5 ± 2,3 (роки) відповідно у групі PSO та плацебо [Таблиця 2].
Таблиця 2
Базові характеристики пацієнтів у групах олії граната та плацебо
У порівнянні між групами антропометричні вимірювання та дієтичні фактори були однаковими у двох досліджуваних групах до та після дослідження. У груповому порівнянні досліджені змінні не мали суттєвих змін після випробування у двох досліджуваних групах [Таблиця 3].
Таблиця 3
Антропометричні та дієтичні фактори в олії гранатових кісточок та групах плацебо
Середня концентрація загального холестерину суттєво відрізнялася між двома групами на початковому та кінцевому рівні; однак середні зміни не відрізнялись між двома групами наприкінці дослідження.
Концентрація TG суттєво відрізнялася між двома групами на початковому рівні, але не було значущої різниці між двома групами на 8 тижні. Також середня концентрація ХС ЛПНЩ суттєво відрізнялася між двома групами на вихідному рівні; однак на 8-му тижні між двома групами не було значних відмінностей, а також середніх змін. Наприкінці дослідження рівень ХС ЛПВЩ значно знизився в обох групах порівняно з вихідним рівнем; однак на кінець дослідження між двома групами не було значущих відмінностей. Споживання PSO не мало суттєвого впливу на рівні FPG, інсуліну, HbA1c, аланінтрансферази та HOMA-IR [Таблиця 3].
Таблиця 4
Плазмові концентрації вимірювальних факторів в олії гранатових кісточок та групах плацебо
Як було показано в сукупній формі, чотири людини в групі PSO не змогли продовжити дослідження. Дві жінки мали висип та свербіж, які зникли після відміни препарату. У чоловіка було розлад шлунково-кишкового тракту (ШКТ). У іншого чоловіка була кровотеча з верхнього відділу шлунково-кишкового тракту, що спричинило госпіталізацію пацієнта. Після лікування він виписався. Троє пацієнтів групи плацебо припинили плацебо через головний біль або легке розлад живота [Рисунок 1].
Блок-схема дослідження
ОБГОВОРЕННЯ
У цьому дослідженні ми виявили, що споживання 2000 мг PSO/день протягом 8 тижнів не впливало на рівень глюкози в крові натще, резистентність до інсуліну та ліпідний профіль у хворих на цукровий діабет. Наскільки нам відомо, це перше дослідження, яке оцінювало результати споживання ПСО у хворих на цукровий діабет. Попередні дослідження показали ефекти PSO на моделях тварин [19]. У дослідженні, проведеному на мишах, Miranda et al. показали, що ПА не зменшує накопичення жиру в печінці та інших органах щурів, які харчуються обезогенною дієтою, і не призводить до поліпшення глікемічного контролю. [20] Nekooeian та ін. досліджували вплив щурів на цукровий діабет типу 2 PSO. Вони вказали, що рівень інсуліну в плазмі збільшується без будь-якого зниження рівня глюкози в плазмі. Механізм цього невідомий, але він може бути пов'язаний з регуляцією генів активованого проліфератором пероксисоми рецептора-g (PPAR-g). [21]
Дослідження in vitro показало, що пунінова кислота покращує фактор некрозу пухлини-α (TNF-α), спричинену дисфункцією білка, тому поглинання глюкози та резистентність до інсуліну можуть покращитися після введення пунінової кислоти. [22] В іншому дослідженні споживання PSO призвело до зниження рівня TNF-α у плазмі крові у мишей. Однак лікування PSO у пацієнтів з дисліпідемією не впливало на рівень TNF-α у сироватці крові в одному дослідженні. [23]
Крім того, дослідження in vitro зафіксували, що пунінова кислота є агоністом для PPAR, молекулярною мішенню для тіазолідиндіонів, протидіабетичних засобів. Однак природними агоністами PPAR є пунікова кислота. ПА може підвищувати експресію генів PPAR і, таким чином, покращує гомеостаз глюкози та інсулінорезистентність, пов’язану із запаленням. [24]
Вони також показали, що PSO може зменшувати окислювальний стрес, але не впливав на ліпідний профіль сироватки крові. Попередні дослідження задокументували, що поліненасичені жирні кислоти n-3 є гіполіпідемічним агентом. [25,26] Результати нещодавніх досліджень впливу PSO на ліпідні профілі суперечливі. У цьому дослідженні не було суттєвої різниці в рівні загального холестерину в сироватці крові, рівня ЛПНЩ, рівня ЛПВЩ та рівня ТАГ у двох групах хворих на цукровий діабет. У дослідженні in vivo на ожиріних гіперліпідемічних щурах було продемонстровано, що дієта, доповнена ПСО, не впливала на жирову тканину черевної порожнини та рівень ліпідів сироватки крові, але зменшує накопичення печінкового триацилгліцерину, аналогічно контрольній групі. [14] Ймовірний механізм, підтверджений у дослідженні in vitro, що в клітинах HepG2 9-цис, 11-транс, 13-цис CLN пригнічували синтез TAG. [27] Mirmiran та співавт. встановили, що споживання 800 мг PSO не змінює рівень холестерину та LDL-C, але знижує співвідношення TAG та TAG: HDL-C протягом 4 тижнів дослідження у пацієнтів з гіперліпідемією. [28]
Слід зазначити, що попереднього досвіду застосування ПСО у хворих на цукровий діабет немає, що обмежувало нас введенням підвищених доз ПСО.
Обмеженнями цього дослідження є невеликий обсяг вибірки досліджуваної популяції, а не оцінка рівня PSO у сироватці крові.
Потрібні подальші дослідження для оцінки ефекту добавок ПСО у хворих на цукровий діабет.
ВИСНОВКИ
У цьому дослідженні ми виявили, що споживання 2000 мг PSO/день протягом 8 тижнів не впливало на рівень глюкози в крові натще, резистентність до інсуліну та ліпідний профіль у хворих на цукровий діабет. Це може стосуватися невеликого обсягу вибірки нашого дослідження. Нам потрібно дослідити вплив PSO на більші групи людей, або ми повинні збільшити тривалість дослідження. Як ми показали безпеку 2000 мг/день PSO, майбутні дослідження можуть збільшити дозу його.
- Повна стаття Розгляд мікробіоти кишечника при лікуванні цукрового діабету 2 типу
- Кушинг; s-синдром із втратою ваги та цукровим діабетом II типу BES2002 21-й суглоб
- Екстракт насіння селери Переваги, побічні ефекти; Дозування
- Експерти відзначають затримку баріатричної та метаболічної хірургії під час пандемії COVID-19
- Ексклюзивне інтерв’ю Дженніфер Стоун про те, як вона керує акторською діяльністю, діабет 1 типу та багато іншого