Варіанти гена рецептора меланокортину-3 при захворюванні ожирінням
Анотація
ІНФОРМАЦІЯ: Дослідження зв'язків та нокаутів на мишах свідчать про те, що меланокортин-3-рецептор (MC3R) є кандидатом на ген ожиріння.
ЦІЛЬ: Щоб оцінити, чи мутації MC3R лежать в основі захворюваності на ожиріння.
ПРЕДМЕТИ І МЕТОДИ: Кодування MC3R та 5 ′ -фланговані області були послідовно розподілені у 48 суб’єктів, а виявлені варіанти генотипували у 252 фіні, що страждають ожирінням (ІМТ ≥40 кг/м 2). Зміни гелю використовували для вивчення того, чи мутація передбачуваного промотору змінює зв'язування GATA-фактора.
РЕЗУЛЬТАТИ: Було знайдено три найпоширеніші варіанти MC3R: 17C> Варіант, що змінює Thr6 → Lys на 16%, 241G> Варіант, що змінює Val81 → Ile на 15%, і заміщення −239A> G у місці зв'язування GATA у 21% випробовуваних. Ще чотири варіанти були виявлені в 5 'фланговій області. Частота трьох типових варіантів не відрізнялася у пацієнтів із ожирінням та контолом. Серед страждаючих ожирінням варіанти 17C> A та 241G> A були спільно передані та пов'язані із збільшенням співвідношення інсулін-глюкоза (P G мутація.
ВИСНОВКИ: Варіанти гена MC3R є загальними і не пояснюють захворюваність на ожиріння у людей. Ці варіанти пов’язані з незначними змінами в початку набору ваги, гіперлептинемією та співвідношенням інсулін – глюкоза. Мутація -239A> G скасовує зв'язування GATA-4 з промоторною областю MC3R.
Вступ
Частка жиру в організмі відображається циркулюючими рівнями лептину та інсуліну, а тривалий гомеостаз маси тіла досягається шляхом інтеграції цих гормональних сигналів центрами гіпоталамусу. 1,2,3 Нейропептиди, отримані з попередника АКТГ проопіомеланокортину (POMC) та меланокортинових рецепторів (MCR), відіграють ключову роль у цьому складному контролі апетиту та маси тіла. 1,2 MC3R і MC4R сильно виражені в областях мозку, що беруть участь у регулюванні енергетичного балансу. 2 MC4R відіграє важливу роль в енергетичному гомеостазі, оскільки цілеспрямоване порушення викликає гіперфагію та ожиріння у мишей. 4 мутації MC4R лежать в основі до 4% важкого ожиріння на початку захворювання або у дорослих. 5,6 Спостережувана зв'язок між ожирінням та хромосомною областю 20q13 також робить ген MC3R правдоподібним кандидатом для ожиріння людини. 7 Крім того, порушення MC3R у мишей призводить до збільшення жирової маси, гіперлептинемії та резистентності до інсуліну. 8,9 Ми розглянули, чи мутації гена MC3R лежать в основі захворюваності на ожиріння та/або пов'язані із зміною метаболічних параметрів.
Предмети та методи
У 1989–1995 рр. Було зібрано когорту з 252 пацієнтів із ожирінням (ІМТ ≥40 кг/м 2, 182 жінки/70 чоловіків, вік 21–67 років, поширеність діабету та гіпертонії 24 та 45%). 10 Історія розвитку ваги оцінювалася за допомогою опитувальника. Для виявлення мутації 1400 bp 5 ′ -флангованої області та всієї кодуючої області гена MC3R були секвенувані у 48 суб’єктів, а варіанти виявлені генотиповано в решті когорти. Зразки крові від 312 здорових донорів крові (153 жінки та 159 чоловіків) з Фінської служби переливання крові Червоного Хреста служили контролем для оцінки частоти алелів у фоновій популяції. Концентрації лептину визначали за допомогою радіоімунологічного аналізу (Linco Research Inc., Сент-Чарльз, Міссурі, США), а інтра- та інтерактивні CV менше 5%. Рівні глюкози, інсуліну та ліпідів вимірювали, як описано раніше. 10
Секвенування та генотипування ДНК
Після ПЛР ген MC3R секвенували за допомогою пар праймерів: 5 ′ - IndexTerm TGACCAGAGCAGACTACTTTCA-3 ′ та 5 ′ - IndexTerm TGAGCAAAGACAACAGCCACT-3 ′; 5 ′ - IndexTerm TCTTCTTCCACCCCAGACTC-3 ′ та 5 ′ - IndexTerm GCAAGACAGGGGATGTGTTA-3 ′; 5 ′ - IndexTerm CCCTTGGCCAATATGAAAAA-3 ′ та 5 ′ - IndexTerm CCAGATACGTCTTTTGGATGC-3 ′; 5 ′ - IndexTerm TCTCTACCCTCCCCATCCTT-3 ′ та 5 ′ - IndexTerm GGGCATTGGACACACTTACC-3 ′; 5 ′ - IndexTerm CATCGTCAGTCTGCTGGAAA-3 ′ та 5 ′ - IndexTerm GAGCATCATGGCGAAGAAC-3 ′; та 5 ′ - IndexTerm CTCGGAGAGCAAAATATGGTCA-3 ′ та 5 ′ - IndexTerm TCACGTGGATGGAAAGTCAA-3 ′. Секвенування проводили за допомогою секвенсора ДНК ABI Prism 377. Генотипування варіантів -239A> G, 17C> A та 241G> A проводили з використанням ферментів рестрикції AlwЯ, HpyCH4IV та BseDI, відповідно, і гель-електрофорез.
Аналіз електрофоретичної мобільності (EMSA)
Ядерні білки готували 11 з клітини пухлини миші Сертолі MSC-1, Т-клітинної лімфоми Jurkat та ліній фібробластів NIH 3T3, експресуючи GATA-4 та GATA-6 (MSC-1), GATA-3 (Jurkat) та не відомих GATA білки (NIH-3T3). Зонди були підготовлені відпалом олігонуклеотидів 5 ′ - IndexTerm TTTCTATGTAAACAAGATAAAAACTGCTCCTCCT-3 ′ (що відповідає нуклеотидам -253-222) та 5 ′ - IndexTerm AGGAGGAGCAGTTTTTATTTTTTATATATATTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTATATATATATTTTTTATATATATATTTATGGATAAAAACTGCTCCTCCT-3 ′ і 5 ′ - IndexTerm AGGAGGAGCA-GTTTTTATCC.TGTTTACATAGAAA-3 ′ (MCR3mut, −239A> G-мутація підкреслено) та 5 ′ - IndexTerm CCCATAAAGATAGGGA-3 ′ і 5 ′ - IndexTerm TCCCTATCTTTATGGG-3 ′ (відповідає нуклеотидам β-182 до 18182 -1) ген). Один з олігонуклеотидів кожного зонда перед відпалом був 5-кінцево міченим [γ- 32 P] АТФ. Реакції зв'язування проводили, як описано. 13 Антитіла були від компанії Santa Cruz Biotechnology Inc. (Санта-Крус, Каліфорнія).
Статистичний аналіз
Тест Манна – Уітні за ранговою сумою був використаний для аналізу відмінностей між середніми показниками групи та точним тестом Фішера для розподілу частот.
Результати
Варіанти гена MC3R
У кодуючій ділянці MC3R були виявлені дві загальні мутаційні помилки: нуклеотид 17C> Змінна амінокислота 6 з треоніну на лізин та 241G> Змінна амінокислота 81 з валіну на ізолейцин. П'ять додаткових варіантів, -939G> C, -911G> A, -803T> C, -373G> T і -239A> G були виявлені в передбачуваній промоторній області. Варіант −239A> G був локалізований у консенсусному сайті зв'язування фактора транскрипції GATA 13 (aaacaaGATAaaaact), що містить нуклеотиди від -244 до -228 гена MC3R (загальна алельна форма жирним шрифтом та підкресленням).
Частоти генотипів для варіантів 17C> A, 241G> A та −239A> G не відрізнялися між хворобливим ожирінням та контрольною популяцією (Таблиця 1A).
Варіант −239A> G та прив’язка GATA
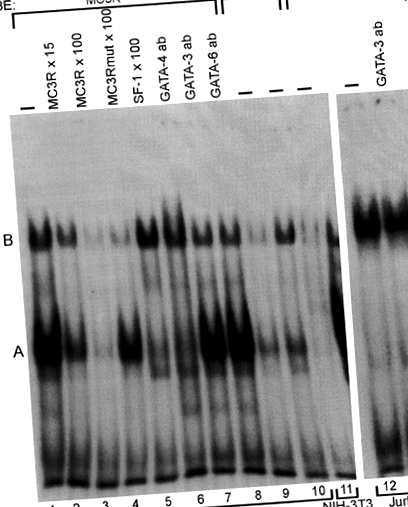
У EMSA ядерні екстракти, що рясно містять GATA-4/GATA-6, дають сильну відсталу смугу А з зондом дикого типу (рис. 1, доріжка 1), тоді як аналізи з використанням олігонуклеотиду MC3Rmut виявляють лише слабкий комплекс білок – ДНК (рис. 1, смуги 9 та 10). У надлишку неміченого олігонуклеотиду MC3R або SF-1 смуга A була чітко ослаблена (рис. 1, смуги 2, 3 та 5), що вказує на специфічне зв'язування та припускає, що з різних білків GATA GATA-4 відповідає за утворення смуги А. Без маркування MC3Rmut не змінив формування смуги A (рис. 1, смуга 4). В експериментах із суперзсувом антитіло GATA-4 скасувало смугу A, вказуючи, що GATA-4 зв'язується з зондом MC3R, тоді як ні GATA-3, ні GATA-6 не викликали ніякого суперзсуву (рис. 1, смуги 6, 7 та 8). Мутація −239A> G не впливала на зв’язування білка (ів), що утворює смугу B (рис. 1, смуги 2–4).
GATA-4 пов'язується з олігонуклеотидом MC3R дикого типу (MC3R). Ядерні екстракти (NE) з клітин MSC-1, NIH-3T3 та Jurkat інкубували з 32 міченими Р-олігонуклеотидними зондами. Коли використовували екстракт MSC-1 (10 мкг) і мічений MC3R, утворилися дві основні смуги A і B (смуга 1). Зв’язування білків конкурували з неміченими MC3R у 15- та 100-кратному молярному надлишку (доріжки 2 та 3), або мутованих MC3R (MC3Rmut, провулок 4) або SF-1 (доріжка 5) олігонуклеотидів у 100-кратному молярному надлишку. У експериментах із суперзсувом використовували антитіла проти GATA-4 (смуга 6), GATA-3 (смуга 7) та GATA-6 (смуга 8). Позначений MC3Rmut використовували як зонд з 10 мкг (доріжка 9) або 20 мкг (доріжка 10) MSC-1 ядерним екстрактом. Екстракт NIH-3T3 (10 мкг, смуга 11), без відомих білків GATA, та екстракт клітин Jurkat (10 мкг, смуга 12 та 13), що містять велику кількість білка GATA-3, інкубували з міченим MC3R. Експеримент суперзсуву з антитілами GATA-3 показаний на доріжці 13.
Варіанти MC3R та метаболічні параметри
Варіанти генів 17C> A та 241G> A були спільними у всіх випадках, крім 3, що свідчить про майже повну нерівновагу зв'язку. Особи з комбінованим генотипом 17CC/241GG мали нижчі співвідношення інсулін-глюкоза та нижчий рівень лептину, і, як правило, важили менше на 20 років, ніж ті, що мали комбіновані варіанти генотипів (Таблиця 1B). Статус носія для варіанту -239A> G був пов'язаний із тенденцією до зниження максимальних значень ІМТ у порівнянні з гомозиготами дикого типу (45,7 ± 0,7 проти 47,7 ± 0,5 кг/м 2; P= 0,06).
Обговорення
Білки, що зв’язують GATA, є факторами транскрипції цинкового пальця, що регулюють експресію генів, диференціювання та проліферацію клітин. 14 Ми демонструємо, що з різних білків GATA 3, 4 і 6 GATA-4 відповідав за зв'язування з GATA-сайтом промотору MC3R. GATA-4 експресується в клітинах гіпофіза та гіпоталамуса, клітинах гонад та надниркових залоз 15,16 та MC3R у корі головного мозку, таламусі, гіпокампі, гіпофізі та гіпоталамусі. 17,18,19 Таким чином, схеми експресії цих двох генів перекриваються, припускаючи, що GATA-4 є регулятором MC3R в природних умовах. Варіант −239A> G асоціювався із тенденцією до зниження максимального ІМТ (45,7 ± 0,7 проти 47,7 ± 0,5 кг/м 2; P= 0,06), а також був незалежним предиктором максимального ІМТ у ожирілих (поступовий регресійний аналіз; Р.-приріст у квадраті = 0,019; P= 0,03), що вказує на те, що це може чинити модулюючий вплив на розвиток максимальної ваги.
Три виявлені варіанти гена MC3R були поширеними серед людей із ожирінням, а також у контрольних суб'єктів, і тому не пояснюють захворюваність на ожиріння. Мутація Thr6 → Lys розташована у позаклітинному N-кінці, а Val81 → Ile у першій трансмембранній частині MC3R. У пацієнтів із ожирінням ожиріння рідкісні варіанти амінокислот були пов’язані з вищими рівнями лептину та співвідношенням інсулін – глюкоза порівняно з пацієнтами, гомозиготними за загальними варіантами. Вони також повідомили про тенденцію до вищого ІМТ у 20 років. Хані та ін виявили збільшення співвідношення інсулін-глюкоза у здорових суб'єктів із варіантом алелів MC3R порівняно зі здоровими суб'єктами з алелями дикого типу. 20 У сукупності ці дані вказують на те, що варіанти гена MC3R можуть спричиняти незначні зміни параметрів, пов’язаних із ожирінням, і що ці зміни не обмежуються лише пацієнтами із ожирінням.
Список літератури
Wardlaw SL. Ожиріння як нейроендокринна хвороба: уроки мутацій рецепторів проопіомеланокортину та меланокортину у мишей та чоловіків. J Clin Ендокринол Метаб 2001; 86: 1442–1446.
Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Bauer TL & Caro JF. Концентрація імунореактивного лептину в сироватці крові у людей із нормальною вагою та ожирінням. New Engl J Med 1996; 334: 292–295.
Хушар Д., Лінч, Каліфорнія, Фейрчайлд-Хантресс V, Данмор Дж., Фанг Q, Беркмайєр Л.Р., Гу В, Кестерсон Р.А., Бостон Б.А., Конус Р.Д., Сміт Ф.Д., Кемпфілд, Л. Цільове порушення мишачого рецептора меланокортину-4 призводить до ожиріння у мишей. Клітинка 1997; 88: 131–141.
Lee JH, Reed DR, Li W-D, Xu W, Joo E-J, Kilker RL, Nanthakumar E, North M, Sakul H, Callum B & Price RA. Сканування геному на ожиріння людини та зв’язок із маркерами у 20q13. Am J Hum Genet 1999; 64: 196–209.
Chen AS, Marsh DJ, Trumbauer ME, Frazier EG, Guan XM, Yu H, Rosenblum CI, Vongs A, Feng Y, Linhai C, Metzger JM, Strack AM, Camacho RE, Mellin TN, Nunes CN, Min W, Fisher J, Gopal-Truter S, MacIntyre DE, Chen HY & Van der Ploeg LHT. Інактивація мишачого рецептора меланокортину-3 призводить до збільшення маси жиру та зниження сухої маси тіла. Nature Genet 2000 р .; 26: 97–102.
- Медична марихуана - проблема ожиріння або можливість Міжнародний журнал ожиріння
- Довготривале ожиріння та фізичне функціонування у літніх американських міжнародних журналах з ожиріння
- Зворотній зв’язок між розміром теляти та грудей у жінок із ожирінням Міжнародний журнал ожиріння
- Чи є стійкість до лептину причиною або наслідком ожиріння, спричиненого дієтою, Міжнародний журнал
- Хворобливе ожиріння після пошкодження спинного мозку, нездужання, яке не підлягає лікуванню