Том 3, глава 114
Марк І. Еванс, доктор медицини
Голова кафедри акушерства та гінекології Університету MCP Haneman, Філадельфія, Пенсільванія (Том 3, Глави 83, 114)
Доктор медичних наук Хунг Буй
Директор, програма діагностики плоду, лікарня Каролінкса, відділ молекулярної медицини, відділення клінічної генетики, Стокгольм, Швеція
(Том 3, глава 114)
Юваль Ярон, доктор медичних наук
Директор відділу пренатальної генетичної діагностики, Тель-Авівський медичний центр Сураскі, Тель-Авів, Ізраїль (Том 3, глава 114)
Скринінг на генетичні розлади стає все більшою частиною акушерської допомоги. Незважаючи на те, що гінекологи протягом десятиліть застосовують подібні підходи до раку шийки матки, серед службовців охорони здоров'я завжди існувала основна стурбованість тим, що екстраполяція на акушерські/фетальні розлади буде неправильною. Майже три десятиліття успішного використання альфа-фетопротеїну (AFP) і тепер багаторазові маркери не полегшили ці проблеми.
Виявлення осіб із захворюваннями, як правило, включає тести або процедури, які проводяться на особах, які, як вважають, мають підвищений ризик. Лише невелика частина загальної популяції, як правило, має достатній ризик, однак, щоб виправдати проведення цих тестів. Щодо генетичних порушень, часто існують підгрупи населення, які, як відомо, піддаються особливо високому ризику, будь то похилий вік матері та синдром Дауна, африканська спадщина та серповидно-клітинна хвороба, єврейська спадщина Ашкеназі та хвороба Тей-Сакса чи незліченні інші. Для деяких з цих розладів, хоча ризик для будь-якої особи в категорії високого ризику вищий, ніж у категорії низького ризику, якщо категорія високого ризику досить мала, більшість постраждалих людей можуть походити з категорії низького ризику . 2 Зокрема, з появою молекулярних технологій та проекту «Геном людини», ми тепер маємо можливість шукати тисячі потенційних розладів у будь-якої людини, яка може бути абсолютно безсимптомною.
Основа скринінгу на будь-який процес захворювання вимагає фундаментального розуміння відмінностей між діагностичними та скринінговими тестами. Діагностичні тести покликані дати остаточну відповідь на питання, чи є у пацієнта саме ця проблема? Як правило, це складні тести, які зазвичай вимагають складного аналізу та інтерпретації. Вони, як правило, дорогі, і зазвичай їх проводять лише пацієнтам, які вважаються «в зоні ризику». І навпаки, скринінгові тести проводяться здоровим пацієнтам і часто всій відповідній популяції. Вони повинні бути дешевими, простими у використанні та зрозумілими для всіх; їх функція - допомогти визначити, хто з груп низького ризику справді перебуває у групі високого ризику. Результати скринінгових тестів за визначенням не є патогномонічними щодо захворювання. Все, що вони роблять, це визначити, хто потребує подальшого тестування. Що стосується генетичних захворювань, запитайте пацієнта: "скільки вам років?" - це не що інше, як дешевий скринінговий тест. Використовуючи вік 35 років матері як граничний показник, можна виявити від 20% до 30% хромосомних аномалій, таких як синдром Дауна, оскільки саме такий відсоток спостерігається у жінок старше 35 років і яким у США пропонують інвазивне тестування на цій підставі.
Спроби вдосконалити чутливість та специфічність хромосомного скринінгу та зменшити загальні витрати на скринінгові програми як такі були в центрі уваги останніх зусиль. 1,2 Мета полягає у зменшенні потреби у дорогому інвазивному тестуванні, що слідує за позитивним скринінгом, і, хоча це не часто згадується, зменшенні витрат на догляд за аномальними новонародженими, які в результаті скринінгу можуть бути виявлені та вагітність перервана в побажання батьків. 3,4 Робота навколо такого скринінгу та зменшення частоти вроджених вад поділяється по суті на чотири категорії:
- Застосування фолієвої кислоти до зачаття вагітності та на ранніх термінах для зменшення частоти дефектів нервової трубки
- Застосування біохімічних та ультразвукових маркерів у другому триместрі для посилення виявлення синдрому Дауна
- Розширення біохімічних маркерів до першого триместру, щоб забезпечити скринінг у більш ранні терміни гестації
- Розвиток біофізико-ультразвукових характеристик будови плода в першому та другому триместрах.
Дефекти нервової трубки
У 1970-х Брок і Саткліфф 5 вперше описали використання AFP в навколоплідних водах, а пізніше в сироватці матері 6 для пренатального виявлення дефектів нервової трубки. Звичайний пренатальний скринінг приймається у Великобританії з середини 1970-х років, а в США - із середини 1980-х. Оцінка впливу такого скринінгу показала, що рівень народжуваності дітей з дефектами нервової трубки знизився з 1,3 на 1000 народжень у 1970 році до 0,6 на 1000 народжень у 1989 році. 7 У деяких районах США, таких як Південний Схід, які мали вищі за середні показники, падіння стало ще більш драматичним.
Було відмічено кілька змін в епідеміологічних характеристиках дефектів нервової трубки: (1) Частка випадків розщеплення хребта зросла. (2) Частка дефектів нервової трубки в поєднанні з іншими непов'язаними дефектами (тобто синдромами) зросла. (3) Захворюваність серед білої популяції зменшилася відносно захворюваності в інших расах. (4) Частота ізольованих дефектів нервової трубки у жінок зменшилася. Усі вищезазначені результати відповідають посиленому використанню скринінгу AFP материнської сироватки, особливо серед білої популяції. Подібне дослідження у Південній Австралії, проведене Чен і його колегами 8 з 1966 по 1991 р., Показало, що загальна поширеність дефектів нервової трубки (включаючи випадки пренатальної діагностики) не змінювалася протягом двох років. Однак зменшилося народження на 84%, з 2,29 на 1000 у 1966 році до 0,35 на 1000 у 1991 році. Падіння становило 96% для аненцефалії та 82% для роздільної хребта. Приблизно 85% відкритих і закритих дефектів було виявлено до 28 тижнів вагітності за допомогою АФП або УЗД. Подібним чином частка припинених випадків у пренатально виявлених випадках неухильно зростала - із середніх приблизно 20% у 1980 році до більш ніж 80% у 1991 році.
Давно було зрозуміло, що існують расові, географічні та етнічні відмінності у частоті виникнення дефектів нервової трубки і що пацієнти мають підвищений ризик на основі інших захворювань. Відомо, що у діабетиків підвищений ризик дефектів нервової трубки, як і у жінок, які приймають протиепілептичні препарати. 9 І навпаки, у дослідженні 1992 р. Було зроблено висновок, що у пацієнтів, які переживають індукцію овуляції, рівень дефектів нервової трубки не перевищує фоновий. 10
Важливим питанням було зв’язок фолієвої кислоти, її дефіциту та частоти дефектів нервової трубки. Експериментальні, клінічні та ембріологічні дослідження досліджували роль вітамінів як причинного фактора. Особлива увага була прикута до необхідного вітаміну групи В, фолієвої кислоти, яка служить донором метилу, який бере участь у синтезі нуклеїнових кислот, обміні пурино-піримідину та синтезі білка. 11 Через збільшення потреби у фолієвій кислоті під час вагітності вагітні жінки особливо схильні до розвитку відносних дефіцитів. Інші можливі впливи включають недостатнє харчування; фізіологічне гемодилюцію вагітності; підвищений плазмовий кліренс; і генетичні порушення, які можуть вплинути на виробництво, транспорт та метаболізм. 12
Протягом 1990-х років було проведено багато досліджень, спрямованих на доповнення фолієвої кислоти у жінок з високим ризиком дефектів нервової трубки, які, як правило, демонстрували зменшення ризику рецидивів у таких жінок, у яких вже була постраждала дитина. Адміністрація США з питань харчових продуктів і медикаментів розпочала, починаючи з 1998 р., Додавання фолієвої кислоти до хліба та зернових. Наша група продемонструвала різке зниження частки високих значень AFP у материнській сироватці в США після введення регулярних добавок до хліба та зернових. 22 Ще одне опубліковане дослідження показало зниження дефектів нервової трубки на 20% на основі даних, що підтверджуються. 23 Кілька інших людей також підтвердили значне зменшення захворюваності. 24
Скринінг на хромосомні аномалії
У 1984 році Merkatz та його колеги 25 вперше опублікували асоціацію низького рівня AFP у сироватці крові матері з підвищеним ризиком хромосомних аномалій, особливо синдрому Дауна. У наступні роки поступово погоджували цю асоціацію і розуміли, що синдром Дауна - не єдиний анеуплоїдний стан, пов'язаний із низьким вмістом АФП у сироватці крові матері. Трисомія 18 має ще нижчі значення AFP. 26
Прийняття широкомасштабного скринінгу з AFP материнської сироватки ефективно подвоїло потенційне виявлення хромосомних відхилень у популяції. Навіть при старінні репродуктивного населення лише від 25% до 30% немовлят із синдромом Дауна народжуються у жінок старше 35 років (рис. 1). Додавання добре скоординованої скринінгової програми AFP для материнської сироватки дозволяє виявити приблизно 30% із 80% випадків, які народжуються у жінок молодше 35 років. Механіка біохімічного скринінгу (тобто з урахуванням гестаційного віку, раси, діабету стан, стан багатоплідної вагітності та вага матері та коригування за допомогою іншої бази даних або коефіцієнти корекції для материнської раси) були опубліковані раніше і тут не повторюються. 27
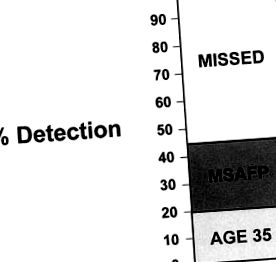
У 1988 р. Уолд та його співробітники 28 припустили, що комбінація параметрів, включаючи AFP, β-хронічний гонадотропін людини (β-HCG) та некон'югований естріол, може значно збільшити частоту виявлення синдрому Дауна до приблизно 60% від загальної кількості (рис. 2 ). Багато досліджень підтвердили підвищену ефективність множинних скринінгових маркерів на противагу лише AFP при виявленні хромосомних аномалій, особливо синдрому Дауна. 29,30,31,32,33,34
Рис. 2. Виявлення методом подвійного та потрійного скринінгу. Супутнє тестування рівня хоріонічного гонадотропіну та естріолу покращує рівень скринінгу альфа-фетопротеїнів приблизно до 60%. MSAFP, материнський сироватковий альфа-фетопротеїн.
Незважаючи на величезні дані та рекомендації національних організацій, таких як Американський коледж акушерства та гінекології, щодо пропонування багаторазового маркерного скринінгу, майже 20% пацієнтів у Сполучених Штатах, які проходять скринінг, все ще мають лише AFP. 35 Існує, по суті, універсальна згода щодо того, що серед трьох загальних параметрів, що використовуються, AFP, β-HCG та некон'югований естріол, що якби можна було вибрати лише один із зазначених вище, то β-HCG є найкращим. Існує віртуальний зв’язок за другим місцем за ефективністю між AFP та некон’югованим естріолом. Оскільки AFP вже використовується в Північній Америці та більшій частині Західної Європи для виявлення дефектів нервової трубки, однак, єдиним справжнім питанням залишається питання, чи є вигідним додавання некон'югованого естріолу як третього параметра.
Еванс та його колеги 37 дослідили багато «догм» 3-х десятиліть біохімічного скринінгу та виявили, що багато з них більше не діють. Ми вважаємо, що великі розбіжності в результатах, про які повідомляють з усього світу, значною мірою зумовлені незначними, а іноді і не такими тонкими відмінностями в лабораторних методах. 37 На гіркі аргументи щодо подвійного проти потрійного скринінгу, частково, відповідає той факт, що вимірювання естріолу набагато ширше, ніж інші параметри. Такі варіації допомагають пояснити, чому лабораторії мають такий різний досвід використання естріолу. Коли методи стандартизовані, велика частина мінливості зникає і дозволяє проводити порівняння «яблука проти яблук» на відміну від порівняння «яблука проти апельсинів». Подібним чином, значна частина повідомлень про зміни в літературі також зникає зі стандартизацією, і коефіцієнт коригування діабету стає непотрібним, якщо належним чином враховувати той факт, що пацієнти з діабетом мають вищу вагу матері. 39,40
Багато статей за останні кілька років розглядали різні складові в режимі маркерів, причому найбільш важливим було відзначено використання вільного β-HCG у другому триместрі на відміну від інтактного β-HCG. Уолд і Хекшоу 41 повідомили в 1993 р., Що використання вільного β-HCG порівняно із загальним β-HCG збільшить частоту виявлення приблизно на 4% для даного хибнопозитивного показника, що використовується разом з віком матері, AFP та некон'югованим естріолом. Інші дослідження припускають, що, особливо у більш ранні терміни гестації (наприклад, 14 та 15 тижнів), вільний β-HCG може мати кращу чутливість та специфічність, ніж інтактна молекула.
Іншим перспективним маркером став пошук клітин плода в материнському кровообігу. Дослідження протягом 1990-х років показали, що виділення та аналіз клітин плода може стати практичним та корисним як скринінговий тест. 42,43,44 Поточний стан фактично слідує за 2 десятиліттями різних пусків і зупинок, які, в свою чергу, виглядали багатообіцяючими та розчарувальними, оскільки Герценберг та його колеги 45 вперше виявили та збагатили флуоресцентну активовану сортування клітин. Велика частина роботи за останні 2 десятиліття була зосереджена на шляхах підвищення ефективності методів виявлення, головним чином, зосереджених на необхідності збільшення збагачення клітин плода від материнського кровообігу, поширеність якого, за оцінками, становить приблизно 1 з 10 мільйонів клітин . 46,47,48
Інша область потенційної застосовності клітин плоду в крові матері полягає у виділенні молекулярної діагностики менделівських розладів. Ло та його партнери 50 змогли визначити резус-статус плода у жінок, які, як відомо, були сенсибілізованими та виходили заміж за чоловіків-гетерозигот. Гейфман-Гольцман та його колеги 51 визначали резус-статус плода за допомогою полімеразної ланцюгової реакції фетальних ядерних еритроцитів, відсортованих з материнської крові. Найближчі кілька років зрештою визначать, наскільки успішним сортування клітин плоду є скринінговим тестом. Спочатку сподівались, що це може бути діагностичним тестом і замінить потребу в інвазивному тестуванні; однак на момент написання статті каріотипи плоду не можуть бути отримані з ізольованих клітин, а лише флуоресценція на місці можливі результати, пов’язані з гібридизацією. Хоча такий результат хороший, як скринінговий тест на анеуплоїдію, наш досвід показує, що приблизно одна третина аномальних каріотипів, що спостерігаються в програмах пренатальної діагностики, не є такими, які можна було б виявити стандартними зондами для хромосом 13, 18, 21, X та Y. 52 До тих пір, поки не будуть отримані повні каріотипи, клітини плоду не замінять інвазивне тестування, але можуть бути важливим доповненням до арсеналу скринінгових технологій.
Багато досліджень пропонують димерний інгібін А як чудовий маркер, який може підвищити чутливість на 3% - 7% для даного показника позитивного екрану. 53 Деякі пропонують чотириразовий скринінг. Існують також парадигми, які включають різні параметри в різний час разом. Хоча попередні дані свідчать про високу чутливість із покращеною специфічністю, приховування результатів від пацієнтів на термін до 1 місяця є етично проблематичним, на наш погляд. Без сумніву, з’явиться кілька підходів до скринінгу, і не буде єдиного єдиного стандартного підходу.
Ще одним двоступеневим підходом став так званий інтегрований тест. 54 Це поєднання крові та ультразвуку першого триместру. Результати не повідомляються пацієнту, який потім чекає результатів крові другого триместру до того, як буде зроблена оцінка ризику. Попередні дані свідчать про зниження хибнопозитивних показників порівнянної чутливості, але компромісом є необхідність пацієнтам чекати 6 тижнів, поки не почнеться завершення процесу скринінгу. Для пацієнтів, які особливо не піклуються про результати, затримка може бути непоганою, але багато пацієнтів вважають таку затримку нестерпною.
Незважаючи на те, що скринінг, як правило, фокусується на трисомії 21, наші та інші дані завжди демонструють різноманітну картину аномалій, виявлених скринінгом. 55 Інша картина аналітичних рівнів спостерігається при трисомії 18. Значення AFP, β-HCG та некон'югованого естріолу, як видається, низькі. 56 Ці низькі значення припускають іншу патофізіологію, ніж для синдрому Дауна. При синдромі Дауна низький рівень AFP та некон'югований естріол та високий β-HCG можна пояснити як відбиття невідповідної незрілості або незрілості плода (тобто всі значення відповідають більш молодому терміну вагітності). У трисомії 18 це пояснення не працює. Раніше ми показали, що існують різні моделі геномно спрямованого внутрішньоутробного уповільнення росту у різних анеуплоїдіях, але як це перетворюється на сироваткові маркери, незрозуміло. Тим не менше, деякі звіти показали, що алгоритм може бути використаний для ідентифікації більшості випадків трисомії, водночас додаючи близько 0,75% до населення, якому пропонують амніоцентез.
З усіх оцінених сироваткових маркерів у матері, пов'язаний з вагітністю білок плазми A (PAPP-A) та вільний β-ХГЧ виявились найбільш прогнозуючими серед усіх як потенційні маркери для скринінгу синдрому Дауна у першому триместрі. 57,58,59,60,61 Канік та Келлнер 61 розглядали скринінг синдрому Дауна у першому триместрі (8-13 гестаційних тижнів) з аналітами материнської сироватки крові. PAPP-A та вільний β-HCG виділялися найбільш перспективними маркерами. Вони підрахували, що ефективність скринінгу цих аналітів на синдром Дауна в поєднанні з віком матері становить 60% випадків виявлення та 5% хибнопозитивних показників. Це схоже на показники скринінгу подвійного скринінгу другого триместру, але менш ефективні, ніж потрійний або чотириразовий скринінг другого триместру. Канік і Келлнер 61 дійшли висновку, що скринінг у першому триместрі з використанням лише сироваткових маркерів не можна рекомендувати, за винятком випадків, коли скринінг у другому триместрі неможливо виконати.
Інтегрований тест (скринінг І та ІІ триместру)
Демонстрація того, що багатомаркерний біохімічний скринінг дозволить виявити більшість плодів з хромосомними аномаліями, такими як синдром Дауна, спричинила політичні та етичні дискусії в Північній Америці та Європі. Хеддоу та його колеги 69 показали, що у жінок старше 35 років можна виявити майже 90% плодів із синдромом Дауна, водночас зменшивши кількість амніоцентезів приблизно вдвічі і більше. З суто громадського та математичного погляду відмова у доступі до жінок старше 35 років, чиї біохімічні екрани не відповідають рівню ризику, достатньо високому, щоб гарантувати витрачання ресурсів. 38 Такий підхід вимагав би переорієнтації філософії та усунення самостійності пацієнта щодо таких питань. Однак, коли автономія та державні долари конфліктують, оправдано очікувати розбіжностей щодо належного використання цих ресурсів.
Czeizel 24 узагальнив дані про те, яку частку вроджених відхилень можна виявити та запобігти. Czeizel вважав, що можна оцінити приблизно 51 із 73 типів вроджених патологій (70%). Поширеність народжень всіх вроджених аномалій може бути зменшена приблизно з 65 до 26 на 1000; 39 на 1000 або 60% можна запобігти. Хоча багато вроджених відхилень можна запобігти, вони не представляють єдиної патологічної категорії, і не існує єдиної стратегії їх профілактики, яка була б доречною.
- Варіації обсягу злаків впливають на кількість вибраного та з’їденого на сніданок
- Відкритий журнал ожиріння - Том 2
- ВООЗ EMRO Плоскостопість серед армії Саудівської Аравії поповнення та фактори ризику Том 12, випуск
- Об’ємне харчування
- Том 22 Випуск 5 Систематична та прикладна акарологія