Споживання магнію
Пов’язані терміни:
- Гіпермагніємія
- Гіпомагніємія
- Магній
- Кров'яний тиск
- Кісткова маса
- Щільність кісток
- Рівень крові магнію
- Споживання кальцію
Завантажити у форматі PDF
Про цю сторінку
Патофізіологія поглинання кальцію, фосфатів та магнію
2 МЕХАНІЗМИ ПОГЛАННЯ МАГНІЮ
Дієтичний магній поглинається трьома механізмами: активним всмоктуванням, пасивною перфузією та розтягуванням розчинника. 357, 358 Активне поглинання є насичуваним, позаклітинним транспортним процесом і регулюється 1,25 (OH) 2D3. Подібно до фосфату, активне всмоктування стає фізіологічно важливим для введення магнію лише тоді, коли внутрішньосвітлова концентрація магнію низька. Для стандартних дієтичних споживань абсолютна кількість активно засвоюваного магнію порівняно мала порівняно з пасивними механізмами. Отже, роль вітаміну D у регуляції поглинання магнію є незначною. Пасивна перфузія відбувається шляхом парацелюлярної дифузії іонів і залежить від концентрації магнію у просвіті. На пасивне поглинання припадає більша частина магнію, що поглинається в тонку кишку і клубову кишку. 358 Тоді як в проксимальному відділі тонкої кишки лінійно збільшується з просвітом концентрація магнію, в клубовій кишці поглинаючий процес магнію повністю насичується при концентраціях просвіту вище 10 мМ 359 (рис. 6–9). Оскільки рух магнію по кишечнику слідує за потоком води через клітини кишечника, розтягнення розчинника 360 представляє додатковий механізм поглинання магнію.
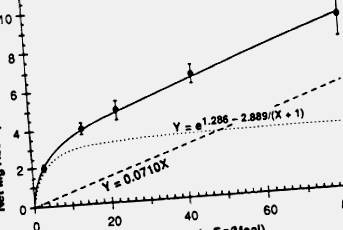
Малюнок 6–9. Чисте поглинання магнію (суцільна лінія), оцінене за методом метаболічного балансу, як функція споживання у здорових людей. Рівняння чистого поглинання, e 1,286–2,889/(X + 1) + 0,0710x, являє собою комбінацію гіперболічної функції (пунктирна лінія) плюс лінійної функції (пунктирна лінія).
Загалом, весь кишечник може засвоювати магній. Отже, чистий вхід залежить як від ефективності всмоктування, так і від часу проходження в кожному окремому сегменті кишечника. Відповідно, хоча найвища швидкість всмоктування магнію відбувається в дванадцятипалій кишці, більша частина харчового магнію всмоктується в дистальному відділі кишечника через довший час транзиту. 357 Існують видові відмінності щодо ролі товстої кишки в цій функції. У птахів і нижчих ссавців товста кишка є основним місцем поглинання магнію, тоді як у людини більша частина елемента поглинається до потрапляння в товсту кишку. 357, 358 Однак слід враховувати, що всмоктування товстої кишки може відбуватися при призначенні клізм, що містять магній. 361
Гіпертонія
ІНШІ ЗАХОДИ
Зміни споживання магнію та кальцію не виявили значного впливу на АТ у людей похилого віку, хоча збільшення споживання вітаміну С має легку гіпотензивну дію та позитивний вплив на ліпідний профіль у літніх гіпертоніків. 46 Кофеїн може мати гострий пресорний ефект у людей, які ще не отримували кофеїн, але регулярне споживання кофеїну не має пресорного ефекту (хоча деякі дослідження показали, що збільшення споживання пов'язане з підвищеним ризиком ІХС). Легкі аеробні вправи (ходьба 30 хвилин на день три-чотири рази на тиждень) призводять до значного зниження АТ (приблизно 20/10 мм рт. Ст.) У старших гіпертоніків. Це також зменшує ризик інсульту незалежно від гіпотензивної дії, покращує профілі глюкози, зменшує вагу та покращує загальне самопочуття. 47
Гормони та порушення мінерального обміну
Кишкові причини гіпомагніємії.
Селективного дієтичного дефіциту магнію не відбувається, і насправді надзвичайно важко викликати виснаження магнію експериментально, харчуючись дієтами з дефіцитом магнію, ймовірно, тому, що збереження магнію в нирках є настільки ефективним. Велика кількість магнію може втрачатися при хронічних діарейних станах (ця рідина може містити більше 10 мекв/л магнію) або через кишкові свищі або тривалий дренаж шлунково-кишкового тракту. 592 Частіше магній потрапляє в мило з жирними кислотами при розладах, пов’язаних із хронічною мальабсорбцією. 593 Дослідження рідкісного аутосомно-рецесивного розладу, гіпомагнезії з вторинною гіпокальціємією (HSH) призвело до ідентифікації перехідного рецепторного потенційного каналу білка TRPM6 у формі гетероолігомеру з тісно пов'язаним канальним білком TRPM7 як ключового молекулярного медіатора кишкового (і нирково-канальцевого) трансепітеліального транспорту магнію. 594
Порушення калію та магнію
Луї-Філіп Лаурін, Мартін Леблан, у “Нефрологія критичної допомоги” (третє видання), 2019
Лікування
Припинення прийому магнію (добавки, ліки, парентеральне харчування) - це перший крок у лікуванні гіпермагніємії. У пацієнтів з нормальною функцією нирок припинення прийому магнію дозволяє гіпермагніємії виправитись; у пацієнтів з нирковою недостатністю або з важкою симптоматичною гіпермагніємією може знадобитися замісна ниркова терапія. Гемодіаліз є кращим перед гемофільтрацією, оскільки зниження концентрації магнію в сироватці крові відбувається швидше. Коли спостерігаються важкі симптоми, кальцій може вводитися як антагоніст магнію для подолання серцевих аритмій, гіпотонії та пригнічення дихання. Звичайна доза становить 50-100 мг елементарного кальцію протягом 5-10 хвилин, але можуть знадобитися більші кількості.
Дієтичне споживання мінеральних речовин (магнію, кальцію та калію) та біологічні процеси старіння
Дієтичні Mg, Ca і K та їх концентрація в організмі сприяють модуляції біологічних процесів, які, як відомо, беруть участь у процесі старіння.
Збільшення дієтичного споживання Mg і K пов’язане з покращенням здоров’я серцево-судинної системи, але факти менш дієві для Ca.
Здається, добавки Ca пов’язані зі скромно підвищеним серцево-судинним ризиком.
Збільшення споживання в їжі Mg, Ca і K пов’язане із зниженням артеріального тиску
Вище споживання К пов’язане зі зниженням ризику інсульту. Подібні, але слабкі докази також доступні для Mg і Ca.
Вище вживання в їжу Ca, і меншою мірою K і Mg, пов'язане зі зниженням ризику діабету 2 типу.
Хоча факти, що демонструють захисний ефект від прийому з їжею Mg, Ca, K та здоров'я серцево-судинної системи, а також T2D, настійно свідчать про подібний вплив на старіння мозку та зниження когнітивних функцій, оскільки ССЗ і T2D є важливими та відомими факторами ризику для мозку та когнітивних здоров'я, досліджень у цій галузі бракує.
Взаємозв'язок між овочами та фруктами (антиоксидантні вітаміни, мінерали та клітковина) і надходження та ризик серцево-судинних захворювань
Магній
Гомеостаз магнію
Виснаження магнію та остеопороз: експериментальні моделі на тваринах
Малюнок 12. Після 16 тижнів дефіциту магнію у щурів (суцільні бруски) кількість остеобластів значно зменшилася порівняно з контролем (відкриті бруски) (Rude et al., 1999) * p
Малюнок 13. Через 4 і 16 тижнів дефіциту магнію у щурів (суцільні бруски) кількість остеокластів було значно підвищено порівняно з контролем (відкриті бруски) (Rude et al., 1999) * p
Малюнок 14. Вплив дієти з низьким вмістом магнію при 10% потреби в поживних речовинах на об’єм трабекулярної кістки (BV/TB), середню ширину трабекулярного середовища (TTh) та число трабекулярних речовин (TbN) у щурів, які харчуються дієтами Control (C) або низьким вмістом магнію (MgD), як визначається мікрокомп’ютерною томографією. Значення є середніми ± SD, n = 7. Бари без загальної букви відрізняються (p Rude et al., 2004).
Ці важкі ступені дефіциту Mg навряд чи часто трапляються в людській популяції. Нещодавно ми повідомляли про менш важкі ступені обмеження Mg у щурів (10%, 25% та 50% від рекомендованої потреби в поживних речовинах), а також спостерігали шкідливий вплив на кістки (Rude et al., 2004; Rude et al., 2005; Rude et al., 2006), включаючи зменшення трабекулярної кістки, зменшення формування кісток та посилення резорбції кісток. Вплив дієти Mg при 10% рекомендованої потреби в поживних речовинах на трабекулярну кістку продемонстровано на рис. 14. Ці неадекватні дієтичні рівні Mg присутні у сегментах людської популяції, як вже обговорювалося раніше, і припускають дефіцит Mg як можливий фактор ризику розвитку остеопорозу.
Магній та взаємозв'язок з діабетом
Дефіцит 3 мг у загальній популяції, хронічно хворих та хворих на цукровий діабет
У Північній Америці споживання Mg не відповідає дієтичним рекомендаціям для значної частини населення. 2,13 У 2004 р. Більше 34% дорослих канадців у віці старше 19 років отримували Mg з їжею та водою нижче середньої розрахункової потреби, встановленої Інститутом медицини (МОМ). 13,14 Зміни у режимі харчування та збільшення обробки харчових продуктів є ключовими факторами, що обумовлюють дефіцит споживання Mg. Дорадчий комітет з дієтичних рекомендацій 2015 року визначив Mg як поживну речовину з дефіцитом. 15
Великий відсоток популяцій, які не відповідають рекомендованому споживанню Mg, свідчить про те, що може існувати проблема дефіциту Mg. Однак зараз недостатньо розуміється кількість магнію, необхідного для оптимального здоров’я. Це відображається великою різницею у рекомендованих споживання, встановленою авторитетними науковими органами з різних юрисдикцій. 14,16,17 Крім того, відсутній біомаркер для оцінки фізіологічного стану Mg, який можна використовувати для рутинного скринінгу з визначеним контрольним інтервалом на основі результатів для здоров'я. Тому в даний час неможливо точно визначити поширеність дефіциту Mg та пов'язаний з цим ризик для здоров'я серед загальної сукупності.
Останні національні оцінки загальної концентрації Mg у сироватці крові в Канаді були отримані на основі даних цикла 3 канадського обстеження заходів охорони здоров’я, проведеного у 2012–2013 роках. 21 Результати цього дослідження свідчать про те, що нинішні концентрації Mg у сироватці крові в Канаді нижчі за концентрації в популяції США на початку 1970-х років, що свідчить про можливе зниження рівня Mg у населення Північної Америки протягом останніх 40 років. Більше 15% деяких статево-вікових груп мали концентрацію Mg у сироватці менше 0,75 ммоль/л.
Низька концентрація Mg у сироватці часто присутня у госпіталізованих пацієнтів. 22 Серед важкохворих пацієнтів частота вираженої гіпомагніємії може становити 65%. 23 Погіршення всмоктування Mg у кишечнику та підвищене виведення Mg із сечею через хвороби, недоїдання або вживання ліків - це фактори, що сприяють.
Магній
Кишкове всмоктування
Чисте всмоктування Mg є результатом всмоктування Mg та секреції Mg у кишковому тракті через жовч та шлунковий та підшлунковий соки. У здорових дорослих людей поглинається 30-50% дієтичного Mg. Виділений Mg ефективно реабсорбується, а ендогенні втрати калових мас становлять лише 20-50 мг на добу -1. Всмоктування Mg відбувається по всьому кишковому тракту, але дистальний відділ тонкої кишки (тонка і клубова кишки) є основним місцем. По суті, це пасивний міжклітинний процес за допомогою електрохімічного градієнта та розтягування розчинника. Активний транспорт відбувається лише при надзвичайно низькому споживанні дієтичних Mg, і його регулювання невідомо. Поглинання Mg у межі щітки може бути опосередковано комплексом Mg/аніон, а витік Mg через базолатеральну мембрану може включати Naport/Mg 2+ антипортові системи. Виявлено ген, причетний до дефіциту Mg у людини. Він експресується в кишечнику та нирках і, здається, кодує білок, який поєднує властивості проникних Са- та Mg каналів з активністю протеїнкінази. Цей ген може бути причетний до поглинання Mg. Через важливість пасивного процесу, кількість Mg у травному тракті є головним фактором, що контролює кількість Mg, що поглинається.
Порушення обміну кальцію, фосфату та магнію
Кишково-ниркова обробка магнію
Кишкове всмоктування харчового магнію відбувається як насичуваним, так і пасивним транспортним процесом, основна частина якого всмоктується в тонкому кишечнику. Етап входження в мембрану щітки ентероцитів контролюється магнієвим каналом TRPM6, який був клонований нещодавно і функціональна характеристика якого триває. Поглинання 3 мг 2+ може коливатися на від 25% до 60%, із середнім поглинанням приблизно 30%. Кишковий транспорт не змінюється у відповідь на хронічні зміни вмісту магнію в їжі. Однак TRPM6 регулюється за рахунок збільшення внутрішньоклітинного Mg 2+ .
Різні фактори змінюють всмоктування Mg 2+ у кишечнику. Високе споживання фосфатів з їжею є інгібуючим, як і високе споживання фітатів. Дія кальцію в їжі складна, і вітамін D, ймовірно, має посилюючий ефект. Гормон росту незначно збільшує всмоктування Mg 2+, тоді як альдостерон та кальцитонін, здається, зменшують його. Як повідомляється, вітамін В6 посилює його.
Mg 2+ виводиться нирками. Втрати через кишкову секрецію та піт у незначних умовах незначні. При ультрафільтруючій концентрації магнію в плазмі від 0,5 до 0,7 ммоль/л (80% від загального вмісту магнію в плазмі) відфільтрована навантаження магнію становить приблизно 104 ммоль (або 2500 мг) на день. Вихід сечі становить приблизно 5% відфільтрованого навантаження (від 4 до 5 ммоль або 100 мг на день). Основна частина відфільтрованого магнію реабсорбується нирковими канальцями (25% у проксимальних канальцях, 65% у товстій висхідній петлі Генле та 5% у дистальних звивистих канальцях) (рис. 10.22).
Транспорт Mg 2+ у товстій висхідній кінцівці переважно пасивний через парацелюлярний шлях. Однак для нормальної реабсорбції Mg 2+ необхідні дві умови: по-перше, генерація електричного, просвіт-позитивного градієнта, індукованого реабсорбцією NaCl, який створює рушійну силу, необхідну для реабсорбції двовалентних катіонів; по-друге, експресія клаудину 16 у тісному з’єднанні, що відповідає за селективність реабсорбції двовалентних катіонів. Різні аномалії, пов'язані з реабсорбцією NaCl або експресією клаудину 16 (раніше називали парацеллін), призводять до гіпермагнезурії, наприклад, атипових випадків синдрому Барттера, який визначається генетичними дефектами, пов'язаними з транспортом NaCl у товстій висхідній кінцівці (див. Також пізніше обговорення) . 34
У дистальному нефроні, тобто дистальному звивистому канальці та сполучній трубочці, Mg 2+ реабсорбується через трансклітинний шлях проти електрохімічного градієнта в гору. Молекулярна ідентичність каналу воротаря, який контролює потрапляння Mg 2+ в епітелій канальців через мембрану межі кисті, була нещодавно виявлена як TRPM6. 3 Він ідентичний такому в кишечнику.
Трубковий транспорт Mg 2+ модулюється сироваткою Mg 2+ і Ca 2+ та об’ємом позаклітинної рідини. Збільшення концентрації Mg 2+ або Ca 2+ у плазмі призводить до депресії транспорту магнію. Позаклітинне розширення об’єму призводить до зменшення проксимальної канальцевої реабсорбції Mg 2+, паралельно з Na + та Ca 2+. Дієтичне обмеження фосфатів призводить до вираженої гіперкальціурії та гіпермагнезурії, що може призвести до явної гіпомагніємії. ПТГ, вазопресин, кальцитонін та глюкагон збільшують канальцеву реабсорбцію Mg 2+, тоді як ацетилхолін, брадикінін та передсердний натрійуретичний пептид стимулюють виведення Mg 2+ із сечею.
Нарешті, було показано, що низка препаратів збільшує виведення Mg 2+ з нирками, включаючи петльові діуретики, такі як фуросемід та етакринова кислота, дистальні діуретики, такі як тіазиди, та осмотичні діуретики, такі як маніт та сечовина. Тіазидні діуретики збільшують доставку натрію до коркового збірного протоку, розсіюючи сприятливий електрохімічний градієнт для надходження магнію на цій ділянці. Крім того, ниркові синдроми, що витрачають магній, спостерігались у пацієнтів, які отримували антибіотики, такі як гентаміцин, протипухлинні засоби, такі як цисплатин, та інгібітори кальциневрину циклоспорин та такролімус. Точні механізми дії цих засобів недостатньо вивчені.
- Гіпурікемія - огляд тем ScienceDirect
- Гіпердинамічна циркуляція - огляд тем ScienceDirect
- Лікарський гриб - огляд тем ScienceDirect
- Лейкоенцефалопатія - огляд тем ScienceDirect
- Ілеїт - огляд тем ScienceDirect