Механізми захисту гастродуоденальної слизової оболонки
Гайдер сказав
1 Research, West Los Angeles, VA Medical Center
3 Коледж літератури та наук Каліфорнійського університету, Лос-Анджелес, Лос-Анджелес, Каліфорнія, 90073
Ізумі Каджі
1 Research, West Los Angeles, VA Medical Center
4 Медичний факультет Каліфорнійського університету, Лос-Анджелес, Лос-Анджелес, Каліфорнія, 90073
Джонатан Д. Кауніц
1 Research, West Los Angeles, VA Medical Center
2 Medical Services, West Los Angeles, VA Medical Center
4 Медичний факультет Каліфорнійського університету, Лос-Анджелес, Лос-Анджелес, Каліфорнія, 90073
5 Кафедра хірургії Каліфорнійського університету, Лос-Анджелес, Лос-Анджелес, Каліфорнія, 90073
Анотація
Мета огляду
Висвітлити останні події у галузі захисту слизової оболонки шлунково-дванадцятипалої кишки з акцентом на взаємодії просвіту та кишок.
Недавні висновки
Зростає інтерес до фізіологічних функцій просвітницьких хемосенсорів, присутніх від мови до товстої кишки, які виявляють органічні молекули в просвіті, пов’язані з прийомом поживних речовин, зазвичай пов’язаних із спеціалізованими клітинами, зокрема ентероендокринними клітинами. Ці рецептори трансдукують вивільнення пептидних гормонів, зокрема продуктів, одержуваних проглюкагоном, таких як глюкагоноподібні пептиди (GLP), які мають глибокий вплив на функцію кишечника та метаболізм. Промінні хемосенсори трансдукують вивільнення GLP у відповідь на зміни в клітинному середовищі, як частина механізму хемосенсибілізації поживних речовин. GLP-2 має важливий трофічний вплив на слизову оболонку кишечника, включаючи збільшення швидкості проліферації стовбурових клітин та зменшення проникності трансмукози для іонів та дрібних молекул, на додаток до збільшення швидкості секреції бікарбонату дванадцятипалої кишки. GLP-1, хоча традиційно вважається інкретином, що підсилює дію інсуліну на периферичні тканини, також має трофічну дію на епітелій кишечника.
Резюме
Краще розуміння механізмів, що опосередковують вивільнення GLP, може додатково висвітлити важливість хіміосенсибілізації поживних речовин як важливої складової механізму, який опосередковує трофічну дію просвітніх поживних речовин. GLP-1 і -2 вже застосовуються в клінічному застосуванні для лікування діабету та кишкової недостатності. Поліпшення розуміння контролю за їх вивільненням та їх ефектом на кінцеві органи дозволить виявити нові клінічні показання та втручання, які посилюють їх вивільнення.
Вступ
Десятирічне спостереження про те, що кишечник атрофується під час голодування, служить основою для концепції «трофічних кормів», коли невелика кількість поживних речовин, що просвітлюються, запобігає атрофії слизової оболонки, навіть коли загальний харчовий статус є недостатнім. Механізм, на якому базується ця концепція, як правило, приписують дієтичним компонентам, таким як глутамін, які служать прямим «паливом» для ентероцитів, в основному на основі досліджень in vitro [1]. Тим не менше, численні спостереження підтримують альтернативну концепцію, згідно з якою трофічні ефекти молекул просвіту опосередковуються здебільшого за допомогою гормональних механізмів. Загальною нашою темою буде висвітлення деяких останніх публікацій, які підтверджують цю гіпотезу.
З клонуванням та деорфанізацією множинних рецепторів, пов’язаних з G білками (GPCR), активованих органічними молекулами, які є або компонентами їжі, або генеруються або секретуються у відповідь на прийом їжі, багато нового інтересу викликало поняття люміналу хіміосенсибілізація, внаслідок молекулярної характеристики задіяних датчиків просвіту. Хоча існує п'ять різних смаків, класично пов'язаних з ротовою порожниною, шлунково-кишковий тракт в основному виражає солодкі, гіркі та умами (білкові) смакові рецептори (сімейства TAS1R і TAS2R), які складаються з гетеродимерів GPCR. Унікальні комбінації цих підтипів рецепторів у кожній родині надають різні функціональні можливості і, отже, сприйняття смаку. Рецептори солодкого смаку використовують комбінацію TAS1R2 і TAS1R3, тоді як рецептори умами складаються з TAS1R1 і TAS1R3 [7]. Гіркі рецептори смаку використовують це друге сімейство рецепторів смаку, TAS2R, які мають понад 25 відомих підтипів [7].
Через приплив безлічі неушкоджених та частково перетравлених органічних сполук, що супроводжують прийом їжі, надзвичайно цікавим є вивчення хіміосенсорів передньої кишки для цих сполук, що містяться у верхній частині кишечника. На даний момент GPCR, активовані довголанцюговими ФА (FFA1 і 4, також відомими як GPR40 і 120), SCFA (FFA3 і 2, також відомими як GPR41 і 43), та жовчні кислоти (GPBAR, також відомий як GPR131 або TGR5) мають були виявлені в просвіті кишкової мембрани [8].
Активація TASR, FFAR та GPBAR вивільняє декілька біоактивних пептидів, включаючи сімейство GLP, які генеруються завдяки активності прогормон-конвертази 1/3, яка протеолітично розщеплює проглукагон, виробляючи GLP-1 та GLP-2 в ентероендокринних L-клітинах [ 9 *]. GLP-1 є важливим інкретином, що виділяється L-клітинами, розподіленими по шлунково-кишковому тракту, і, як вважають, допомагає опосередковувати контроль глікемії. GLP-2 має важливий трофічний вплив на епітелій кишечника, включаючи модуляцію глибини крипт-ворсинок, швидкості проліферації клітин крипти та довжини та ваги кишечника [10 *]. Крім того, GLP-2 експресується в інших типах клітин у шлунково-кишковому тракті та центральній нервовій системі [11], підтримуючи його функцію як важливого проміжного продукту в багатьох сигнальних шляхах клітин. GLP метаболізуються здебільшого дипептидилпептидазою IV (DPP-IV), інгібування якої клінічно застосовується для посилення ефекту ендогенних гормонів, переважно при лікуванні діабету [12 *].
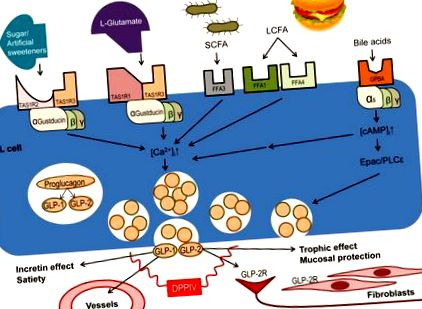
Таким чином, ці GPCR, особливо експресовані на L-клітинах, беруть участь у перетворенні ефектів прийому їжі в багато метаболічних ефектів після їжі. Принципова схема, що зображує активацію просвітницьких GPCR, експресованих на ентероендокринних клітинах, та їх фізіологічні функції зображено як Рисунок 1 .
Кілька GPCR, що сприймають поживні речовини, експресуються на апікальній мембрані L-клітин. Активація рецептора вивільняє GLP, опосередкований збільшенням внутрішньоклітинної концентрації кальцію ([Ca 2+] i). Смакові рецептори (гетеродимери TAS1R) поєднуються з α-густдуцином, тоді як рецептор жовчних кислот (GPBAR) поєднується з Gαi, посилюючи опосередкований TAS1R сигнал. Випущені GLP-1 і GLP-2 мають багато функцій, опосередкованих за допомогою різних рецепторів, експресованих на органах-мішенях, таких як кишкові нейрони та субепітеліальні міофібробласти.
Випуск GLP, пов’язаний із рецептором смаку
Три смакові рецептори - це GPCR, які поєднуються зі специфічним для смаку сигналом G-білка α – субодиниці α-густдуцин та/або α-трансдуцин, щоб регулювати реакцію кишечника на вміст просвіту за допомогою механізму хемосенсибілізації поживних речовин (рис. 1).
Рецептор солодкого смаку (TAS1R2/TAS1R3) є головним датчиком глюкози, важливим для регулювання толерантності до глюкози та впливу інсуліну. Густдуцин, TAS1R2 та TAS1R3, усі співіснувані на GL-клітинах, що продукують GLP-2, беруть участь у функціональній фізіологічній гормональній реакції на ліганди рецепторів солодкого смаку [13 *]. У нокаутованих мишей TAS1R3 Муровець та співавт. [14 *] повідомляв, що толерантність до глюкози була знижена, що супроводжувалося підвищеною резистентністю до інсуліну, що вказує на те, що цей компонент солодкого рецептора бере участь у шляхах, що сприймають цукор у кишечнику, ймовірно, при порушенні вивільнення GLP-1. Широке поширення TAS1R3, з великою кількістю, особливо в центральній нервовій системі та підшлунковій залозі, проте підтримує і позакишкові шляхи. Нові дані Ширазі-Бічі та ін. припускає, що окрім експресії в клітинах K, TAS1R2 і TAS1R3 спільно локалізуються з GLP-2 у L-клітинах, що підтверджується повідомленням про збільшення вивільнення GLP-1 та GLP-2 через активацію TAS1R2 та TAS1R3 [15 ** ].
Рецептор умами (TAS1R1/TAS1R3), асоційований з α-густдуцином і α-трансдуцином, активується представницьким лігандом умами глутамату натрію і алостерично посилюється монозидом монозиду фосфату, який активує місцеві функції кишечника. Висновки Кендіга та ін. припускають, що рецептори умами, які сильно експресуються в ентероендокринних клітинах товстої кишки, зокрема L-клітинах, прискорюють рух товстої кишки і перистальтичний рефлекс [16 *]. У передній кишці просвіт перфузії лігандів рецепторів умами збільшує вивільнення GLP-2, що збільшує швидкість секреції бікарбонату, встановленого механізму захисту слизової оболонки передньої кишки, що впливає на хемосенсибілізацію поживних речовин у посиленні механізмів захисту слизової оболонки [17]. Більше того, секреція бікарбонату через активацію рецептора умами рецептора, опосередкованого GLP-2, який послаблює пошкодження кишечника, спричинене NSAID, як повідомляють Inoue et al., Посилюється інгібуванням DPP-IV, що збільшує концентрацію циркулюючого GLP-2, зменшуючи його метаболізм [18].
Нарешті, рецептори гіркого смаку (TAS2R) існують у понад 25 різних підтипах, які присутні або в мономерних, або в гомо-мультимерних формах. Широке розмаїття рецепторів гіркого смаку, ймовірно, пов’язане з важливістю для організмів уникати токсинів, які, як правило, мають гіркий смак. Сила гіркого смаку безпосередньо корелює з тим, наскільки великий гомомультимер TAS2R [19 *]. Гіркі рецептори смаку експресуються в численних типах ентероендокринних клітин - жодне дослідження не змогло локалізувати їх до певного типу клітин in situ - з надзвичайно високою експресією в культивованих клітинних лініях на основі ентероендокринних клітин STC-1 та NCI-H716, обидва з яких також коекспресують α-густдуцин та GLP-1 [20 *, 21 *]. Α-субодиницею G-білка, зчепленого з рецепторами гіркого смаку, як рецептори солодкого та умами, також є α-густдуцин, який Kim et al. повідомляли про підвищення активності фосфоліпази С та зниження внутрішньоклітинних рівнів цАМФ, що призвело до підвищення рівня внутрішньоклітинного кальцію в організмі та вивільнення GLP-1 [21 *]. Цей спосіб вивільнення інкретину GLP-1 забезпечує основу для нових методів лікування діабету, в яких рецептор гіркого смаку служить молекулярною мішенню.
Рецептор жирних кислот (FFAR) - опосередкований випуск GLP
На додаток до смакових рецепторів, FFA нещодавно були залучені до важливих медіаторів вивільнення GLP (рис. 1). FFAs сильно експресуються на L-клітинах, що передбачає їх участь у вивільненні пептидів, отриманих проглюкагоном. Ліганди FFA1, такі як олеїнова кислота, активують активовану мітогеном протеїнкіназу/позаклітинну сигнально-регульовану кіназу (MAPK/ERK), щоб зберегти життєздатність щільних з’єднань в епітелії кишечника [22 *]. Міямото та ін. повідомляли, що GLP-2 впливає на функцію сполучних структурних білків zonula occludens (ZO) 1–3, окклюдин та клаудини через шлях MAPK/ERK для підвищення парацелюлярної стійкості до проникнення іонів та малих молекул, підвищення цілісності епітелію [ 22 *].
Експресія клубової кишки FFA1 та FFA4 була залучена до опосередкування вивільнення GLP-2 у пацієнтів із хворобою Крона [23 *], що є важливим, оскільки GLP-2 має протизапальну дію. Хоча активація FFAR1 збільшила вивільнення GLP-2, активований FFA4 фактор некрозу пухлини-запалювального медіатора (TNF), що послаблював корисні протизапальні ефекти вивільнення GLP-2, залежного від FFA1, вказуючи на механізм зворотного зв'язку для інгібування надлишку GLP-2 виробництво [23 *].
У дванадцятипалій кишці довголанцюгові FFAR FFA1 та коротколанцюгові FFAR FFA3 збільшують швидкість секреції бікарбонату епітелію через GLP-2-залежний механізм [24 **], додатково впливаючи на GLP-2 у цитозахисних механізмах. Танака та ін. повідомили, що інгібування DPP-IV у поєднанні з активацією FFA1 синергічно збільшує глюкозозалежне вивільнення інсуліну та концентрацію GLP-1 у плазмі [25 *], і Akiba et al. повідомляли про подібні результати за допомогою дуоденальної перфузійної системи [24 *]. Ці результати вказують на те, що FFA1 опосередковує випуск обох GLP, які підтримують цілісність кишечника. Більше того, Kawaguchi et al. повідомляв, що екзендін-4, стійкий до DPPIV аналог GLP-1, був надзвичайно ефективним засобом лікування стеатогепатиту на мишачих моделях [26 *], який додатково паралелює GLP-1 та GLP-2 як важливу молекулу в регуляції запалення, особливо в органи травлення. Незалежно від того, чи відбувається це за допомогою механізму хемосенсибілізації поживних речовин, опосередкованого рецептором жирних кислот, вивільнення GLP-1 та GLP-2 є важливими факторами, що впливають на захист слизової оболонки та контроль глікемії.
Рецептор жовчної кислоти (GPBAR)
Жовчні кислоти - це ендогенні метаболіти холестерину, що виділяються в просвіт дванадцятипалої кишки при концентраціях мМ у відповідь на прийом їжі. Селективний мембранно-зв’язаний GPCR, що називається GPBAR, експресується в L-клітинах. Пероральне додавання синтетичного агоніста GPBAR запобігало запаленню на моделі коліту миші за допомогою опосередкованого GLP-2 шляху [27 *]. На відміну від TASR та FFA, GPBAR поєднується з Gαs, активуючи внутрішньоклітинний білок cAMP-обміну, безпосередньо активований сигнальним шляхом cAMP (Epac), що передує вивільненню GLP [28,29 *], що може посилити вивільнення GLP, викликане глюкозою або L-глутаматом [28,30], що вказує на GPBAR у модуляції хіміосенсибілізації поживних речовин у L-клітинах (рис. 1). Оскільки GPBAR широко експресується у багатьох інших органах, таких як жовчний міхур, націлювання агоніста GPBAR на кишкові рецептори, ймовірно, буде необхідним для терапевтичного застосування нових агоністів [31 *].
ДЛП при поширених шлунково-кишкових розладах
Під час травлення вивільнення GLP-1 асоціюється із насиченням [32 *], по суті, діючи як механізм зворотного зв’язку для інгібування надмірного споживання їжі, через активацію центральних рецепторів ситості, присутніх у паравентрикулярних та дугоподібних ядрах гіпоталамуса. Нгуєн та ін. повідомили, що при патологічному ожирінні вивільнення GLP-1 у відповідь на внутрішньодуоденальну перфузію глюкози було зменшено, навіть незважаючи на те, що інсулін та викид іншого інкретину, глюкозозалежного інсулінотропного поліпептиду (GIP) збільшувались із наслідком гіперінсулінемії та гіперглікемії [33 *]. Ці результати свідчать про те, що основним дефектом, що лежить в основі захворюваності на ожиріння, може бути відсутність насичення після їжі через порушення вивільнення GLP-1.
Експресія рецептора GLP-2 (GLP-2R) в товстій кишці та клубовій кишці зменшується у пацієнтів із запальним захворюванням кишечника (IBD) [34 *]. Оскільки GLP-2 надає протизапальну дію, а також підвищує цілісність бар'єру слизової оболонки, як повідомляють Walker et al. [35 *], знижена експресія GLP-2R могла б частково пояснити спостережену знижену бар’єрну функцію та запалення при хворобі Крона та виразковому коліті [36]. Крім того, Pedersen et al. нещодавно повідомляли, що GLP-2R експресується не на епітелії кишечника, а навпаки, на кишкових нейронах на додаток до субепітеліальних міофібробластів [37 *], які були залучені до регуляції запалення при ВЗК [38 *].
Нещодавно Управління з контролю за продуктами та ліками США (FDA) затвердило стійкий до DPP-IV аналог телуглутиду GLP-2 для лікування кишкової недостатності. У клінічних випробуваннях тедуглутид переконливо покращував всмоктування кишкової рідини та електролітів [39,40 **]. У поросят з експериментальною кишковою недостатністю лікування тедуглютидом збільшувало загальну масу кишечника на довжину та швидкість синтезу білка в кишечнику, що відповідає трофічним функціям GLP-2 [41 *], завдяки вивільненню факторів росту, таких як фактор росту кератиноцитів (KGF) та інсуліноподібний фактор росту (IGF) із кишкових субепітеліальних міофібробластів, що експресують рецептори GLP-2 [42]. Хоча більша частина користі для тедуглутиду пояснюється його кишково-трофічним ефектом, його протизапальний та посилюючий бар'єр ефект може мати додаткову користь при терапії хронічних запальних станів, зазначивши, що тедуглутид не схвалений FDA для лікування запальних станів.
Штучні підсолоджувачі
Екзогенне введення аналога GLP-2, що має доведену користь при кишковій недостатності, може, як обговорювалося вище, мати додаткові переваги при ВЗК, функціональних захворюваннях кишечника (ФБД) та інших захворюваннях. Екзогенна аналогова терапія GLP-2 зазвичай потрібна протягом тривалого періоду і може бути досить дорогою. Хоча екзогенне введення аналога GLP-2 було ретельно вивчено, збільшення ендогенного вивільнення GLP-2 отримало набагато менше клінічної уваги. Одним практичним методом фізіологічного вивільнення ендогенного GLP-2 є проковтування лігандів для рецепторів, експресованих на апікальній мембрані L-клітин, які вивільняють GLP-2 при активації. У зв'язку з цим штучні підсолоджувачі, які є просто високоафінними лігандами для рецептора солодкого смаку (TASR1R2/3), вивільняють GLP-1 та GLP-2 [8,14 **], благотворно впливаючи на глікемічний контроль та на слизова кишечника. Оскільки штучні підсолоджувачі широко використовуються в клінічному застосуванні, і FDA визнає їх харчовими добавками, їх використання, не дозволене FDA, при цукровому діабеті, FBD та IBD заслуговує на подальші дослідження, хоча деякі епідеміологічні дослідження свідчать про те, що ці речовини можуть бути неефективними або навіть шкідливими [43 ].
Короткий зміст та майбутні напрямки
Механістична основа спостереження про те, що SCFA та інші поживні та неживні речовини в просвіті кишечника після їжі є кишечнотрофними, була розкрита нещодавніми експериментальними дослідженнями, в яких просвітні сполуки активують поживні хемосенсори, експресовані на L-клітинах. Цей специфічний тип клітин вивільняє трофічні гормони в портальну циркуляцію та лімфатичні засоби для активації рецепторів, експресованих на епітеліальних міофібробластах, які вивільняють фактори росту і таким чином активують рецептори, що експресують ентероцити, збільшуючи швидкість проліферації кишкових стовбурових клітин. Відкриття багатьох датчиків живильних поживних речовин забезпечило численні молекулярні мішені, на яких можуть базуватися нові терапії з низьким ризиком побічних ефектів при кишковій недостатності, цукровому діабеті, ожирінні, FBD та IBD.
Ключові моменти
Смакові рецептори (TASR) експресуються в шлунково-кишковому тракті та опосередковують вивільнення GLP
Вільні жирні кислоти (FFA), експресовані на L-клітинах, модулюють вивільнення GLP і діють як важливі регулятори хіміосенсибілізації поживних речовин.
Мембранний рецептор жовчних кислот (GPBAR), експресований на L-клітинах, змінює вивільнення GLP, що активується TASR і FFA.
Глюкагоноподібні пептиди (GLP) відповідають за підтримку цілісності та росту кишечника, а також засвоєння цукру
Подяка
Фінансова підтримка та спонсорство
Ця робота була підтримана науковими грантами Департаменту у справах ветеранів та Національного інституту охорони здоров'я.
Виноски
Конфлікт інтересів
- Вплив раннього ентерального харчування на моторику шлунково-кишкового тракту та бар’єр слизової оболонки кишечника
- Gale Academic OneFile - Документ - Механізми захворювання - це остеопороз, ожиріння кісток
- Розвиток механізмів ожиріння та фізіології - PubMed
- Генетичні зв'язки між дієтою та тривалістю життя спільні механізми від дріжджів до людей Nature Reviews
- Карта та діаграма котеджних продуктів - Фонд правового захисту від ферми до споживача