Кетогенна дієта: освітлення старої, але золотої біохімії
Питання: Які механізми регулюють кетогенез та пом'якшують його вплив на захворювання? На які умови безпосередньо впливають кетони та/або кетогенна дієта?
Винос: Кетогенез регулюється, прямо чи опосередковано, дією інсуліну. Кетогенна дієта має чіткі клінічні переваги при деяких рідкісних станах, що включають дефекти гліколітичних шляхів. Попередні дані також вказують, що це може бути корисним для пацієнтів з раком, нейродегенеративними захворюваннями та різними станами, пов'язаними із запаленням.
У цьому огляді 2019 року узагальнено основні механізми, що регулюють кетогенез, та проаналізовано вплив дієтичного кетозу на конкретні захворювання.
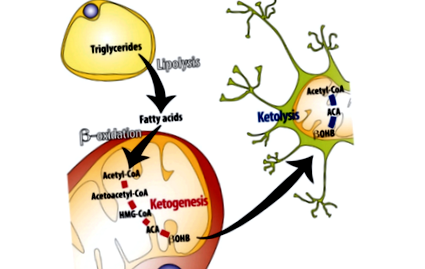
Кетогенез - тобто синтез кетонових тіл у печінці - в основному зумовлений тривалим пригніченням рівня інсуліну (1). Протягом перших годин голодування або під час дієти з дуже низьким вмістом вуглеводів запаси глюкози в печінці та м’язах викидаються в кров для підтримки рівня глюкози в крові. Як тільки ці запаси вичерпаються, жирові кислоти виділяються з жирової тканини. Коли ці жирні кислоти досягають печінки, вони піддаються бета-окисленню і утворюють ацетил-КоА. Коли рівні ацетил-КоА стають досить високими, печінка починає виробляти кетонові тіла (КБ) у значних кількостях (2). Потім ці циркулюючі кетонові тіла поглинаються іншими клітинами та органами через монокарбоксилатний транспортер 1 (MCT1), де потім перетворюються назад в ацетил-КоА для використання в якості джерела енергії (3).
Рисунок 1: Короткий огляд ключових процесів, що регулюють кетогенез
Таким чином, кетогенез в основному регулюється доступністю жирних кислот у печінці. Лише за допомогою цього механізму кетогенез пригнічується навіть помірним підвищенням рівня інсуліну, що зміщує жирові клітини від розпаду жирових кислот та їх викиду у бік накопичення жирних кислот, зменшуючи приплив жирних кислот у клітини печінки (4). Інсулін одночасно пригнічує кетоз шляхом прямого регуляторного впливу на клітини печінки, включаючи підвищення рівня малоніл-КоА, що зменшує доступність ключового кетогенного проміжного продукту (ацил-КоА) у мітохондріях печінки, інгібуючи тим самим кетогенез (5).
Рисунок 2: Регулювання кетогенезу за допомогою інсуліну. Червоні стрілки вказують на процеси, які регулюються або вимикаються за кожної обставини. Інсулін, впливаючи на вироблення малоніл-КоА, пригнічує доступність ацил-КоА у мітохондріях печінки, що, в свою чергу, пригнічує кетогенез.
Кетогенна дієта (КД) - тобто дієта, що індукує кетоз, як правило, за рахунок різкого придушення споживання вуглеводів - має чітку і специфічну клінічну корисність для двох станів, які характеризуються дефектами гліколітичних шляхів. Синдром дефіциту GLUT1 (GLUT1 DS) погіршує транспорт глюкози через гематоенцефалічний бар’єр і призводить до низького рівня глюкози в спинномозковій рідині. Симптоми включають судоми, порушення руху та когнітивні дисфункції. Кетогенна дієта швидко усуває ці симптоми; рекомендується пацієнтам із цим генетичним захворюванням починати КД якомога швидше після встановлення діагнозу, щоб запобігти тривалому пошкодженню мозку (6). Синдром дефіциту піруват-дегідрогенази (PDH-DS) подібний тим, що кетогенна дієта пом'якшує симптоми, обходячи патології, пов'язані з центральними гліколітичними шляхами (7). Добре задокументовані переваги кетогенної дієти у пацієнтів із стійкими до наркотиків нападами можуть виникати за подібними механізмами (8), хоча в цих випадках КД, як правило, підтримується поряд з протиепілептичними препаратами.
У цих та подібних умовах КД зміщує клітинний метаболізм від гліколізу. На KD 90% енергії отримується з жиру і лише 10% з вуглеводів та білків, зменшуючи як потребу, так і потенціал для гліколізу. Наприклад, судоми характеризуються високим рівнем гліколітичності; кетогенна дієта пригнічує гліколіз і тим самим зменшує ризик судом (9). КД також можуть мати більш прямі, вторинні переваги за цих станів, зберігаючи енергетичний гомеостаз нейронів та здоров'я мітохондрій. Низький рівень нейронального АТФ підвищує збудливість нейронів за рахунок впливу (відсутності) АТФ на калієві канали (10); кетогенні дієти підтримують підвищений рівень АТФ у клітинах, особливо в контексті гліколітичної дисфункції. КД одночасно знижують вироблення активних форм кисню (АФК) клітинними мітохондріями та сприяють біогенезу мітохондрій у нейронах (11). Ці та інші ефекти на конкретні молекули, такі як аденозин та окремі жирні кислоти, можуть додатково пояснити переваги кетогенної дієти для запобігання та контролю нападів (12).
На периферії кетонові тіла протизапальні завдяки інгібуванню NLRP3 (13). Дослідження на тваринах надали попередні докази, що кетогенна дієта може запобігти або зменшити тяжкість захворювань, безпосередньо пов’язаних із запаленням, таких як подагра та артрит (14). Ці самі наслідки призвели до припущення, що кетогенна дієта може управляти хронічним низькоякісним запальним станом, пов'язаним із серцево-судинними захворюваннями, таким чином зменшуючи ризик серцевих захворювань (15).
Роль кетогенної дієти у лікуванні та профілактиці раку широко обговорювалася на CrossFit.com (16). Теоретично кетогенна дієта використовує ефект Варбурга, позбавляючи залежні від гліколізу ракові клітини основного джерела палива, не завдаючи шкоди здоровим клітинам. Однак принаймні деякі ракові клітини можуть використовувати кетонові тіла як паливо, анулюючи цей ефект. Тим не менше, сучасні дані свідчать про те, що КД постійно покращує якість життя онкологічних хворих і, зокрема, зменшує шлунково-кишкові та неврологічні побічні ефекти існуючих методів лікування раку (17). Використання кетогенної дієти як допоміжного засобу для хіміотерапії, променевої терапії та інших методів лікування раку і надалі залишатиметься предметом дослідження.
Рисунок 3: Гіпотетичні механізми, за допомогою яких кетогенна дієта погіршує ріст пухлини
Ранні дані свідчать про те, що кетогенна дієта (або штучне підвищення рівня кетонів у сироватці крові за допомогою кетонових добавок) може тимчасово відновити когнітивні функції у пацієнтів на ранніх стадіях нейродегенеративного захворювання (18). Автори цього огляду стверджують, що принаймні деякі випадки хвороби Альцгеймера мають метаболічний характер, тому кетогенна дієта, підтримуючи тривале підтримання нейронального енергетичного гомеостазу, може запобігти і навіть змінити нейродегенерацію. Однак даних на підтримку цієї теорії мало. Подібним чином попередні дані свідчать, що кетогенна дієта може покращити немоторні симптоми у пацієнтів із хворобою Паркінсона (19). З огляду на те, що нинішні стандарти медичної допомоги (L-DOPA) ці симптоми погано розглядають, КД розглядається як перспективна допоміжна терапія для пацієнтів із хворобою Паркінсона.
KD також пропонується для лікування жирової хвороби печінки, оскільки обмеження вуглеводів, пов’язане з KD, призводить до швидкого очищення запасів жиру в печінці (20). Примітно, що використання КД для лікування НАЖХП може призвести до доброчесного циклу, оскільки печінка без жиру здатна швидше ініціювати кетоз у відповідь на пригнічення інсуліну, ніж жирна печінка.
Мінімальні дані, в основному отримані від дітей, припускають, що тривале дотримання КД може бути пов'язане з підвищеним ризиком переломів, каменів у нирках та затримкою росту (21). Однак ці самі дані свідчать про те, що ці побічні ефекти можуть бути наслідком погано побудованих кетогенних дієт, що призводять до дефіциту вітаміну D та подібних станів, і можуть бути не властивими самому харчуванню.
Загалом, цей огляд пропонує докази, що підтверджують використання КД при різних запальних станах, раку та неврологічних розладах. Дослідження, що вивчають кетогенну дієту, залишаються обмеженими, але КД залишається перспективним варіантом для станів, в яких вагу відіграють дефекти гліколізу, клітинний енергетичний гомеостаз або запалення.
- Вплив кетогенної дієти на силу та силу
- Опис кетогенної дієти іспанською мовою Descripción de la Dieta Ketogénica en Español Epilepsy
- Клінічні проблеми Кетогенна дієта невизначеної безпеки для здоров'я серця MedPage сьогодні
- Фітнес-інструктор Павло Цацулін любить CrossFit, пояснює дієту Джо Рогану; Фітнес Вольт
- Не починайте іншої дієти, поки не прочитаєте це; Дай мені CrossFit