Інгібування ЦОГ-2 послаблює анорексію під час системного запалення, не порушуючи вироблення цитокінів
1 Кафедри педіатрії, молекулярної біології та фармакології та акушерства та гінекології, Медична школа Вашингтонського університету та Дитяча лікарня Сент-Луїса, Сент-Луїс, штат Міссурі 63110
1 Кафедри педіатрії, молекулярної біології та фармакології та акушерства та гінекології, Медична школа Вашингтонського університету та Дитяча лікарня Сент-Луїса, Сент-Луїс, штат Міссурі 63110
1 Кафедри педіатрії, молекулярної біології та фармакології та акушерства та гінекології, Медична школа Вашингтонського університету та Дитяча лікарня Сент-Луїса, Сент-Луїс, штат Міссурі 63110
1 Кафедри педіатрії, молекулярної біології та фармакології та акушерства та гінекології, Медична школа Вашингтонського університету та Дитяча лікарня Сент-Луїса, Сент-Луїс, штат Міссурі 63110
Анотація
Анорексія та втрата ваги є частими ускладненнями гострих та хронічних інфекцій та є наслідком індукції цитокінів, простагландинів та інших медіаторів запалення, які мають вирішальне значення для елімінації патогенів. Вибіркове послаблення гіпофагічної реакції на інфекцію та підтримка виробництва факторів, необхідних для боротьби з інфекцією, є корисним доповненням до антимікробної терапії при лікуванні захворювань людини. Тут ми оцінюємо відносний внесок циклооксигенази (ЦОГ) -1- та ЦОГ-2 простагландинів у анорексію та втрату ваги, спричинену системною імунною активацією ліпополісахаридом (ЛПС). Використовуючи селективні фармакологічні інгібітори COX та мишей, що нокаутують гени, ми виявили, що інгібування COX-2 під час індукованого LPS запалення призводить до збереження споживання їжі та підтримання ваги тіла, тоді як інгібування COX-1 призводить до посиленої та тривалої втрати ваги. Регуляція нейропептиду Y, кортикотропін-вивільняючого гормону, лептину та інтерлейкіну-6 не змінюється як функція інгібування ЦОГ-2 після введення ЛПС. Наші дані свідчать про інгібування ЦОГ-2 як про терапевтичну мішень для підтримки харчового статусу, забезпечуючи при цьому нормальну реакцію цитокінів під час інфекції.
активація імунної системи під час гострих бактеріальних або вірусних інфекцій призводить до генерації цитокінів та інших медіаторів запалення, які є важливими для контролю інфекції. Ці медіатори запалення призводять до хемотаксису та активації одноядерних клітин та місцевих змін у кровотоці та проникності судин, що сприяють викоріненню патогенів. На додаток до цих сприятливих дій, фактори, індуковані під час інфекції або іншого системного запалення, також виявляють шкідливі дії. Одним із важливих наслідків запалення є анорексія, що супроводжується гострою втратою ваги (17, 19, 37). При важкій або тривалій інфекції чи запаленні ці зміни в харчуванні можуть негативно вплинути на вирішення інфекції, загоєння ран та ріст. Здатність вибірково пригнічувати аноректичну реакцію, зберігаючи дії медіаторів запалення, необхідних для елімінації збудника, була б дуже корисним доповненням до антимікробної терапії інфекції.
Ліпополісахарид (ЛПС), основний компонент зовнішньої клітинної стінки грамнегативних бактерій, широко використовується як модель для гострого сепсису. Подібно до бактеріальної інфекції, введення ЛПС призводить до лихоманки, стійкого вироблення цитокінів та анорексії у гризунів (20, 30). Інгібування вироблення або дії цитокінів після LPS, зокрема фактора некрозу пухлини (TNF) -α та інтерлейкіну (IL) -1β, послаблює анорексію, спричинену LPS (29, 30). Однак гальмування цих проксимальних медіаторів запального каскаду могло б поставити під загрозу виживання в умовах живого, реплікаційного патогена, як передбачається підвищеною сприйнятливістю мишей до генетичного дефіциту рецептора TNF 1 (31), IL-6 (14 ) та інтерферон-γ (6) до інфекції бактеріальними агентами, такими як Listeria monocytogenes.
Також було показано, що інгібування продукції простагландинів послаблює аноректичну реакцію на LPS або IL-1β (18, 33), але механізм, за допомогою якого це відбувається, та наслідки для генерування захисної запальної реакції залишаються незрозумілими. Перший здійснений етап синтезу простагландинів, каталізований синтазами простагландину Н або циклооксигеназами, послужив важливою терапевтичною мішенню для лікування запальних захворювань (36). Нещодавно розроблені нестероїдні протизапальні препарати (НПЗЗ) здатні селективно пригнічувати функцію однієї з двох ізоформ циклооксигенази (ЦОГ), ЦОГ-1 або ЦОГ-2 (21, 22, 36). Поліпшення розуміння фізіологічної ролі цих ізоформ ЦОГ дозволить нові застосування ЦОГ-селективних препаратів із меншою кількістю несприятливих наслідків, таких як гастрит та нефротоксичність, ніж неселективні інгібітори.
У цьому дослідженні ми перевіряємо гіпотезу про те, що селективне інгібування ЦОГ буде ефективним для послаблення аноректичної відповіді, що супроводжує активацію імунної системи, не змінюючи реакції цитокінів або надниркових залоз. За допомогою ЦОГ-1- та ЦОГ-2-селективних фармакологічних засобів та мишей-нокаутів ми визначимо відносний внесок кожної ізоформи у викликану запаленням анорексію.
Утримання тварин.
Миші дикого типу (WT), COX-1 з дефіцитом (KO) (16) та COX-2 KO (26) були розміщені на 12: 12-годинному циклі світло-темно з необмеженим доступом до чау гризунів, якщо тільки вказано інше. Для досліджень фармакологічних інгібіторів оцінювали самців мишей C3H/HeN (Harlan Sprague Dawley, Indianapolis, IN) віком 10–12 тижнів (11, 34). Самці мишей COX-1 і COX-2 KO, оцінені у віці 8–14 тижнів, були безпородними фоном C57BL/6 × 129, підтримуваними жіночими паруваннями самців KO × гетерозиготи KO для алелів COX-1 KO та гетерозигот × гетерозигот. для алелю COX-2 KO. Контрольними мишами, позначеними як “WT” для експериментів з COX KO, були WT та гетерозиготні посліди, що виникали з гетерозиготних спарювань COX-2. Всі протоколи мишей відповідали керівництву Національного інституту охорони здоров’я (NIH) та затверджені Комітетом з догляду за тваринами та використання медичної школи Вашингтонського університету.
LPS-індукована анорексія.
Вимірювання плазми кортикостерону, лептину, глюкози та IL-6.
Плазму для вимірювання кортикостерону, лептину, глюкози та IL-6 отримували від одиночно розміщених самців мишей C3H/HeN (n = 3–5 на групу) шляхом швидкої ретроорбітальної флеботомії в гепаринізовані капілярні трубки із загальним часом від першого поводження з твариною до завершення кровотечі не більше 30 с. Базова лініят = 0 зразка було отримано при 1000 у мишей, що годувались лібітом У 1400 мишам вводили транспортний засіб або SC-236 через гель, а їжу виймали з клітки на решту експерименту. Мишам проводили внутрішньочеревну ін'єкцію транспортного засобу або ЛПС через 30 хв після обробки носієм або SC-236. Потім додаткові зразки крові відбирали через 3 та 16 год після ін’єкції LPS у тварин, що голодували. Кров збирали на льоду, плазму відокремлювали центрифугуванням і зберігали при -80 ° С до аналізу. Концентрацію кортикостерону в плазмі (ICN Biomedicals, Коста-Меса, Каліфорнія) визначали методом радіоімунологічного аналізу, як описано раніше (3, 13). Концентрації IL-6 у плазмі (Фармінген, Сан-Дієго, Каліфорнія) та лептину (R & D Systems, Міннеаполіс, Міннесота) вимірювали методом ІФА згідно з інструкціями виробника. Концентрацію глюкози в плазмі крові вимірювали на аналізаторі глюкози в крові HemoCue (HemoCue, Mission Viejo, Каліфорнія).
Гіпоталамічна гібридизація мРНК in situ.
Статистичні методи.
Усі результати виражаються як середні значення ± SE. Статистичний аналіз проводив ANOVA, с P ≤ 0,05 вважається значущим.
Рис. 1.Фармакологічне пригнічення синтезу простагландинів послаблює схуднення, спричинене ліпополісахаридами (ЛПС). A: зміна маси тіла після введення транспортного засобу (n = 7), індометацин (індо, n = 4), або інгібітори селективної ізоформ циклооксигенази (ЦОГ) (n = 4–5) без введення ЛПС. B: зміна маси тіла після введення транспортного засобу (n = 11), індо (n = 5), або селективними інгібіторами ЦОГ (n = 10–12) з адмініструванням ЛПС. Статистично значущі зміни: день (d) 1, P
Для подальшого підтвердження диференціальної дії COX-1- проти похідних COX-2 простагландинів на втрату ваги після системної імунної активації, ми оцінили мишей WT, COX-1 та COX-2 KO після введення LPS. Для цих експериментів використовували самок мишей, оскільки миші-самці COX-2 KO мають ранню смертність (26), що виключає отримання достатньої кількості здорових дорослих чоловіків COX-2 KO для наших досліджень. Відповідно до вищезазначених експериментів із використанням селективних інгібіторів COX, миші COX-2 KO продемонстрували значно меншу втрату ваги, ніж миші COX-1 KO через 1 день після введення LPS (P 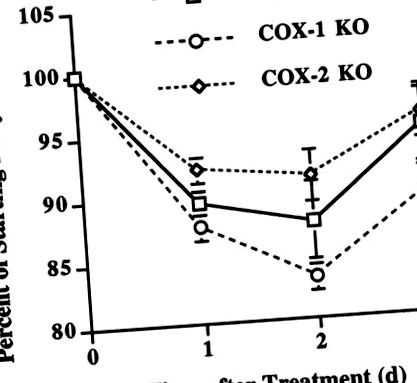
Рис.2.Генетичне пригнічення синтезу простагландинів послаблює LPS-індуковану втрату ваги. Миші з нокаутом COX-2 (KO) мали тенденцію до меншої втрати ваги, ніж миші дикого типу (WT) через 1 день після введення LPS (P = 0,08) і значно менша втрата ваги, ніж миші COX-1 KO на 1 день (P
Зміни в споживанні енергії або використанні енергії можуть сприяти зменшенню втрати ваги, пов’язаному із селективним інгібуванням або дефіцитом ЦОГ-2. Для оцінки ефекту інгібування ЦОГ-2 на апетит ми вимірювали споживання їжі у мишей, які отримували ЛПС, з або без одночасного інгібування ЦОГ-2 за допомогою SC-236 (рис.3A). Введення лише ЛПС призвело до зменшення споживання їжі на 60% порівняно з мишами, які отримували носій, протягом 24 годин після індукції системної активації імунної системи. Навпаки, введення SC-236 тваринам, які отримували ЛПС, послаблювало гіпофагічну реакцію, причому споживання їжі зростало на 50% порівняно з мишами, які отримували лише ЛПС. Відповідно до зменшення втрати ваги після ЛПС, SC-236 послаблював, але не повністю блокував гіпофагічну реакцію. На підтвердження спостереження, що ефект SC-236 на зменшення втрати ваги залежить від підтримання споживання їжі, а не від змін у використанні енергії, миші, яких обробляли транспортним засобом або SC-236, а потім голодували протягом 16 годин після введення LPS однакова втрата ваги (рис. 3B).
Рис.3.Змінюються апетит та швидкість метаболізму після введення ЛПС з інгібуванням ЦОГ-2. A: споживання їжі протягом 24 годин після введення ЛПС. *P
Підтримання маси тіла, споживання їжі та загального харчового статусу в умовах гострої бактеріальної інфекції або хронічних запальних захворювань мало б значну користь для здоров’я. Однак, якщо підтримка споживання їжі та маси тіла після ЛПС сталася наслідком пригнічення реакції цитокінів на запалення, здатність організму боротися з інфекцією та не піддаватися сепсису може бути порушена. Щоб визначити наслідки пригнічення ЦОГ-2 на продукцію цитокінів, ми вимірювали концентрацію IL-6 у плазмі крові після введення LPS. Нормальна продукція IL-6 у відповідь на LPS вимагає попередньої індукції як TNF-α, так і IL-1β, а IL-6 залишається підвищеним протягом тривалого періоду, забезпечуючи корисний маркер для інтеграції відповіді цитокінів (1, 31, 40 ). Як і слід було очікувати, IL-6 різко зріс після введення LPS (рис. 4A). Введення SC-236 спільно з LPS не призвело до зміни величини ранньої індукції IL-6, виміряної через 3 години після LPS, або до стійкого збільшення IL-6 через 16 годин після LPS.
Рис.4.Індукція гормону плазми після введення ЛПС.A: вимірювання інтерлейкіну в плазмі (ІЛ) -6 після введення ЛПС (n = 3–5 на групу).Час 0 а концентрація IL-6 на носії/носії була нижчою за межу виявлення в аналізі 0,1 нг/мл. B: вимірювання кортикостерону в плазмі крові після введення ЛПС (n= 4–5 на групу). *P
Як додатковий доказ того, що відносна специфічність наслідків інгібування ЦОГ-2 після ЛПС була скоріше на гіпофагічну відповідь, а не на загальну цитокінову та запальну реакцію, ми оцінили активність осі гіпоталамус-гіпофіз-наднирники. Стимуляція виділення глюкокортикоїдів надниркових залоз під час запалення відображає дії цитокінів на центральну нервову систему, гіпофіз та ділянки надниркових залоз та забезпечує корисну комплексну міру стимуляції та загасання запальної реакції (3, 5, 23, 38). Введення ЛПС призвело до помітного підвищення концентрації кортикостерону в плазмі крові через 3 год, що підтримувалось через 16 год після введення (рис. 4B). Невелике збільшення плазмового кортикостерону спостерігалося на 3-ій годині у мишей, які не отримували ЛПС, оскільки цей момент часу збігався з нормальним циркадним піком у виробництві глюкокортикоїдів. Не було різниці у величині або тривалості активації надниркових залоз у тих мишей, які отримували LPS та SC-236. Відповідно до стійкого збільшення виходу глюкокортикоїдів надниркових залоз після LPS, мРНК CRH у паравентрикулярному ядрі гіпоталамуса була підвищена приблизно втричі як у групах LPS, так і у SC-236/LPS (рис. 5).
Рис.5.Аналіз гібридизації in situ гіпоталамічного кортикотропін-рилізинг-гормону (CRH) та нейропептиду Y (NPY).A: репрезентативні авторадіограми корональних зрізів через паравентрикулярне ядро гіпоталамусу (pvn) для CRH та дугоподібне ядро (дугу) для виявлення мРНК NPY. Зображення з малим збільшенням цілих корональних зрізів (ліві панелі для кожного зонда) та зображення великого збільшення паравентрикулярних або дугоподібних ядер для гібридизації CRH та NPY відповідно (панелі, розташовані справа для кожного зонда). Центральне ядро мигдалини (am) також демонструє гібридизацію мРНК CRH. V, транспортний засіб. B: кількісний денситометричний аналіз CRH та NPY in situ авторадіограм (n = 3 на групу). *P
Щоб визначити, чи генерувані ЦОГ-2 простагландини мали прямий вплив на апетит чи впливали опосередковано на центри апетиту за допомогою модуляції нейропептидів або інших молекул, ми вимірювали мРНК NPY в дугоподібному ядрі гіпоталамуса та концентрації лептину в сироватці крові. Незважаючи на підвищений рівень цитокінів та індукцію анорексичного нейропептиду CRH (7), рівень NPY не відрізнявся у мишей, які отримували або не отримували LPS (рис. 5). На відміну від цього, концентрація лептину в сироватці крові збільшувалася введенням ЛПС (рис. 4C.), що узгоджується з попередніми звітами (2, 12). Величина індукції лептину не відрізнялася між групами носія/LPS та SC-236/LPS. Глюкоза в плазмі зменшилась у відповідь на введення ЛПС, але ця гіпоглікемічна відповідь не відрізнялася між групами носія/ЛПС та SC-236/ЛПС (рис. 4D).
Дані, представлені в цьому дослідженні, демонструють, що селективна фармакологічна або генетична блокада простагландинів, генерованих ЦОГ-2, ефективно послаблює гіпофагічну реакцію на системне запалення, викликане ЛПС. На відміну від інших засобів, що послаблюють викликану запаленням анорексію, таких як інгібітор фосфодіестерази пентоксифілін, блокатори кальцієвих каналів та глюкокортикоїди, які блокують проксимальні події у відповідь на LPS (17, 18, 30), селективні до ЦОГ-2 препарати зменшують анорексію без зменшення відповідь цитокінів. Попередні дослідження продемонстрували, що НПЗЗ можуть насправді збільшувати, а не зменшувати проксимальні події у відповідь під час запалення, такі як індукція TNF-α (25), і наші дані розширюють цей аналіз, демонструючи відсутність середньо- та довгострокового зменшення Виробництво Іл-6. Оскільки ми виявили, що інгібування ЦОГ-2 не змінює експресію анорексичних нейропептидів, таких як CRH, орексичних нейропептидів, таких як NPY, або лептин після введення ЛПС, генеровані ЦОГ-2 простагландини, ймовірно, безпосередньо модулюють центральні центри апетиту. Крім того, COX-2 все ще може побічно модулювати апетит, діючи на один із декількох нейропептидних шляхів, які не оцінювались у цьому дослідженні.
Ми вдячні доктору Скотту Морхаму за надання мишей COX-1 KO та COX-2 KO, Monsanto-Pharmacia за надання SC-236 та SC-560, Основній лабораторії досліджень та навчання діабету для вимірювання лептину та докторам. Дж. Гітлін, Д. Рудник та К. Бетін для перегляду рукописів.
СНОПКИ
Цю роботу підтримали гранти Програми біомедичних досліджень університету Монсанто-Фармація/Вашингтон та Програма Маршу Даймса (для Л. Дж. Муглії) та Національний інститут охорони здоров’я, підготовка грантів 5 T32 HD-07507 (для П. М. Джонсона).
Адреса для запитів на передрук та іншої кореспонденції: L. J. Muglia, Washington Univ. Медична школа, 660 пр. Евкліда, коробка 8208, Сент-Луїс, Міссурі 63110 (електронна пошта: [електронна пошта захищена] wustl. Edu).
- Екстремальна ахалазія, що представляється як нервова анорексія
- Від анорексії до булімії до одужання, особистий рахунок про недосконалу подорож Марії Мутіа
- Порушення харчової поведінки Anorexia nervosa (самоголодування; гіпотрофія; екстремальна втрата ваги)
- Боріться із запаленням цим куркумою та лимонним ранковим еліксиром
- Жінки-спортсменки, яким багато чого втрачати здоров’я, стають прихованими напастями анорексії та булімії