Гомогенат перепелиних яєць полегшує еозинофільний езофагіт, спричинений харчовою алергією, шляхом модуляції шляху трансдукції PAR-2 у мишей, сенсибілізованих арахісом
Прісцилія Лянто
1 Пекінський передовий інноваційний центр харчового харчування та здоров'я людини, Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Шивен Хань
1 Пекінський передовий інноваційний центр харчового харчування та здоров'я людини, Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Сінруй Лі
2 Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Фредрік Оньянго Огуту
3 Відділ харчових технологій Кенійського інституту промислових досліджень та розробок, Південь С - Попо Rd., Оф Момбаса Rd., 30650–00100 Найробі, Кенія
Яні Чжан
2 Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Чжуоян Вентилятор
2 Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Хуйліан Че
1 Пекінський передовий інноваційний центр харчового харчування та здоров'я людини, Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін, 100083 р. Китай
Анотація
Вступ
Еозинофільний езофагіт (ЕоЕ) - це хронічне запальне захворювання, пов’язане з харчовою алергією 1 - 3, яке серйозно впливає на нормальне життя пацієнта. Це захворювання проявляється в стравоході пацієнта, який характеризується нескінченним запальним станом. У західних країнах поширеність EoE різко зросла з 10 до 50 на кожні 100 000 загальної популяції 4. Тим часом, хоча опубліковані звіти про EoE з країн Азії обмежені. Кіношита та ін. провела нещодавній систематичний огляд літератури про EoE в країнах Азії, який виявив порівняльний патогенез захворювання EoE серед пацієнтів із Заходу та Азії 5. Поширеність EoE в азіатських країнах становить майже 17–6557 на 100 000 розслідуваних випадків ендоскопії, представляючи широкий діапазон, який потенційно може бути пов’язаний із неявним упередженням дослідження як ефект від використання невеликого обсягу вибірки та/або різних форм показань до ендоскопії. Незважаючи на те, що показники поширеності EoE в азіатській популяції були дуже різними, характеристика патогенезу хвороби EoE була подібною до тієї, що була виявлена в західній популяції. По суті, EoE зараз виявилося серйозними захворюваннями не тільки в західних країнах, але і в Азії 5 .
На сьогодні основна фармакотерапія ЕоЕ принципово залежить від інгаляційних кортикостероїдів. Незважаючи на те, що місцеві прийом місцевих стероїдів може успішно стримувати запалення, пов'язане з ЕоЕ, є занепокоєння щодо тривалого використання стероїдів, наприклад, ротоглотки, кандидозу стравоходу, порушення мінеральної щільності кісток, глаукоми, гіперглікемії, та інші антагоністичні впливи 2, 6 - 8. Існує нагальна потреба у пошуку та створенні нових та потужних протизапальних препаратів для EoE.
У попередньому дослідженні було виявлено, що перепелине яйце відрізняється від інших пташиних яєць. Різниця полягає особливо в його яєчному білку, перепелине яйце багатше білками, що мають протиалергічну та протизапальну дію 9. Дослідження in vitro показали, що перепелине яйце містить овокоїд та овоінгібітор, які можуть полегшити алергічні реакції, блокуючи зв'язування триптази або будь-якого іншого гомолога трипсину та активованого протеазами рецептора 2 (PAR-2) 10. Більше того, патент на роль перепелиного яйця в модуляції функції імунних клітин, особливо еозинофілів та нейтрофілів, у лікуванні алергії був виданий в 2015 році Сполученими Штатами (номер патенту: US2015/0057232A1) 11, даючи міцні основи особлива роль перепелиних яєць.
Роль перепелиного яйця була визначена в контексті лікування алергічних астматиків 12, 13 та риніту 14, але не при харчовій алергії, особливо про його роль у лікуванні харчової алергії, спричиненої хворобою типу EoE, раніше не повідомлялося. Тому в цьому дослідженні використано мишачу модель збудника алергії, спричиненого арахісом, для вивчення протизапальної та протиалергічної дії перепелиного яйця та його механізму лікування харчової алергії.
Результати
Пероральне лікування перепелиних яєць полегшило симптоми EoE-подібної харчової алергії у мишей Balb/c
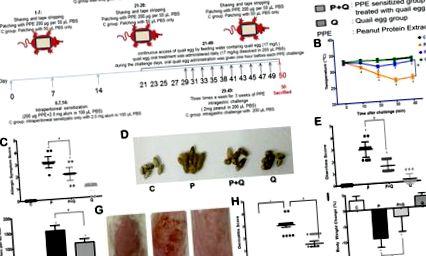
На виникнення харчової алергії зазвичай вказують системні та місцеві алергічні симптоми та/або ознаки 15. Для того, щоб визначити, чи може перепелине яйце полегшити харчову алергію, спричинену симптомами хвороби EoE, ми провели спостереження щодо системних (температура тіла та реакція гіперчутливості) та місцевих алергічних реакцій (діарея, поведінка подряпин, дерматит та втрата маси тіла) мишей протягом 40 хв після шкірного або внутрішньошлункового ураження. Протокол арахісових алергенів, індукованих EoE-подібною хворобою на мишачих моделях, описаний на рис. 1А .
Пероральна обробка перепелиних яєць знижувала рівень PPE специфічних IgE, IgG1 та медіаторів алергії
Алергенспецифічні IgE та IgG1 належать до антитіл типу Th2 типу 16, вони можуть відображати імунний стан організму. Близько 80% значної кількості антитіл в організмі становить IgG, а слідова кількість - IgE 17. У зв'язку з тим, що перепелине яйце може також дозволити організму виробляти специфічні антитіла, ми провели аналіз рівня специфічних IgE та IgG1 арахісових та перепелиних яєць. Як показано на рис. 2А, на початку виклику ЗІЗ (день 28) рівень специфічного для ЗІЗ IgE у групі P був значно підвищений порівняно з контрольною групою (P # P 2B, під час фази сенсибілізації (день 28), Група P показала високий рівень PPE-специфічного IgG1, високий рівень IgG1 тривав до кінця експерименту (P 2B вказував, що хоча щоденна пероральна обробка перепелиних яєць могла інгібувати вироблення PPE-специфічного IgG1, оральна терапія перепелів була лише на з іншого боку, здатний стимулювати вироблення специфічного IgG1 для перепелиних яєць у групі P + Q, що відповідало збільшенню специфічного IgE для перепелиних яєць, виявленому на 35-й день. Ці висновки вказували на те, що екстракт арахісового білка та перепелине яйце разом могли реагувати на два антигенних джерела у групі мишей P + Q.
Тучні клітини та активація еозинофілів відіграють важливу роль в алергічних реакціях 18, 19. Тому для того, щоб визначити ступінь активації тучних клітин та еозинофілів у експериментальних мишей, ми провели аналіз алергічних медіаторів, що виділяються в сироватці крові, а також рівні гістаміну, триптази та катіонного білка еозинофілів (ECP) (рис. 2C-E). Порівняно з контролем (група С), ці три алергічні медіатори значно збільшились у групі Р, тоді як лікування пероральним перепелиним яйцем (група Р + Q) могло суттєво пригнічувати вивільнення цих трьох медіаторів (Р 20. Еозинофіли є центральними ефекторними клітинами при алергії, яка збільшує алергічну інфляцію 20, гістамін є ефекторними молекулами, що виділяються під час алергенної відповіді, два є ключовими компонентами алергічної відповіді, де їх кількість збільшується, але коли модулюється алергія, їх кількість зменшується 20 .
Пероральне лікування перепелиних яєць зменшує клітини селезінки, що виділяють пов'язані з EoE цитокіни
Пероральне лікування перепелиних яєць зменшувало клітини селезінки, що виділяли пов'язані з EoE цитокіни (n = 5). Th2 цитокіни (A) IL-4, (B) IL5, (C.) Іл-13; цитокіни iNKT (D) Іл-15; Атопічний дерматит, пов’язаний з цитокінами (E) TSLP; Алергічні негативні регулятори (F) Іл-10. Результати виражаються як середнє значення ± SEM. * P # P 2, 21, 22. Нещодавнє дослідження хвороби EoE, спричинене харчовою алергією на тваринах, показало, що оральний арахісовий алерген може сприяти накопиченню інфільтрації еозинофілів у стравоході, легенях та тонкому кишечнику 21. Тому ми провели подальший аналіз для визначення ефекту лікування пероральних перепелів на модулюючу інфільтрацію еозинофілів під час прогресування захворювання EoE.
По-перше, кількість інфільтрації еозинофілів у стравоході, легені та тонкому кишечнику підраховували при великому збільшенні. Результати показали значне збільшення кількості еозинофілів у трьох запалених тканинах групи P (P 2, легені: (11,60 ± 1,70) × 10 2, тонка кишка: (9,34 ± 1,96) × 10 2 на мм 2 тканинних шарів) . Пероральна обробка перепелиних яєць значно зменшила кількість інфільтрації еозинофілів, як це спостерігалося у групі P + Q (P 2, легені: (6,62 ± 1,46) × 10 2, тонка кишка: (6,05 ± 0,48) × 10 2 на мм 2 тканинних шарів) тоді як лікування перепелиних яєць без сенсибілізованих ЗІЗ мишей (група Q), за винятком тонкої кишки ((5,87 ± 0,95) × 10 2 на мм2 тканинних шарів), не показало збільшення кількості еозинофілів порівняно з кількістю інфільтрації еозинофілів у тонкому кишечнику контрольної групи ((5,688 ± 1,34) × 10 2 на мм 2 тканинних шарів) (рис. 4А – В).
Пероральна обробка перепелиних яєць знижувала експресію PAR-2 та NF-κB p65 у тканинах та сприяла лікуванню EoE подібної терапії захворювання
Обговорення
Тим часом загальновідомо, що саме перепелине яйце містило яєчні алергени, які також можуть впливати на регуляцію імунного шляху, щоб забезпечити користь у виникненні алергічних реакцій. Однак, хоча в цьому дослідженні ми також виявили, що пероральне лікування перепелиним яйцем могло викликати значний приріст специфічного IgE для перепелиних яєць на 35-й день, ми також виявили значне зниження PPE-специфічного IgE та IgG1 у сенсибілізованих мишей, сенсибілізованих до арахісових алергенів. з перепелиним яйцем. Значне підвищення специфічного IgE для перепелиних яєць згодом зменшилось, що свідчить про розвиток толерантності до алергенів до перепелиних яєць. Виробництво антитіл IgE проти перепелиного яйця в цій групі мишей не було дивним, оскільки білок перепелиного яйця містив багато описаних алергенів, і миші, використані в цьому експерименті, отримували ад'ювант для посилення відповіді. Цікаво, що ЗІЗ викликали стійкі до арахісових алергенів специфічні IgE та IgG1 у сенсибілізованих мишей, тоді як перепелине яйце викликало лише помірний тиск специфічних IgE та IgG1 до перепелиних яєць. Це явище, ймовірно, пов'язане з шляхом впливу алергену, оскільки було описано, що шкірний вплив схильний до розвитку алергічної імунної відповіді, тоді як оральний вплив має тенденцію до розвитку толерантності 47 .
Принципова схема механізму протиалергічної та запальної дії перепелиного яйця на харчову алергію, спричинену EoE, як алергічна реакція захворювання.
- Багаторазова непереносимість харчових білків; Симптоми алергії; Управління Neocate
- Харчування для еозинофільного езофагіту Запалююче харчування
- Q; A With Allergolog-Mom on Guidelines of Food Alergy Prevention of Alergy; Живильник
- Вивчіть поживні речовини проти їжі для профілактики захворювань, хто виграв Американський інститут дослідження раку%
- Управління харчовими продуктами серії випадків еозинофільних гастроентеропатій від спільноти "Алергія",