Дисбактеріоз кишечника у дітей із синдромом короткої кишки пов’язаний із порушенням результату
Анотація
Передумови
Склад кишкової мікробіоти здається важливим фактором для визначення клінічного результату у дітей із синдромом короткої кишки (СРС). Зміни мікробіоти можуть призвести до серйозних ускладнень, таких як переростання бактерій тонкої кишки (SBBO) та запалення слизової оболонки кишечника, що призводить до тривалої залежності від парентерального харчування (PN) з подальшим збільшенням ризику печінкової недостатності та сепсису. На сьогоднішній день не існує повідомлень про відображення мікробіому кишечника у дітей з СРС. Тут ми представляємо перший звіт про профіль кишкової мікробної спільноти у дітей із СРС.
Висновки
У дослідження включено дітей з діагнозом СРС в неонатальному періоді. Здорові брати та сестри служили контролем. Збирали зразки калу та аналізували мікробні профілі за допомогою секвенування генів 16S рРНК на платформі Illumina MiSeq. Ми спостерігали виражений мікробний дисбіоз у дітей із СРС на лікуванні ПН із підвищеною та домінуючою відносною чисельністю Enterobacteriacae у чотирьох з п’яти дітей порівняно з дітьми із СБС, відлученими від ПН та здоровими братами та сестрами.
Висновки
Загальне зниження бактеріального різноманіття у дітей з СРС відповідає картографуванню мікробіомів кишечника при запальних захворюваннях кишечника, таких як хвороба Крона та некротизуючий ентероколіт у недоношених дітей. Отримані нами дані вказують на те, що дисбактеріоз кишечника у дітей із СРС пов’язаний із тривалою залежністю ПН.
Висновки
Передумови
Дитяча кишкова недостатність (ІФ) визначається як нездатність шлунково-кишкового тракту підтримувати адекватний ріст, гідратацію та електролітний гомеостаз у дітей без парентерального харчування (ПН). Синдром короткого кишечника (СРС) є найпоширенішою причиною дитячої ІФ. Стан спричинений масивними резекціями тонкої кишки внаслідок некротизуючого ентероколіту (НЕК) або вульви та вроджених вад розвитку, таких як шлунково-кишковий атрезія. СРС новонароджених - це захворювання з високим рівнем захворюваності та смертності [1]. Медичне керівництво СРС має на меті встановити повноцінне ентеральне/пероральне годування та відлучення від ПН.
Кишкова мікробіота, здається, є головним фактором, що визначає успішний клінічний результат при СРС, який визначається як незалежність лікування ПН та адаптації кишечника. Зміни мікробіоти можуть призвести до серйозних ускладнень, таких як надмірне розростання бактерій тонкої кишки (SBBO) та запалення слизової оболонки кишечника, що може запобігти відлученню від ПН, порушуючи всмоктувальні функції кишечника [2,3]. Рекомендовано тривале лікування просвітом/пероральним антибіотиком для лікування СББО у дітей [4,5]. Більшість випадків СРС трапляються у новонароджених у період, коли стерильний кишечник зазвичай колонізується бактеріями, досягаючи мікробного профілю, характерного для дорослого шлунково-кишкового тракту, приблизно у віці 2-4 років [6]. Порушення збалансованої кишкової мікробної спільноти, тобто дисбактеріоз, із збільшеною відносною кількістю факультативних анаеробних Enterobacteriaceae у товстій кишці спостерігається при запальних захворюваннях кишечника (ВЗК) у моделей мишей, у людей із хворобою Крона та у НЕК у недоношених дітей [7,8].
На сьогоднішній день не існує повідомлень про відображення мікробіоти кишечника у дітей з СРС. Тут ми представляємо перший звіт про мікробний профіль у дітей із СРС за допомогою секвенування генів 16S рРНК на платформі Illumina MiSeq.
Методи
Пацієнти
Це дослідження було схвалено регіональним комітетом з питань етики медичних досліджень в Упсалі (Dnr2012/002). Інформована письмова згода на збір зразків та подальший аналіз була отримана від батьків. Характеристики досліджуваної групи та відповідних здорових братів і сестер продемонстровано в таблиці 1. Дослідження охоплює 11 дітей у віці від 1,5 до 7 років з діагнозом ІФ/СРС у неонатальному періоді, з яких двоє - із набору триплетів (2А та 3А) (Таблиця 1). Всі діти, крім одного, були недоношеними. Дитині 1А, 8А та 13А була проведена процедура подовження кишечника із серійною поперечною ентеропластикою (STEP) [9]. На момент дослідження п’ятеро дітей не були відлучені від ПН. Сім здорових братів і сестер служили контролем. Діти з ПН мали пероральний та/або ентеральний прийом безлактозної гідролізованої білкової суміші та віковий прийом твердої їжі зі зменшенням вмісту дисахаридів згідно з таблицею 1.
Збір даних та статистичний аналіз
Зразки калу збирали і зберігали при -80 ° C до аналізу. ДНК витягували з кожного зразка калу за допомогою надчистого набору для ізоляції ДНК калу (MoBio, Naxo Ltd, Тарту, Естонія) відповідно до інструкцій виробника.
Результати
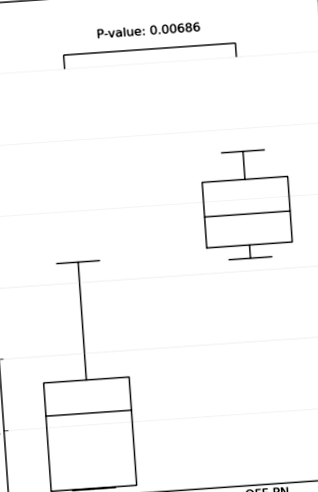
Малюнок 1 показує, що індекс різноманітності Шеннона значно знижується у дітей із СБС, які все ще перебувають на ПН, порівняно з дітьми, відлученими від ПН. Жодна з дітей, хворих на ПН, не мала залишкового внутрішньоклітинного захворювання.
Індекс різноманітності Шеннона у дітей із СБС, які все ще перебувають на ПН, порівняно з дітьми, які відлучені від ПН.
Мікробні спільноти у дітей з СБС на ПН (1А, 3А, 8А, 9А, 12А), діти з СБС, відлучені від ПН (2А, 4А, 11А, 13А, 16А, 18А), та брати та сестри (2С1, 2С2, 11С1, 11С2, 12C, 13C1, 13C2). Цифра показує відносну чисельність 19 найпоширеніших таксономічних сімей, на які припадає принаймні 84% від чисельності у всіх зразках.
На малюнку 3, показники різноманітності Шеннона та, на малюнку 4, незважені відстані UniFrac у дітей із СБС на ПН (1А, 3А, 8А, 9А, 12А), діти СБС, відлучені від ПН (2А, 4А, 11А, 13А, 16A, 18A) та побратимів (2C1, 2C2, 11C1, 11C2, 12C, 13C1, 13C2).
Індекс різноманітності Шеннона у дітей із СБС на ПН (1А, 3А, 8А, 9А, 12А), дітей, відлучених від ПН (2А, 4А, 11А, 13А, 16А, 18А) та братів та сестер (2С1, 2С2, 11С1, 11С2), 12C, 13C1, 13C2).
Графік PCoA, що описує незважену відстань UniFrac між зразками. Попарні відстані між усіма зразками проектуються на двовимірний простір, де вісь PC1 описує найвищий ступінь варіації. Таким чином, вважається, що зразки, які згруповані між собою, мають більшу частку філогенетичного дерева порівняно із зразками, які є більш відокремленими.
Ми мали унікальну можливість вивчати триплети, що представляють усі три групи. Дитина 2А і дитина 3А були триплетами чоловічої статі, народженими на 23 тижні вагітності. Обидва хлопчики страждали на НЕК в неонатальному періоді, що призвело до резекції тонкої кишки (табл. 1). Третій хлопчик-триплет (2С2) залишався здоровим. У дитини 2А було резектовано лише 2 см тонкої кишки, однак у нього розвинувся ІФ після тривалого НЕК і він став залежним від ПН. Під час лікування ПН у нього не було ознак SBBO. За 3 місяці до забору калу його відлучили від повноцінного перорального годування та без антибіотиків. Його кишкова бактеріальна різноманітність була подібною до його здорового брата (SDI 4, 67 та 4, 97 відповідно).
Дитину 12А лікували антибіотиками лише протягом перших 2 тижнів після пологів, не мали ознак SBBO і відлучення від ПН прогресувало, але повільно. Її фекальне різноманіття бактерій показало Lactobacillacae як найпоширеніша таксономічна сім'я згідно з нашими попередніми висновками (рис. 2) [13]. Ми могли виявити Clostridium difficile у двох з десяти пацієнтів з СРС (пацієнти 2А та 11А) та у дуже низькій відносній чисельності (дані не наведені).
Висновки
Тенденція SBBO та запалення кишечника затримувати або запобігати відлученню від ПН у цих дітей із СРС, схоже, пов’язана з мікробним дисбіозом в кишковому тракті. Цей висновок відповідає попередньому дослідженню, яке продемонструвало, що введення ПН було незалежно пов'язане із SBBO [14]. Вплив ПН на зміну профілю внаслідок голодування мікробіомів малоймовірний, оскільки порушення всмоктування перорально/ентерально харчується є основною проблемою СБС. Загалом, спостережувані зміни мікробіоти у дітей з СРС, швидше за все, є як причиною, так і наслідком стану захворювання дитини. Обмеженням дослідження є невелика дослідна група, і незрозумілими факторами, які можуть вплинути на результати, є вік, довжина кишечника та лікування антибіотиками. Однак когорта в цьому дослідженні представляє дітей з СРС у клінічній практиці.
У нашому центрі ми лікуємо SBBO пероральними антибіотиками, як рекомендують інші центри [4-6]. Однак найімовірніше, що антибіотики ще більше сприятимуть дисбіозу у цих дітей. У дітей із СРС нормальна колонізація порушується через раннє та часте вживання антибіотиків, а зменшення різноманітності бактерій дозволяє потенційним патогенним бактеріям розширюватися. Запропоновано антибіотики для зниження стійкості до колонізації Enterobacteriacae як от кишкова паличка і Salmonella enterica, за рахунок підвищення запального тонусу слизової оболонки кишечника [15]. Найчастіше пробіотики використовуються для модифікації мікробіоти кишечника при СРС; однак існують суперечливі висновки та повідомлення про пробіотико-асоційовану септицемію [16].
Загальне зниження бактеріального різноманіття у наших дітей з СРС відповідає дисбактеріозу кишечника у хворих на ВЗК, немовлятам із НЕК, а також було описано на моделі поросят СБС у поросят [7,8,17,18]. Крім того, діти з рецидивами C. difficile-асоційована діарея демонструє зменшення різноманітності калу зі зменшенням Бактеріодети і Фірма [19]. У цих дітей показник успішності трансплантації мікробіоти калу (ФМТ) перевищує 90%. Таке лікування також успішно застосовується як доповнення для лікування ВЗК [19,20]. Отже, ФМТ може виявитись альтернативою лікування у ретельно відібраних випадках СРС із дисбіозом. Однак, оскільки діти з СРС часто вразливі через свій початковий стан здоров'я, слід враховувати труднощі та ризики ФМТ. Хоча частота серйозних побічних ефектів рідкісна, одним із таких ризиків є зараження хворобою донора, коли безсимптомні мікроорганізми, які не викликають проблем у здорового донора, можуть викликати реакцію у реципієнта. Крім того, масове надходження нової мікробіоти також може спричинити аутоімунні захворювання, а також бактерії та септичний шок. Також слід бути особливо обережним з ФМТ, якщо у пацієнта є якісь ознаки імунодефіциту [21].
Це перший звіт, що описує мікробний профіль кишечника у дітей із СРС із використанням послідовності наступного покоління. Ми спостерігали виражений мікробний дисбіоз у дітей із СБС, які все ще перебувають на ПН, порівняно з дітьми, відлученими від ПН із підвищеною відносною кількістю протеобактерій, більшість з яких тривалий час лікувались антибіотиками. Отримані нами дані вказують на те, що дисбактеріоз кишечника у дітей із СРС пов’язаний із порушенням результату при тривалій залежності ПН. Подальші дослідження повинні з’ясувати нові стратегії лікування дисбактеріозу кишечника у цих дітей.
- Дисбіоз мікробіоти кишечника пов’язаний з недоїданням та зниженням рівня амінокислот у плазмі крові
- Більша кількість тромбоцитів пов'язана з метаболічним синдромом, незалежно від діагностики жирової печінки
- Як годувати наших дітей без їжі, калорій та правил
- Зелений чай як інгібітор кишкового всмоктування ліпідів Потенційний механізм його розвитку
- ЛИСТЕР Чи варто звинувачувати батьків у надмірній вазі дітей Думка про місцеві перспективи Telegram