Дисбіоз мікробіоти кишечника пов’язаний з недостатнім харчуванням та зниженим рівнем амінокислот у плазмі крові: уроки моделювання метаболізму в геномному масштабі
Маніш Кумар
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
Боянг Джи
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
Паризад Бабаї
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
Промі Дас
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
Димитра Лаппа
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
Гірія Рамакрішнан
5 Медичний факультет/Відділ інфекційних хвороб, Університет Вірджинії, Шарлотсвілль, штат Вірджинія, США
Тодд Е. Фокс
6 Кафедра фармакології, Університет Вірджинії, Шарлоттсвілль, штат Вірджинія, США
Рашидул Хаке
7 Міжнародний центр досліджень діарейної хвороби, Дакка, Бангладеш
Вільям А. Петрі-молодший
5 Медичний факультет/Відділ інфекційних хвороб, Університет Вірджинії, Шарлотсвілль, штат Вірджинія, США
Фредрік Бекхед
3 Лабораторія Валленберга, кафедра молекулярної та клінічної медицини, Університет Гетеборга, 41345, Гетеборг, Швеція
4 Центр фундаментальних досліджень обміну речовин Novo Nordisk, Секція з метаболічної рецептології та ентероендокринології, Факультет медичних наук, Університет Копенгагена, 2200 Копенгаген, Данія
Єнс Нільсен
1 Кафедра біології та біологічної інженерії Технологічного університету Чалмерса, SE41128, Гетеборг, Швеція
2 Центр фонду біологічної стійкості Novo Nordisk, Технічний університет Данії, DK2800 Lyngby, Данія
M.K., B.J. та J.N. задумав та спроектував дослідження, обчислювальні рамки та аналізи. M.K., B.J. та P.B. впровадив основи та виконав аналіз Д.Л. розробив конвеєр для вдосконалення анотацій моделі. П.Д., Ф.Б. та Дж. задумав і спроектував експерименти ферментації. П. проводили досліди. R.H., W.A.P.J. та J.N. задумав та спроектував дослідження метаболоміки. Г.Р. та Т.Ф. виконував експерименти з метаболоміки. М.К. проаналізував дані метаболоміки. M.K., P.B. та J.N. написав рукопис.
Пов’язані дані
Анотація
ВСТУП
Гіпотрофія є важким неінфекційним захворюванням у країнах з низьким та середнім рівнем доходу, яке включає дві форми, а саме недоїдання (затримка росту та марнотратство) та переїдання (ожиріння). Згідно з недавньою доповіддю Всесвітньої організації охорони здоров'я (ВООЗ), затримки росту та марнотратство вплинули на 160 мільйонів та 50 мільйонів дітей відповідно у всьому світі (Chan, 2017). У 2016 р. Лише затримка трюку вплинула на 22,6% дітей у віці до 5 років у цілому (UNICEF та ін., 2017). ВООЗ рекомендує годувати грудьми до 6-місячного віку для здорового росту немовлят. Більше того, у разі недоїдання рекомендується готове до вживання терапевтичне харчування на основі арахісового масла та сухого знежиреного молока (RUTF) (Briend et al., 2015). Незважаючи на те, що за останні кілька десятиліть було досягнуто значного прогресу у зменшенні поширеності затримок у рості, втручання, що застосовуються для лікування затримок у розвитку дитини, не завжди були успішними (Bhutta et al., 2008; Ramakrishnan et al., 2009). Нещодавно було проведено кілька досліджень, щоб зрозуміти вплив втручання поживних речовин, таких як поживні добавки на основі ліпідів або RUTF, мікроелементи, такі як вітамін А, цинк, залізо, окремо або в декількох комбінаціях, на низькорослих дітей (Ashorn et al., 2015a; Mayo-Wilson et al., 2014; Ramakrishnan et al., 2009). Результати цих досліджень свідчать про те, що втручання не змогли зменшити лінійний дефіцит зростання затримки росту.
Окрім харчових поживних речовин, виявлено, що мікробіота кишечника людини пов’язана з недоїданням (Blanton et al., 2016; Smith et al., 2013; Subramanian et al., 2014). У кишечнику людини зберігаються трильйони мікробних клітин, які в сукупності діють як біореактор для ферментації дієтичних макроелементів до метаболітів, що сприяють здоров’ю, наприклад, коротколанцюгових жирних кислот (СКЖК) (De Vadder et al., 2014; Louis and Flint, 2017), амінокислоти (AA) (Husted et al., 2017; Metges, 2000; Shoaie et al., 2015) та вітаміни (Degnan et al., 2014; Gominak, 2016; Östman et al., 2001). Більше того, попередні дослідження продемонстрували взаємодію мікробіоти кишечника з метаболізмом жовчних кислот, що може мати значний вплив на метаболізм господаря (Wahlström et al., 2016).
МАТЕРІАЛИ І МЕТОДИ
Аналіз даних відносної чисельності мікроорганізмів кишечника
Дані відносної таксономічної чисельності кишкових бактерій були отримані в результаті трьох опублікованих досліджень, заснованих на дитячих групах з трьох різних країн (Малаві, Бангладеш та Швеція) (Bäckhed et al., 2015; Smith et al., 2013; Subramanian et al., 2014 ). Для відбору 20 найбільш поширених видів бактерій із мікробіоти кишечника здорових та недоїдаючих дітей було використано лише відносну кількість на рівні видів, щоб відновити ГЕМ. Це припущення було зроблено для спрощення системи моделювання для розуміння метаболічних можливостей найбільш домінуючої частини мікробіому кишечника дитини у стані здоров’я та недоїдання. Всього було відібрано 68 видів. Відносну таксономічну чисельність вибраних видів можна побачити в таблиці S1 та на рисунку S2.
Співвідношення Firmicutes/Bacteroidetes розраховували для здорових та недоїдаючих дітей, використовуючи дані відносної таксономічної чисельності чотирьох опублікованих досліджень (Bäckhed et al., 2015; Blanton et al., 2016; Smith et al., 2013; Subramanian et al., 2014). Серед чотирьох наборів даних двоє були з малавійських дітей (Blanton et al., 2016; Smith et al., 2013), а решта два - з Бангладеш (Subramanian et al., 2014) та шведських дітей (Bäckhed et al., 2015) . Дані відносної таксономічної чисельності шведських дітей були доступні лише для здорових дітей. Подальші набори даних про чисельність видів використовувались для визначення індексу різноманітності Шеннона або індексу Шеннона-Вінера мікробіоти кишечника для кожної дитячої групи. Індекс Шеннона-Вінера визначається наступним чином (Hurlbert, 1971):
Де, Pi - відносна чисельність видів i. S - кількість видів у мікробній спільноті. функція розмаїття пакету vegan була розгорнута для отримання цього індексу в R версії 3.3.0.
Реконструкції метаболічних моделей у масштабі генома
Через часткову послідовність та анотацію або відсутність у відкритих базах даних генома десяти видів, проекти GEM були реконструйовані для 58 видів (таблиця S2). Ці моделі представлені стехіометричною матрицею (S), яка включає метаболічну конверсію та інформацію про баланс маси біохімічних реакцій (ферментативних та транспортних) в метаболічній мережі організму, а ріст визначається за реакцією біомаси, яка пов'язана з іншими біохімічними реакціями в мережі. Анотовані геноми на основі швидкої анотації з використанням підсистемної технології (RAST) sever (Aziz et al., 2008) були використані для реконструкції проекту GEM на платформі KBase (База знань Міністерства енергетичних систем США, https://kbase.us/) . Платформа KBase використовує конвеєр modelSEED (Henry та ін., 2010) для генерації GEM.
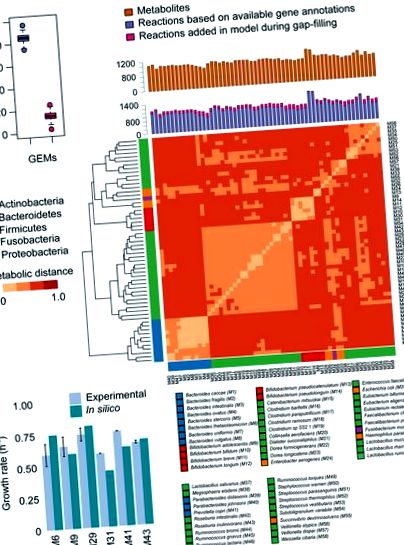
Щоб заповнити прогалини в GEM, ми використали конвеєр KBase/modelSEED для автоматичного додавання мінімального набору реакцій до проектних мереж з метою отримання біомаси (Henry et al., 2010). Оновлений конвеєр KBase/modelSEED використовує раніше опублікований метод заповнення прогалин (Latendresse, 2014). GEM, які містили щонайменше 75% реакцій на основі наявних анотацій генів, були розглянуті для подальшого аналізу, щоб зменшити можливий вплив реакцій, що заповнюються автоматично. Детально про кроки, які виконуються при куруванні GEM, див. Додатковий текст. Усі 58 GEM доступні на GitHub (https://github.com/SysBioChalmers/ChildrenGutMicrobialGEMs). На наступному кроці ми порівняли GEM, щоб визначити метаболічні відмінності один від одного. Нерівномірність моделей досліджували з точки зору метаболічних відстаней між моделями на основі їх списку реакцій. Метаболічну відстань розраховували з використанням коефіцієнта Жакара, оскільки метаболічна відстань = 1 - коефіцієнт Жакара (Левандовський, 1971) (рис. 2В та таблиця S4). Якщо A - сукупність реакцій моделі a, а B - сукупність реакцій моделі b, то метаболічна відстань між a і b визначається як 1 - | A∩B |/| A∪B |.
(А) Частка реакцій, пов’язаних із анотаціями генів (фіолетова смужка) та доданих під час заповнення проміжків (рожева смужка). (B) Кількість метаболітів та реакцій в GEM бактерій кишечника, а також метаболічні відстані між моделями на основі спільних та унікальних реакцій, яке було розраховане за допомогою коефіцієнта Жакара (Експериментальна процедура). Моделі, що представляють один і той же тип, мають більше реакцій, ніж моделі з таксономічно різних видів. Функція heatmap.2 пакета gplots, а функції dist та hclust R були використані для генерації теплової карти та дендрограми відповідно у версії R 3.3.0. (C) Перевірка GEM. Прогнози швидкості росту ГЕМ шести видів кишкових бактерій були підтверджені експериментальними спостереженнями на середовищі YCFA з різною швидкістю поглинання глюкози (ммоль gDW-1 год-1) в умовах анаеробного росту (табл. 1). Видами, що брали участь в цьому аналізі, були Bacteroides thetaiotaomicron (M6), Bifidobacterium adolescentis (M9), Eubacterium rectale (M29), Faecalibacterium prausnitzii (M31), Prevotella copri (M41) та Roseburia inulinivorans (M43).
Моделювання моделей
Реконструкція метаболічних моделей мікроорганізмів у кишечнику
Спільні метаболічні моделі (СММ) були реконструйовані з використанням одновидових ГЕМ, згідно з раніше опублікованим методом створення моделей мішаних мішків для мікробних спільнот (Henry et al., 2016). Для цього було відібрано п’ять мікробних спільнот кишок на основі п’яти різних дитячих груп, а саме малавійських дітей (здорові), дітей Бангладеш (здорові), шведських дітей (здорові), малавійських дітей (недоїдають) та дітей Бангладеш (недоїдають) (Таблиця S5).
Попарні взаємодії між видами
Паралельне моделювання проводили шляхом формулювання лінійного програмування, в якому метаболіти середовища були встановлені як єдині доступні ресурси для моделей. Якщо обидві моделі вимагали метаболіту, обмеження означало б, що сума пов'язаного з ним потоку споживання буде меншою або рівною доступній кількості в середовищі. Будь-які метаболіти, вироблені членами громади, які використовував інший член, були обмежені, що означало, що споживаний потік менше або дорівнює продукованому потоку. Цільовою функцією для моделювання попарного росту та потенційного продукування метаболітів були сума реакцій біомаси та сума реакцій обміну, що утворюють метаболіт, що представляє інтерес, відповідно. Для ідентифікації типу впливу на ріст швидкість приросту в парному моделюванні віднімали від швидкості приросту при оптимізації окремих видів, і залежно від зміни темпів зростання тип ефекту класифікували.
Перевірка моделей
GEM Bacteroides thetaiotaomicron (M6), Bifidobacterium adolescentis (M9), Eubacterium rectale (M29), Faecalibacterium prausnitzii (M31), Prevotella copri (M41) та Roseburia inulinivorans (M43) використовувались для прогнозування темпів зростання in vitro в initro експериментальні дані на основі монокультур. В експериментальній установці Bifidobacterium adolescentis L2–32, Eubacterium rectale A1–86 (DSM 17629), Faecalibacterium prausnitzii A2–165 (DSM 17677) та Roseburia inulinivorans A2–194 (DSM 16841) були надані доктором Карен Скотт, The Rowett Інститут харчування та здоров'я, Абердін. Бактероїди thetaiotaomicron ATCC 29148 та Prevotella copri DSM 18205 були отримані з American Type Culture Collection (ATCC) та Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ), відповідно. Спочатку, перш за все, штами були виділені зі свого фекального середовища проживання. B. adolescentis, B. thetaiotaomicron, E. rectale, F. prausnitzii та R. inulinivorans підтримувались у пробірці, подібній до Хунгейту (Ochs Laborbedarf, Німеччина), в середовищі YCFA (Додаткові експериментальні процедури) в анаеробному середовищі з використанням безкисневого CO2 ( Зе та ін., 2012). Однак P. copri зберігався на середовищі PYG (носій 104 у каталозі DSMZ).
Анаеробну камеру (Coy Lab Products, Grass Lake, MI, USA) використовували для підтримання безкисневого середовища для субкультивирования кожної бактерії на агаровій пластині, що містить середовище YCFA. Для приготування інокуляту одну колонію переносили в рідке середовище YCFA (7,5 мл у кожній пробірці Хунгейта) та інкубували протягом 12–15 год. Крім того, 100 мл сироваткових флаконів (Ochs Laborbedarf, Німеччина) з робочим об’ємом автоклавного середовища YCFA 50 мл використовувались для проведення експериментів ферментації в анаеробному середовищі, яке підтримувалось безкисневим CO2. Кожну пляшку інокулювали 2% (об./Об.) Інокулятом і інкубували максимум 30 год. Всі експерименти проводились у трьох примірниках.
Для моделювання GEM вищезазначених видів усі компоненти середовища YCFA розділяли на окремі метаболіти (Додаткова експериментальна процедура та таблиця S7), які використовувались як вхідні дані для GEM. Швидкість поглинання глюкози (ммоль гДВ -1 год -1) була обмежена, як вимірювали експериментальними спостереженнями (Таблиця 1). Швидкість поглинання решти середніх метаболітів залишалася необмеженою (таблиця S7). Виробництво біомаси було встановлено як цільову функцію для моделювання цих GEM.
Таблиця 1:
Порівняння прогнозованих темпів зростання та експериментальних темпів зростання (n = 3)
- Дисбактеріоз кишечника у дітей із синдромом короткої кишки пов’язаний із порушенням результату
- Більша кількість тромбоцитів пов'язана з метаболічним синдромом, незалежно від діагностики жирової печінки
- Ле Фі; кислота Фіт; Кислотний очищаючий гель для обличчя та тіла; PHYTO5 Швейцарський квантовий енергійний догляд за шкірою
- Виноградний сік, консервований або розлитий у пляшки, несолодкий, без додавання аскорбінової кислоти Харчові факти та калорії
- Нехай вони їдять равликів Харчові гігантські равлики можуть вирішити проблему недоїдання - ScienceDaily