Діагностика хронічного панкреатиту
Пов’язані терміни:
- Ендоскопічна ретроградна холангіопанкреатографія
- Гострий панкреатит
- Магнітно-резонансна холангіопанкреатографія
- Ендоскопічне УЗД
- Підшлункова залоза
- Комп’ютерна томографія
- Панкреатографія
- Протока підшлункової залози
- Хронічний панкреатит
Завантажити у форматі PDF
Про цю сторінку
Ендоскопічна УЗД
Хронічний панкреатит
Діагноз хронічного панкреатиту очевидний при встановленні кальцифікатів паренхіми або внутрішньопротокових каменів, як це видно на рентгенограмі черевної порожнини, КТ або ендоскопічній ретроградної холангіопанкреатографії (ERCP). Ці висновки також легко побачити на EUS. Однак є пацієнти з симптоматикою, що свідчить про хронічний панкреатит, проте методи візуалізації є нормальними або недіагностичними. Ця когорта пацієнтів може мати ранній або мінімальний хронічний панкреатит. EUS може точно оцінити незначні зміни паренхіми та протоки у цих пацієнтів. Для діагностики хронічного панкреатиту існують визначені критерії EUS, які співвідносяться із вирізаними патологічними зразками. Гістологічне підтвердження є золотим стандартом для діагностики хронічного панкреатиту, і розробляються нові голкові системи, які дозволять провести основну біопсію підшлункової залози під керівництвом EUS.
Хронічний панкреатит
Діагностика хронічного панкреатиту
Діагноз хронічного панкреатиту грунтується на поєднанні анамнезу та фізикального обстеження, аналізів крові, функціональних тестів та рентгенологічних досліджень. Клініцист повинен дати чіткий опис болю, повторюваного характеру епізодів та наявності факторів ризику захворювання, включаючи вживання алкоголю та сімейний анамнез. Оскільки природний анамнез болю дуже мінливий, і 20% пацієнтів мають безболісний хронічний панкреатит, не рідкість, що діагноз може затягнутися. При фізичному огляді можуть бути докази недоїдання, таких як виснаження в часі та зменшення запасів підшкірного жиру. Повнота живота може свідчити про наявність псевдокісти підшлункової залози.
Панкреатит
Недостатність підшлункової залози
Тестування функції підшлункової залози може допомогти діагностувати хронічний панкреатит шляхом виявлення недостатності підшлункової залози і може слугувати основою для раціональної терапії при прогресуванні хронічного панкреатиту. 67 Інтубація дванадцятипалої кишки із стимуляцією секретин-церулеїном залишається стандартом для діагностики недостатності підшлункової залози. Важливо те, що тест може виявити зменшення вироблення ферментів до того, як виявиться порушення травлення. На практиці це рідко виконується. Мало центрів мають знання та обсяг для надійного проведення тесту, значною мірою тому, що тест трудомісткий та трудомісткий для проведення. Отже, деякі лікарі замінюють всмоктування рідини дванадцятипалої кишки при ендоскопії для тесту інтубації. Такий підхід, ймовірно, недооцінює секрецію підшлункової залози і призводить до неправильної класифікації у великої кількості пацієнтів. 68
Протягом багатьох років було розроблено ряд неінвазивних тестів функції підшлункової залози як заміни для інтубаційного тесту. Альтернативи включають фекальну еластазу або хімотрипсин, панкреолауриловий тест, бентиромідний тест та дихальні тести з міченими тригліцеридами. Кожен виявляє лише пацієнтів із запущеним хронічним панкреатитом. При легкій та помірній втраті екзокринної функції всі тести мають низьку чутливість. З цих тестів фекальна еластаза є найбільш доступною. Необхідний пробний зразок стільця, і пацієнти можуть залишатися на добавках ферментів підшлункової залози. Водянистий стілець представляє проблему, оскільки розріджує еластазу підшлункової залози і призводить до хибнопозитивних результатів.
Одного разу рутинна частина оцінки підозри на мальабсорбцію, 72-годинний збір калових жирів вийшов з ладу, незважаючи на те, що він залишається найкращим тестом на стеаторею. Тест не є специфічним для захворювань підшлункової залози, оскільки захворювання слизової оболонки кишечника можуть спричинити стеаторею. Крім того, тест важко проводити. Сім'ї не люблять збирати та зберігати стілець і, можливо, не дотримуються необхідної дієти. Деякі пацієнти можуть мати проблеми із дотриманням призначеної дієти. Виконання тесту в лабораторії метаболізму може подолати деякі з цих проблем, але це недоцільно для клінічної практики. Як і у випадку з іншими неінвазивними тестами, 72-годинний збір калових жирів є ненормальним лише на тлі запущеного захворювання.
EUS при запальних захворюваннях підшлункової залози
Резюме
EUS є дуже точним у діагностиці хронічного панкреатиту: кальцифікати або п’ять або більше критеріїв добре корелюють як з ERCP, так і з тестуванням екзокринної функції підшлункової залози. Виявлення менш ніж трьох критеріїв, і особливо жодного, ефективно виключає хронічний панкреатит. Наявність трьох або чотирьох критеріїв є найкращим загальним обмеженням; дослідження, що приземляються на або біля цього відсікання, по суті невизначені і не змінюють підозри хвороби на попереднє тестування. Не рекомендується отримувати гістологічні зразки за допомогою FNA або біопсії Tru-Cut. Використовувати кількість критеріїв для встановлення тяжкості хронічного панкреатиту (тобто легкого, середнього або важкого захворювання) не рекомендується. Функціональний MRCP є конкуруючою технологією, але, здається, не є настільки точним для раннього захворювання.
EUS корисний для виявлення можливих причин ідіопатичного рецидивуючого панкреатиту. Діагностична ефективність EUS є найвищою у пацієнтів старшого віку та у пацієнтів із встановленим жовчним міхуром, і це може бути навіть корисним на додаток до MRCP у цих пацієнтів. Урожайність більш обмежена у молодих пацієнтів без жовчного міхура. Також можна надійно діагностувати співіснуючий хронічний панкреатит, і EUS може бути особливо актуальним у пацієнтів з хронічним болем між нападами. Хоча необхідні додаткові дослідження, діагностика підрозділу підшлункової залози за допомогою EUS представляється конкретною і, можливо, більш чутливою, ніж MRCP (особливо коли результати MRCP читаються в середовищі громади). Неможливість досягти ознаки стека викликає підозру на розділення підшлункової залози, але здатність стежити за (або не слідувати) протокою підшлункової залози від великої ампули до гену (або від черевної до спинної) є більш надійною.
EUS, хоча і не є досконалим, є однією з найкращих доступних методик для розрізнення запальних (псевдопухлинних) пухлинних пухлин у підшлунковій залозі. Часто FNA не потрібен, оскільки поява запальних змін у EUS або об'ємність без будь-якої відчутної маси має сильне негативне прогнозне значення. У пацієнтів з невизначеними масами підшлункової залози FNA, безумовно, корисна. Більшість випадків у цій категорії вимагають певного типу подальшого візуалізації приблизно через місяць для виявлення рідкісних хибнонегативних результатів EUS та підтвердження дозволу або стабільності доброякісних мас. AIP можна запідозрити на EUS, і біопсія Tru-Cut може бути корисною у деяких випадках, але тестування IgG4 на сироватці крові в більшості випадків є безпечнішим та надійнішим. Стимульовані секретином EUS, EUS з аналізом зображень, EUS з контрастом та EUS з еластографією є перспективними доповненнями до EUS, які потребують подальшого вивчення.
Етіологія, патогенез та діагностика хронічного панкреатиту
Магнітно-резонансна томографія та холангіопанкреатографія (див. Розділ 19)
Використання МРТ/MRCP є більш чутливим для діагностики ХП, ніж КТ або УЗД. МРТ/MRCP виявляє ранні паренхіматозні зміни ХП та протокових аномалій (Conwell et al, 2014; Manikkavasakar et al, 2014; Sainani et al, 2015; Trikudanathan et al, 2015). Застосування стимульованого секретином МРТ/МРХП забезпечує динамічний тест для характеристики протоки підшлункової залози та паренхіми підшлункової залози. Зокрема, внутрішньовенне введення (IV) секретину повинно призвести до збільшення діаметра протоки підшлункової залози більш ніж на 1 мм, з відновленням його розміру через 10 хвилин («відповідність протоки підшлункової залози») (Conwell et al, 2014). МРТ/МРХП із внутрішньовенним секретином також можна використовувати для оцінки екзокринної функції підшлункової залози. Використовуючи багатозрізну, швидку Т2-зважену послідовність, можна оцінити кількість рідини, що секретується підшлунковою залозою до і після стимуляції.
Trikudanathan та його колеги (2015) оцінили кореляцію результатів МРТ та індукованого секретином MRCP (sMRCP) з хірургічною гістопатологією у когорті пацієнтів з не кальцифічним ХП, які пройшли тотальну панкреатектомію з аутотрансплантацією острівців. Загалом 57 пацієнтів мали sMRCP протягом 1 року після операції. Використовуючи аналіз кривих робочих характеристик приймача (ROC), автори виявили, що дві або більше характеристик МРТ/sMRCP забезпечують найкращий баланс чутливості (65%), специфічності (89%) та точності (68%) для диференціації патологічного та нормального підшлункової залози тканина. Лінійний регресійний аналіз з урахуванням віку, куріння та індексу маси тіла (ІМТ) показав, що нерегулярність головного протоку підшлункової залози, коефіцієнт інтенсивності сигналу, зваженого за Т1, між м’язами підшлункової залози та параспінального м’яза та наповнення дванадцятипалої кишки після ін’єкції секретину були важливими незалежними предикторами фіброзу. Це дослідження продемонструвало сильну кореляцію між результатами МРТ/sMRCP та гістопатологією некальцинозного ХП (Trikudanathan et al, 2015).
Таким чином, МРТ/MRCP корисно оцінити на перидуктальний фіброз, розширення протоки з ектазією та аномаліями бічних гілок, утворення внутрішньопаренхіматозної кісти, а також стриктури та камені підшлункової залози, що ведуть до утрудненого відтоку (Conwell et al, 2014; Manikkavasakar et al, 2014 ). МРТ особливо корисна для виявлення ранніх паренхіматозних змін, що свідчать про ХП, таких як аномальна знижена інтенсивність сигналу на пригнічених жиром зображеннях, зважених Т1, та відстрочене або обмежене посилення після введення гадолінію (Conwell et al, 2014). Апаратне та програмне забезпечення для MRT та MRP постійно переживає інтенсивний розвиток (Sainani et al, 2015). Основним недоліком MRCP є те, що зміни в бічних гілках не візуалізуються з такою ж точністю, як у ERP.
Хронічний панкреатит
Комп'ютерна томографія
Чутливість та специфічність комп’ютерної томографії (КТ) для діагностики ХП становить від 75% до 90% та 85% відповідно. 31 Головною перевагою КТ є те, що він може бути стандартизованим та візуалізувати всю підшлункову залозу. КТ є найбільш чутливим тестом для виявлення кальцифікації, точним виявленням розширення магістральної протоки підшлункової залози і може виявити неправильний контур залози (рис. 59.2). 31,38,39 Ці особливості спостерігаються в просунутому КП, а КТ чудово виявляє ці зміни. Однак КТ погано виявляє незначні відхилення в роботі паренхіми підшлункової залози або зміни бічних гілок підшлункової протоки, які зазвичай спостерігаються при легших формах захворювання. КТ має хорошу специфічність, але не має чутливості для діагностики ХП. Нові мультидетекторні КТ-сканери можуть забезпечити кращу чутливість.
Візуалізація та радіологічне втручання в підшлунковій залозі
Хронічний панкреатит
МРТ у поєднанні з MRCP є найбільш корисним неінвазивним тестом для діагностики хронічного панкреатиту. МРТ дозволяє оцінити як зміни паренхіми підшлункової залози (включаючи зміни сигналу та атрофії), так і зміни протоки підшлункової залози. КТ, навпаки, відмінно підходить для демонстрації характерних кальцифікацій підшлункової залози (рис. 95.4).
Серед ранніх знахідок хронічного запалення є аномальний сигнал тканини підшлункової залози, наприклад, зменшення власного сигналу Т1 на передконтрастному Т1-зваженому зображенні, насиченому жиром. Пізні дані включають розширення та стеноз підшлункової та жовчовивідних шляхів, внутрішньопротокові кальцифікації та атрофію або збільшення паренхіми. 17 У пацієнтів з хронічним панкреатитом підшлункова залоза демонструє зниження постконтрастного посилення порівняно з нормальною тканиною підшлункової залози.
Фокальне збільшення підшлункової залози в результаті гострого до підгострого панкреатиту може бути важко відрізнити від раку. До корисних відмітних ознак візуалізації належать «проникаючий канал» (тобто візуалізація нормального або безперешкодного протоки у фокально аномальному сегменті підшлункової залози) та наявність кальцифікатів. З іншого боку, дані про судинну інвазію не є типовими для хронічного панкреатиту і, натомість, дуже вказують на злоякісність.
Ускладнення хронічного панкреатиту включають шлунково-кишкову непрохідність, спричинену утворенням псевдокісти, накладену інфекцію та судинні ускладнення (наприклад, тромбоз ворітної вени або селезінкової вени та артеріальна псевдоаневризма), що може вимагати рентгенологічних втручань. MRCP із стимуляцією секретину дозволяє оцінити екзокринну функцію підшлункової залози та відповідність протоку. Негативні оральні контрастні речовини слід вводити до стимульованого секретином МРХП для точної оцінки функції підшлункової залози.
Рак печінки, жовчного дерева та підшлункової залози
Чусільп Чарнсангавей, в онкологічній візуалізації, 2002
Хронічний панкреатит
Типовою проблемою, з якою стикаються діагностичні рентгенологи, є диференціація раку підшлункової залози від хронічного панкреатиту. Діагностика хронічного панкреатиту, який характеризується атрофією паренхіми, дифузним розширенням протоки та дифузним кальцинозом паренхіми, не представляє труднощів, і ця форма може спостерігатися у 60-70% пацієнтів із хронічним панкреатитом. Однак хронічний панкреатит, що проявляється як вогнищева маса, що спостерігається у 30% випадків хронічного панкреатиту, діагностувати складніше. Хоча гіподенсна маса, швидше за все, є протоковою аденокарциномою, невелика кількість може представляти хронічний панкреатит, а ізоденсова маса може свідчити про протокової аденокарциномі. Ендоскопічна ультрасонографія з біопсією - це сучасний підхід, який використовується для вирішення цієї проблеми до планування лікування в моєму закладі.
Панкреатит, хронічний
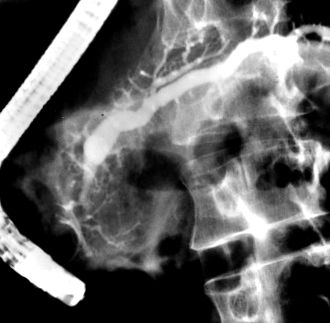
Ендоскопічна ретроградна холангіопанкреатографія
РИСУНОК 3. ERCP пацієнта з хронічним панкреатитом. Це можна побачити разом із протокою підшлункової залози, заповненою рентгенологічним контрастом. Протока підшлункової залози розширена, а бічні гілки протоки також розширені і неправильні. Отримані дані відповідають хронічному панкреатиту та демонструють хворобу великих проток (див. Текст для пояснення).
Прийом кави та ризик раку підшлункової залози
Jeanine M. Genkinger, Valerie Gebara, in Coffee in Health and Disease Prevention, 2015
40.4 Фактори ризику раку підшлункової залози
Небагато факторів ризику раку підшлункової залози добре відомі або широко прийняті. Найбільш послідовним та усталеним фактором ризику раку підшлункової залози є куріння сигарет. 26,27 Крім того, генетична схильність, діагностика хронічного панкреатиту або діабету або сімейний анамнез раку підшлункової залози збільшує ризик раку підшлункової залози. Похилий вік, раса, чоловіча стать та ожиріння (розглянуті в посиланнях 26,27) також позитивно пов’язані з ризиком раку підшлункової залози. Більшість із цих факторів ризику неможливо модифікувати.
Крім того, деякі модифіковані дієтичні фактори, такі як більший прийом алкоголю, 28 червоного та переробленого м’яса, 26 та напої, підсолоджені цукром 29, були пов’язані з вищим ризиком розвитку раку підшлункової залози. За останні три десятиліття численні дієтичні фактори, включаючи споживання кави та ризик раку підшлункової залози, досліджувались в екологічних дослідженнях, контролі за випадками хвороби, когортному та мета- та об'єднаному аналізах.
Рекомендовані публікації:
- Ендоскопія шлунково-кишкового тракту
- Про ScienceDirect
- Віддалений доступ
- Магазинний візок
- Рекламуйте
- Зв'язок та підтримка
- Правила та умови
- Політика конфіденційності
Ми використовуємо файли cookie, щоб допомогти забезпечити та покращити наші послуги та адаптувати вміст та рекламу. Продовжуючи, ви погоджуєтесь із використання печива .
- Синдром тріщин зуба - огляд тем ScienceDirect
- Діоген - огляд тем ScienceDirect
- Фронтотемпоральна деменція - огляд тем ScienceDirect
- Дистальна панкреатектомія - огляд тем ScienceDirect
- Щур, чутливий до солі Даля - огляд тем ScienceDirect