Безпечний діапазон температур для інтраопераційної та ранньої післяопераційної безперервної гіпертермічної інтраперитонеальної перфузії на свинячій моделі експериментальної дистальної резекції шлунка з реконструкцією Billroth II
Анотація
Передумови
Поточне дослідження мало на меті дослідити безпеку інтраопераційної та ранньої післяопераційної безперервної гіпертермічної інтраперитонеальної перфузії (IEPCHIP) при різних температурах на свинячій моделі експериментальної дистальної резекції шлунка з реконструкцією Billroth II.
Методи
Тридцять свиней були випадковим чином розділені на 5 груп. Дві групи використовувались як контрольні групи (групи А1 і А2), а 3 групи використовувались як групи перфузії (групи В, С і D). Свині групи А1 отримували дистальну резекцію шлунка лише з реконструкцією Billroth II. Свині в групах A2, B, C та D отримували ту саму операцію, що і група A1, з подальшим IEPCHIP при 37 ± 0,5 ° C, 42,5 ± 0,5 ° C, 43,5 ± 0,5 ° C або 44,5 ± 0,5 ° C відповідно. Час перфузії оцінювали для кожної свині в групі А2, а також у групах перфузії, і перфузії проводили двічі для кожної групи. Перша перфузія була проведена інтраопераційно, а друга перфузія розпочата через 1 день після операції. Були зібрані дані щодо життєво важливих показників та функції печінки та нирок. Порівнювали параметри, що стосуються зцілення анастомозу, патології тканини анастомозу та спайки живота.
Результати
Життєві показники та функції печінки та нирок свиней у групах А1, А2, В та С істотно не впливали на цю процедуру. На відміну від цього, життєві показники та функції печінки та нирок свиней групи D зазнали значного впливу. Порівняно зі свинями груп А1, А2 чи В, анастомотичний тиск розриву, міцність на розрив та вміст гідроксипроліну у свиней групи С та D були значно нижчими. Істотних відмінностей у цих параметрах між групами А1, А2 та В. не спостерігалось. Абдомінальна адгезія була більш серйозною у свиней групи D. Відкладення колагену у свиней групи А1, А2 та В було щільним в анастомозі, а запальна клітинна інфільтрація спостерігалася у групі D.
Висновки
IEPCHIP при 42,5 ± 0,5 ° C був безпечним і спричиняв мінімальні порушення. Однак на зцілення анастомозу впливала перфузія при 43,5 ± 0,5 ° C і 44,5 ± 0,5 ° C, а абдомінальна адгезія була найсильнішою у тварин групи D, які були перфузовані при 44,5 ± 0,5 ° C.
Передумови
Щорічно у всьому світі діагностується понад 900 000 нових випадків раку шлунка, і 42% цих випадків трапляються в Китаї [1]. Крім того, більше 30% запущених ракових захворювань шлунка співіснують із перитонеальною дисемінацією, а медіана часу виживання цих пацієнтів становить приблизно 6 місяців [2, 3].
Навіть після радикальної резекції шлунка понад 50% пацієнтів із запущеним раком шлунка можуть померти від рецидивів очеревини [3, 4]. В останні роки покращена виживаність, пов’язана з гіпертермічною внутрішньоочеревинною перфузійною хіміотерапією перитонеального карциноматозу раку шлунка [5, 6], була підтверджена як експериментальними [7], так і клінічними дослідженнями [5, 8]. Більше того, циторедукційна хірургія плюс гіпертермічна інтраперитонеальна перфузійна хіміотерапія стала пріоритетним методом лікування раку шлунка з перитонеальним карциноматозом [9], а виживання можна продовжити за допомогою інтраопераційної та ранньої післяопераційної інтраперитонеальної хіміотерапії [10, 11]. Таке лікування може призвести до своєчасної елімінації вільних ракових клітин в результаті оперативних факторів або спонтанного розповсюдження. Таким чином, гіпертермічна інтраперитонеальна перфузія вважається ефективною для профілактики та/або лікування перитонеального карциноматозу та сприяння виживанню [5, 12].
Однак гіпертермічна внутрішньочеревна перфузійна хіміотерапія збільшує періопераційні ускладнення та смертність у випадках запущеного раку шлунка [13–18]. Рівень захворюваності та смертності з 1999 по 2010 рр. Становив від 12% до 66,3% та від 0% до 12,5% відповідно [3].
Вважається, що рання перфузія призведе до додаткового збільшення ризику післяопераційних ускладнень та смертності. Відповідно, безпека ранньої гіпертермічної перфузії стала важливим питанням. Репарація анастомозу після реконструкції шлунково-кишкового тракту вважається одним з найважливіших факторів, що впливають на безпеку після операцій. Коли порушення анастомозу призводить до витоку, це може спричинити інфекцію черевної порожнини, адгезивні непрохідності кишечника, анастомотичну стриктуру і навіть септичний шок [14–16]. Хоча зниження якості життя не повинно бути причиною для заперечення цієї терапії [19], деякі дослідники вважають, що гіпертермія та хіміотерапевтичні засоби впливають на загоєння ран [20]. Крім того, гіпертермічна внутрішньоочеревинна перфузійна хіміотерапія після шлунково-кишкової операції дійсно збільшує ймовірність витоку анастомозу та періопераційну смертність [17, 21].
Як правило, ракові клітини ефективно елімінуються за допомогою гіпертермічної перфузії, якщо температура перевищує 42 ° C [22, 23], хоча гіпертермія більше 45 ° C призводить до незворотного пошкодження гепатоцитів [24]. Клавер та його колеги обстежили ад'ювантне лікування після циторедукційної операції з приводу карциноматозу очеревини на моделі щурів, і їх дослідження гіпертермічної внутрішньочеревної перфузії при 37 або 41 ° C вимагають подальших досліджень [25].
Більше того, було проведено мало досліджень для вивчення безпечного та оптимального діапазону температур для інтраопераційної та ранньої післяопераційної безперервної гіпертермічної інтраперитонеальної перфузії (IEPCHIP) при лікуванні перитонеального карциноматозу раку шлунка. Таким чином, ми провели дослідження IEPCHIP на свинячій моделі експериментальної дистальної резекції шлунка з реконструкцією Billroth II, щоб вивчити безпеку цієї процедури при діапазоні температур від 37 до 45 ° C.
Методи
Це дослідження було проведено відповідно до принципів Гельсінської декларації, а інституційні комісії з перевірки відповідних установ розглянули та затвердили його дизайн.
Створення та управління моделями
Було використано тридцять здорових та зрілих свиней Бама (15 самок та 15 самців). Тварин забезпечив міні-інкубатор для свиней з міста Тайчжоу провінції Цзянсу. Середня вага цих тварин становила 20 ± 2 кг.
Усі свині голодували протягом 12 годин до операції. Процедуру проводили під внутрішньовенною та інгаляційною анестезією. Ця ж команда хірургів виконувала всі процедури, щоб забезпечити технічну однорідність.
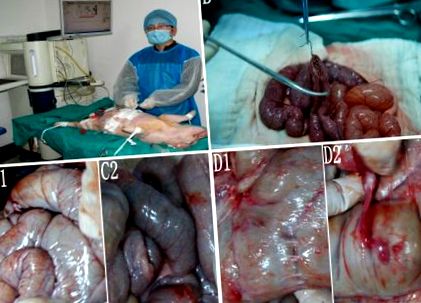
Свиней Бама були випадковим чином розділені на 5 груп. Групи А1 і А2 служили контрольними групами, а групи В, С і D представляли гіпертермічні перфузійні групи. Свиням групи А1 була проведена дистальна резекція шлунка з реконструкцією Білльта II (Рисунок 1А). Інші групи отримали IEPCHIP після того, як пройшли ту саму процедуру, що і група А1.
Процедура та післяопераційна адгезія. A, Ентероентеростомія. B, Гіпертермічна перфузія у моделі свиней. C1 і С2, У групах післяопераційної адгезії не спостерігалося A 2 і B. D1 і D2, Післяопераційна плівчаста і щільна адгезія спостерігалась у групі D.
До операції живіт готували голінням. Після досягнення задовільної анестезії у стерильних умовах ми провели дистальну резекцію шлунка та побудували гастроеюностомію та наскрізну єюноеєюностомію через серединний розріз із використанням 3–0 шовкових швів (Ethicon, Norderstedt, Німеччина). У групах A2, B, C і D два вихідні катетери розміщували під діафрагмою, а 2 припливних катетери розміщували в порожнині тазу кожної свині (рис. 1B). Катетери фіксували на навколишній шкірі 1–0 шовковими швами (Ethicon, Norderstedt, Німеччина). Потім усі розрізи шкіри зашивали, щоб закрити живіт.
Процедура IEPCHIP
Після перфузії ми використовували кілька пупків живота, щоб захистити розріз живота. Жодна свиня не отримувала їжу протягом 24 годин після операції, і всіх тварин внутрішньовенно обробляли 80 000 МО гентаміцину та 0,5 г метронідазолу в розчині глюкози та хлориду натрію в дозі 40 мл/кг. На третій день вводили рідку дієту без шлаків, а на шосту добу тварини отримували напіврідку дієту і поступово переводили на звичайний раціон. Післяопераційну внутрішньоочеревинну гіпертермічну перфузію також робили свиням під системною анестезією з прикріпленими ногами. Для полегшення болю вводили трамадол по 30 мг на день; це лікування продовжували протягом 3 днів поспіль після операції.
Спостережувані параметри
Ми вимірювали частоту дихання, артеріальний тиск, анальну температуру та частоту серцевих скорочень у свиней за 2 години до, під час та через 2 години після процедури. Ми також спостерігали післяопераційний стан експериментальних тварин, включаючи дефекацію, харчування, зміни активності та ваги, і класифікували результати кожної тварини після операції.
Периферичну венозну кров відбирали у всіх тварин до операції та через 1 день, 3 дні, 7 днів та 14 днів після операції. Оцінювали рівень глутаміно-піровиноградної трансамінази (ALT), альбуміну (ALB), загального білірубіну (TBIL), азоту сечовини в крові (BUN) та креатиніну (CR).
Тварин забивали через 14 днів після процедури, тоді ж проводили розтин.
Вимірювання анастомотичного тиску розриву, міцності на розрив та вмісту гідроксипроліну
Гідроксипролін забезпечує показник концентрації колагену, оскільки це найпоширеніша амінокислота в колагені. Для розрахунку вмісту гідроксипроліну застосовували хімічний колориметричний метод з аналітично чистими реагентами за такою формулою: вміст гідроксипроліну (мкг/мг вологої маси) = (поглинання спектрофотометричної трубки - поглинання порожньої пробірки/поглинання стандартної пробірки - поглинання порожньої пробірки ) × вміст стандартної речовини (5 мкг/мл) × загальний об’єм гідролізату (10 мл)/маса вологи в організації (мг).
Патологічне обстеження
Тканину анастомозу вирізали та зафіксували у 4% розчині формальдегіду за допомогою звичайних та стандартних процедур. Серійні 5-мкм зрізи парафінових блоків готували і фарбували гематоксилін-еозином (ВІН). Ці зразки оцінювали за допомогою світлової мікроскопії.
Статистичний аналіз
Всі експериментальні дані аналізували за допомогою статистичного програмного забезпечення SPSS18.0 (SPSS Inc, Чикаго, Іллінойс, США). Дані щодо функцій печінки та нирок виражали як середнє значення ± SD. Відмінності між групами аналізували та порівнювали за допомогою дисперсійного аналізу та критерію Ньюмана-Кельса. P значення менше 0,05 вважали статистично значущими.
Результати
Під час хірургічного втручання та перфузійних процедур серйозних ускладнень не відбулося.
Абдомінальна адгезія та анастомоз
Адгезія не була виявлена в групах А1, А2 (Малюнок 1, С1) або В (Малюнок 1, С2). У групі С. спостерігався лише 1 випадок з мембранозною адгезією. Мембранна адгезія та щільна адгезія спостерігались у 3 свиней групи D (рис. 1D1, D2).
Середній тиск розриву, міцність на розрив та вміст гідроксипроліну в анастомозі шлунка-тонкої кишки та анастомозі тонкої кишки та тонкої кишки в групах C та D були меншими за ті значення, що спостерігались у групах A1, A2 та B (рис.2).
Патологія
Утворення колагенових волокон всередині анастомозу було видно після фарбування ВІН. Порівняно з групами B, C та D, колаген був більш щільно відкладеним в анастомозі груп A1 і A2, з кращою грануляцією та утворенням тканин, а відновлення слизового шару було вищим у 2 групах (Рисунок 3, A1 і А2). У групі В осадження колагену було щільним в анастомозі (рис. 3В), а нерегулярне відкладення колагену було в менших кількостях у групі С, ніж у групі В (рис. 3С). Осадження колагену було найменш щільним у групі D і супроводжувалося запальною інфільтрацією клітин (рисунок 3D).
Патологічне дослідження анастомотичної тканини. А1 і А2, Колаген щільно осідав в анастомозі, з кращим відновленням слизового шару групами А1 і А2. B, Колаген щільно відкладався в анастомозі групи B тварини. C., Зменшене та нерегулярне відкладення колагену спостерігалося в анастомозі групи C. тварини. D, У анастомозі групи спостерігали зменшене та нерегулярне відкладення колагену та інфільтрацію запальних клітин D тварини.
Періопераційні життєві показники
Порівняно зі значеннями, отриманими до перфузії, температура тіла свиней у групах А1 та А2 була стабільною, як і частота серцевих скорочень, частота дихання та середній артеріальний тиск під час процедури. Крім того, після перфузії тварин у групах В і С температура тіла зросла в середньому приблизно на 1 ° С, частота серцевих скорочень зросла в середньому до 105 ударів на хвилину, частота дихання збільшилася до 35 разів на хвилину, а середній артеріальний тиск знизився приблизно на 25 мм рт. Через дві години після процедури у цих тварин показники життєдіяльності досягли нормального рівня. У групі D середня температура зросла на 1,5 ° C, частота серцевих скорочень зросла приблизно до 120 ударів на хвилину, частота дихання зросла до 40 разів на хвилину, а середній артеріальний тиск знизився приблизно на 35 мм рт. Життєві показники цих тварин не повернулись до нормального рівня протягом 2 годин після процедури.
Післяопераційне відновлення
Усі свині були схильними протягом більшої частини першої доби. Усі свині груп А1, А2, В і С могли стояти і ходити через 1 день після процедури. Через 2 дні тварини змогли пити і їсти. Після процедури лише 1 свиня в групі С двічі вирвала в перший день. Крім того, психічний статус та стан працездатності тварин були справедливими. Однак тварини групи D не могли стояти на наступний день після процедури, і три свині безперервно стогнали. Через два дні тварини могли лише пити, але на третій день ці свині почали їсти. У групі D одна свиня відчувала блювоту 2 рази в перший день; а інша свиня блювала 6 разів на день протягом 3 послідовних днів.
Функція печінки та нирок
Рівні ALT, TBIL та ALB у свиней у групах А1 та А2 залишалися стабільними. При температурі перфузії 37 ± 0,5 ° C, 42,5 ± 0,5 ° C і 43,5 ± 0,5 ° C 60-хвилинна безперервна гіпертермічна внутрішньочеревна перфузія не мала значного впливу на функцію печінки або нирок. Через 1 тиждень свині групи А1 та А2 відновились до нормального рівня. Навпаки, при температурі 44,5 ± 0,5 ° C 60-хвилинна безперервна гіпертермічна внутрішньочеревна перфузія серйозно погіршувала функції печінки та нирок тварин. Це порушення функції нирок та печінки тривало щонайменше 2 тижні. Параметри, що стосуються функцій печінки та нирок, наведені в таблицях 1, 2 та 3 для свиней груп B, C та D.
Обговорення
В попередніх дослідженнях проводили інтраопераційну гіпертермічну внутрішньоочеревинну хіміотерапію (IHIC) та IHIC у поєднанні з ранньою післяопераційною інтраперитонеальною хіміотерапією [10, 26–28]. У цих дослідженнях повідомлялося про покращення виживання, хоча з певними рівнями смертності та важкими ускладненнями [11, 29]. Метою IEPCHIP є знищення вільних ракових клітин та видалення мікроосередків на ранніх термінах після циторедуктивної операції.
Під час процесу перфузії життєві показники досліджуваних тварин різнились у різних групах перфузії. Свині груп А1, А2, В і С швидко одужали і їли і пили швидше після операції, ніж свині групи D. Як було показано вище, перфузат 44,5 ± 0,5 ° С мав значний і тривалий вплив на життєвий стан тварин ознаки та дієта.
Також на печінку може впливати анестезія та гіпертермічна внутрішньочеревна хіміотерапія. В одному з попередніх досліджень функції печінки та нирок мишей у групі гіпертермічної інтраперитонеальної хіміотерапії, яка отримувала лікування при 41 ° C, суттєво не відрізнялися від групи нормальної температури, яка отримувала застосування паклітакселу та бета-циклодекстрину [30]. В цих дослідженнях вважалося, що тепловий стрес спричиняє пошкодження печінки, яке з часом посилюється і вважається, що воно виникає внаслідок низки складних реакцій на окислювальний стрес [31]. У цьому експерименті зміни функції печінки та нирок у групах А2, В та С були оборотними. Перфузія при 37 ± 0,5 ° C, 42,5 ± 0,5 та 43,5 ± 0,5 ° C також спричинила тимчасове та м’яке підвищення відповідних фізіологічних показників. Тим не менше, перфузія при 44,5 ± 0,5 ° C призвела до значних змін цих параметрів, що призвело до очевидної дисфункції печінки та нирок. Дві перфузії, виконані при 44,5 ± 0,5 ° C, викликали тривале і очевидне порушення функції печінки та нирок.
Оскільки показники виживання покращились після циторедукційної хірургії та IEPCHIP при раку шлунка, слід ретельно контролювати токсичність додаткової хіміотерапії. У метааналізі рандомізованих контрольованих досліджень гіпертермічної інтраперитонеальної хіміотерапії резектабельного раку шлунка післяопераційна смертність 6 досліджень становила 2,6% (10/385) [11]. У багатоінституційному дослідженні 1290 пацієнтів, яке вивчало лікування перитонеального карциноматозу неоваріального походження шляхом циторедукційної хірургії та періопераційної внутрішньочеревної хіміотерапії, рівень смертності становив 4,1% [28]. В іншому багатоінституційному дослідженні, яке вивчало циторедуктивну хірургію в поєднанні з інтраопераційною та післяопераційною інтраперитонеальною хіміотерапією перитонеального карциноматозу від раку прямої кишки, відповідна смертність становила 4% (20/506) [29].
Додаткова хіміотерапія може бути надмірно ризикованою для цих пацієнтів, і можливе збільшення кількості стовбурових клітин раку після хіміотерапії викликає подальше занепокоєння [38]. Гіпертермічна перфузія також може бути ефективною, забезпечуючи кращу якість життя без деяких ускладнень, що спостерігаються після процедур при запущеному раку шлунка. Крім того, циторедукційна хірургія з гіпертермічною внутрішньочеревною хіміотерапією продовжує виживання при значній захворюваності та смертності у пацієнтів похилого віку [39]. Гіпертермічна внутрішньочеревна перфузія без хіміотерапії може бути особливо придатною для пацієнтів літнього віку з низьким рівнем працездатності або тих, хто не може переносити хіміотерапію. Тому ми провели інтраопераційну та ранню післяопераційну безперервну гіпертермічну інтраперитонеальну перфузію без хіміотерапії 34 пацієнтам із запущеним раком шлунка з 2011 року.
З вищезазначених причин поточне дослідження було зосереджене на визначенні допустимого діапазону температур, що є основою гіпертермічної внутрішньочеревної перфузії з хіміотерапією або без неї.
Висновки
Ми виявили, що IEPCHIP при 42,5 ± 0,5 ° C не суттєво шкодить свиням-реципієнтам з точки зору їх життєвих показників, функції печінки, функції нирок та зцілення анастомозу. Крім того, не було додаткового ризику витоку анастомозу та спайки живота. Таким чином, перфузія при 42,5 ± 0,5 ° C була безпечною та придатною для IEPCHIP, тоді як перфузія при 43,5 ± 0,5 ° C або 44,5 ± 0,5 ° C була шкідливою і показала, що значно погіршує зцілення анастомозу.
- Салат, вирощений у космосі, безпечно їсти, говорить дослідження; смачно, кажуть космонавти
- Рекорд температури Росії за полярним колом
- Ожиріння та цільова інтраопераційна рідинна терапія - Повний текст
- Натуральні аромати Найкращий путівник безпечним - ідеальний кето
- Безпечний бодібілдінг Більше м’язів з меншою кількістю дієтичного білка