Автофагія та періодичне голодування: зв’язок для терапії раку?
Фернанда Антунес
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Адольфо Гарсія Ерустес
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Анжеліка Джардім Коста
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Ана Кароліна Насіменто
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Клаудія Бінколетто
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Родріго Портес Урешино
II Departamento de Ciencias Biologicas, Університет Сан-Паулу, Діадема, Іспанія
Густаво Хосе Сільва Перейра
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Сорая Субхі Смайлі
I Departamento de Farmacologia, Escola Paulista de Medicina, Федеральний університет Сан-Паулу (EPM-UNIFESP), Сан-Паулу, SP, BR
Анотація
Автофагія: визначення та механізми
Протягом останнього десятиліття аутофагія привертала значну увагу як потенційна мета фармакологічних агентів або дієтичних втручань, які гальмують або активізують цей процес для ряду розладів людини, включаючи інфекції та запальні захворювання 22, нейродегенерацію 23, метаболічні та серцево-судинні захворювання 24, ожиріння 25 та рак 26, 27 .
Автофагія та рак
Терапія аутофагії та раку
Оскільки аутофагія може пригнічувати розвиток пухлини або сприяти росту пухлини, прогресуванню, інвазії та резистентності до лікування, дослідники припустили, що модуляція аутофагії може бути новою терапевтичною стратегією у лікуванні деяких злоякісних пухлин 28, 49, 50 .
Як обмеження дієти модулює аутофагію та терапію раку?
У доклінічних дослідженнях було показано, що обмеження в харчуванні (ДР) продовжує тривалість життя та зменшує розвиток вікових захворювань, таких як діабет, рак, а також нейродегенеративні та серцево-судинні захворювання 63. DR сприяє метаболічним та клітинним змінам в організмах від прокаріотів до людей, які дозволяють адаптуватися до періодів обмеженої доступності поживних речовин 64. Основні зміни включають зниження рівня глюкози в крові та сигналізації про фактор росту та активацію шляхів стійкості до стресу, що впливають на ріст клітин, енергетичний обмін та захист від окисного стресу, запалення та загибелі клітин 64, 65. Голодне поживне речовина також активує аутофагію в більшості культивованих клітин та органів, таких як печінка та м’язи, як пристосувальний механізм до стресових станів 11, 66 .
Дослідження демонструють, що дієтичні втручання можуть зменшити частоту пухлин та посилити ефективність хіміо- та променевої терапії в різних моделях пухлин, підкреслюючи дієтичні маніпуляції як можливе доповнення до стандартних методів лікування раку 63, 65. Серед багатьох режимів дієти, які були оцінені, обмеження калорій (CR) та голодування є методами, що піддаються інтенсивному дослідженню в онкології 63, 65, 67. CR визначається як хронічне зменшення добової норми споживання калорій на 20-40% без недоїдання та з підтримкою частоти прийому їжі 68. На відміну від цього, голодування характеризується повним позбавленням їжі, але не води, з проміжними періодами нормального прийому їжі. Залежно від тривалості голодування можна класифікувати як (i) періодичне голодування (IF - наприклад, чергування на день (≥16 годин) або 48 годин голодування на тиждень) або (ii) періодичне голодування (PF - наприклад, мінімум 3 дні голодування кожні 2 або більше тижнів) 65. У цій статті ми не розглядаємо дослідження CR, які були розглянуті в інших місцях 63, 68, 69; натомість ми зосереджуємось на дослідженнях, що використовують протоколи ІФ як допоміжний засіб для лікування раку у тварин та людей.
Хоча результати поєднання ІФ із протипухлинними препаратами обнадійливі, молекулярні механізми не зовсім зрозумілі. Лі та ін. 81 продемонстрували, що ІФ (48-годинне голодування) знижує рівень глюкози та IGF-1 відповідно на 60% та 70% на моделі тварини з раком молочної залози. У моделі раку товстої кишки ІФ пригнічував ріст пухлини, не спричиняючи постійної втрати ваги, та зменшував поляризацію M2 тумор-асоційованих макрофагів у мишей. Дані in vitro показали індукцію аутофагії та зниження регуляції CD73 з подальшим зменшенням позаклітинного аденозину та пригніченням поляризації M2 через інактивацію JAK1/STAT3 82 .
Комбінація ІФ та інгібіторів тирозинкінази, таких як ерлотиніб, гефітиніб, лапатиніб, кризотиніб та регорафеніб, сприяла стійкому інгібуванню шляху MAPK, що призводить до антипроліферативних ефектів на моделях клітин раку молочної залози, прямої кишки та легенів, а також до інгібування пухлини ріст у моделі in vivo раку легенів 77. Поєднання IF та інгібітора мульти-тирозинкінази сорафеніб виявляло адитивний ефект у пригніченні проліферації клітин гепатокарциноми та поглинання глюкози, а також знижуючи регуляцію шляху MAPK та експресію генів BIRC5, DKK1, TRIB3 та VEGF, які зазвичай змінюються у гепатокарциномі клітини 72. При раку підшлункової залози голодування збільшувало поглинання гемцитабіну завдяки підвищеному рівню його транспортера (hENT1), тим самим посилюючи загибель клітин. У моделі раку підшлункової залози на ксенотрансплантаті цикли голодування та лікування гемцитабіном викликали зменшення росту пухлини більш ніж на 40% 74 .
Таблиця 1
| Рак молочної залози, стійкий до гормонів рак передміхурової залози, повторний рак передміхурової залози | Хіміотерапія + низькокалорійна дієта | В даний час набір учасників | > NCT01802346 |
| Розширений метастатичний рак передміхурової залози | Хіміотерапія + голодування та харчова терапія | В даний час набір учасників | > NCT02710721 |
| HER2 Негативний рак молочної залози | Хіміотерапія + дієта, що імітує голодування | В даний час набір учасників | > NCT02126449 |
| Рак молочної залози | Хіміотерапія + короткочасне голодування (ІФ) | ІФ, пов’язаний з хіміотерапією, добре переноситься, знижує гематологічну токсичність у пацієнтів з HER2-негативним БЦ, а також індукує більш швидке відновлення пошкодження ДНК у PBMC (мононуклеарні клітини периферичної крові) | > NCT01304251 (96) |
| Гінекологічне ракове захворювання (рак яєчників та молочної залози) | Хіміотерапія + короткочасне голодування | Завершено, результати не повідомляються | > NCT01954836 |
| Рак молочної залози | Хіміотерапія + короткочасне голодування | Завершено, результати не повідомляються | > NCT02379585 |
| Злоякісне новоутворення | Короткочасне голодування до системної хіміотерапії | Активний | > NCT01175837 |
| Злоякісне новоутворення | Хіміотерапія + голодування | Завершено, результати не повідомляються | > NCT00757094 |
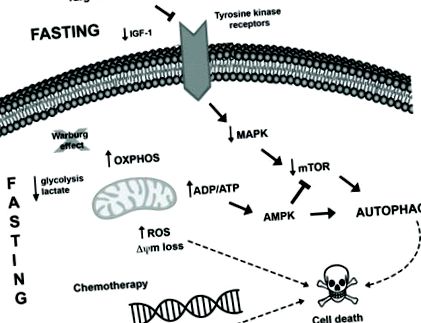
Ще однією новою фармакологічною терапевтичною стратегією, яка в даний час досліджується для лікування раку, є поєднання міметиків обмеження калорій (CRM) з цитотоксичними агентами. CRM - це сполуки, які мають різну хімічну структуру та імітують біохімічні та функціональні ефекти CR, такі як активація AMPK та інгібування mTOR, що призводить до індукції аутофагії, виснаження ацетил-КоА та АТФ та зменшення використання глюкози без викликаючи дискомфорт CR 88. Кілька досліджень продемонстрували супресивний до пухлини ефект агентів CRM, наприклад, 2-дезокси-глюкоза 89, метформін 90, 91, інгібітори mTOR 92, ресвератрол 73, 93, гідроксицитрат 73, спермідин 73, 94 та природні сполуки, такі як куркумін 95, у поєднанні з протипухлинними методами лікування на різних моделях раку. Можливі зв’язки між посиленням голодування та протипухлинною терапією в пухлинних клітинах узагальнені на рисунку 1 .
Можливі молекулярні механізми, індуковані голодуванням та протипухлинним лікуванням, щоб сприяти внутрішньоклітинним змінам та індукції аутофагії в клітинах пухлини. I) Голодування може протистояти ефекту Варбурга (розпад глюкози шляхом гліколізу навіть у присутності кисню), сприяючи окислювальному фосфорилюванню в клітинах пухлини і приводячи до збільшення продукування АФК та зниження рівня лактату та, можливо, АТФ. Збільшення співвідношення ADP/ATP може активувати шлях AMPK, що призводить до індукції аутофагії. Більше того, стійке стресове середовище може призвести до індукції клітинної загибелі. II) Кілька пухлин містять мутації, які сприяють гіперактивації шляху MAPK, що забезпечує ріст, виживання та проліферацію клітин пухлини. Терапії, спрямовані на цей шлях, а також голодування можуть призвести до зниження регуляції цього шляху поряд із зменшенням активації AKT та mTOR, що призведе до індукції аутофагії та загибелі клітин. III) Крім того, голодування посилює згубні наслідки хіміотерапії, такі як пошкодження ДНК, активізуючи таким чином механізм клітинної загибелі, дерегулюючи про- та антиапоптотичні білки та викликаючи мітохондріальні зміни та активацію каспази, що в свою чергу завершується апоптозом.
У цьому огляді ми висвітлили концепції аутофагії, особливо стосовно туморогенезу, а також потенціал аутофагії як терапевтичної мішені при лікуванні різних злоякісних пухлин. Ми також вказали на можливість використання дієтичних маніпуляцій як модулятора аутофагії, а також економічно ефективне втручання для підвищення терапевтичної реакції на складній онкологічній арені. Крім того, голодування може захистити нормальні клітини від токсичності протипухлинних засобів, зменшуючи побічні ефекти у пацієнтів та збільшуючи шкідливий вплив хіміотерапії, променевої терапії та цілеспрямованої терапії на пухлинні клітини. Однак необхідні додаткові дослідження для кращого розуміння молекулярних механізмів, які викликає голодування, з метою виявлення контексту, в якому голодування може бути корисним як доповнення до лікування раку. Більше того, подальші знання можуть також призвести до розробки нових фармакологічних протоколів, які повторюють ефекти, подібні до ефектів голодування, і є більш придатними для різних онкологічних пацієнтів.
ВНОСИ АВТОРА
Антунес Ф сприяв розробці дослідження, написав більшу частину дослідження та відредагував рукопис. Рукопис написали Erustes AG, Costa AJ, Nascimento AC та Trindade CB. Урешино Р.П., Перейра Дж. Дж. Та Смайлі С.С. написали, спроектували та координували дослідження, відредагували та переглянули остаточну версію рукопису. Усі автори розглянули та затвердили остаточну версію рукопису.
ПОДЯКИ
Автори висловлюють подяку за фінансову підтримку Фонду Ампаро на Пескізі до Сан-Паулу (FAPESP) (08/11515-3 та 13/20073-2 від Smaili SS), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq ) та Coordenação de Aperfeiçoamento de Pessoal de Ensino Superior (CAPES).
Виноски
Не повідомлялося про потенційний конфлікт інтересів.
- 10 Доказові переваги для здоров’я від періодичного голодування
- 5 найефективніших методів періодичного голодування - DefatX
- Підхід до лімфоцитозу - радник терапії раку
- Згідно з новим дослідженням, ваше періодичне голодування не означає; t робити що завгодно
- Цетуксимаб у поєднанні з іринотеканом у терапії першої лінії метастатичного колоректального раку (CRYSTAL