Антиатеросклеротична ефективність олмесартану
Анотація
Вступ
Для з'ясування антиатеросклеротичного механізму антагоніста AT1-рецепторів у приматів ми дослідили, чи впливає антагоніст AT1-рецептора, олмесартан, на функцію ендотелію та сироваткові маркери запалення та фактори росту у мавп, яких годували дієтою з високим вмістом холестерину.
Методи
Експериментальний протокол
Мавпи (Macaca fascicularis, n = 18) обох статей були придбані у компанії Keari Co (Осака, Японія). Вага тіла цих мавп коливався від 4,3 до 6,2 кг. Усі мавпи утримувались при кімнатній температурі (23–26 ° C) з 12-годинним циклом світло-темрява і мали вільний доступ до їжі та води. Шість мавп годувались нормальним харчуванням протягом 6 місяців (група з нормальним харчуванням). Дванадцять мавп, яких годували дієтою з високим рівнем холестерину протягом 6 місяців, були порівну розділені на контрольну групу з високим рівнем холестерину та групу, якій давали олмесартан медоксоміл (10 мг/кг/добу, перорально). Дієта з високим вмістом холестерину, яка містила 4% холестерину та 6% кукурудзяної олії, та звичайна дієта були придбані у Oriental Yeast Co (Osaka).
На початковому етапі та через 1 місяць, 3 місяці та 6 місяців систолічний АТ (SBP) та частоту серцевих скорочень контролювали безпосередньо за допомогою катетера (Suflo) (Термо, Токіо, Японія) з датчиком у мавп під наркозом кетаміну гідрохлоридом (10 мг/кг внутрішньом’язово). Зразки крові відбирали для вимірювання рівня ліпідів на початковому рівні та через 2 місяці, 4 місяці та 6 місяців. Наприкінці 6-місячного періоду лікування мавп знеболювали кетаміном гідрохлоридом (10 мг/кг внутрішньом’язово) і вбивали знекровленням. Низхідні грудні аорти швидко видаляли для гістологічного та біохімічного аналізу.
Рівень ліпідів у плазмі крові
Рівні загального холестерину, холестерину ліпопротеїдів низької щільності (ЛПНЩ) та холестерину ліпопротеїнів високої щільності (ЛПВЩ) вимірювали на початковому рівні та через 2 місяці, 4 місяці та 6 місяців за допомогою автоматичного ліпідного аналізатора (7250, Hitachi, Токіо, Японія ).
Гістологічний аналіз
Вимірювали площі атеросклеротичних уражень грудної аорти. 5 Грудна аорта була зафіксована забуференним формаліном. Тканину, що фіксується, фарбували Oil Red O для візуалізації присутності відкладень ліпідів на поверхні інтими. Атеросклеротичну площу розраховували як відношення зафарбованої олійно-червоним-O-плями до загальної площі поверхні за допомогою аналізатора зображення (VM-30, Olympus, Токіо). Імунофарбування антитілами до макрофагів використовували для фарбування тканини, використовуючи антитіло HAM-56 (DAKO Corporation, Carpinteria, CA, USA). 10
Судинна реакція
Сонні артерії видаляли для експериментів з розслаблення судин. Артерії були розрізані на гвинтові смужки довжиною 15 мм і шириною 2,0 мм. Смужку артерії помістили на міограф під напругою у спокої 2,0 г. Середовищем для купання був розчин Тирода (137 ммоль/л хлориду натрію, 2,7 ммоль/л хлориду калію, 1,8 ммоль/л хлориду кальцію, 1,1 ммоль/л хлориду магнію, 0,42 ммоль/л дигідрофосфату натрію, 12 ммоль/л бікарбонату натрію та 5,7 ммоль/л глюкози, рН 7,4). Середовище підтримували при 37 ° С і безперервно барботували з 5% СО2 в кисні. Після періоду рівноваги артерію стискали норадреналіном (1 мкмоль/л), а потім розслабляли ацетилхоліном залежно від дози (10 нмоль/л до 1 мкмоль/л). 11
Маркери сироватки
Набори ІФА використовувались для визначення сироваткових рівнів трансформуючого фактора росту (TGF) -β1, фактора, що стимулює колонію макрофагів (M-CSF), і молекули внутрішньоклітинної адгезії (ICAM) -1 (R&D Systems, Міннеаполіс, Мічиган, США).
Статистичний аналіз
Усі результати представлені як середнє значення ± стандартна похибка середнього значення. Відмінності вважалися значними на P
Результати
Загальні умови
Усі мавпи здавались здоровими, і не було різниці у масі тіла, СБП або частоті серцевих скорочень серед тварин групи нормального харчування та тварин групи високого рівня холестерину, які отримували олмесартан або не отримували лікування через 1 місяць, 3 місяців і 6 місяців.
Рівень ліпідів у плазмі крові
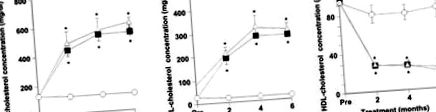
Через 2 місяці, 4 місяці та 6 місяців рівні загального та холестерину ЛПНЩ у групі з високим рівнем холестерину були значно вищими, ніж у групі з нормальним харчуванням (P Фігура 1
Гістологічний аналіз
На малюнку 2 показані сегменти аорти, забарвлені Олійним Червоним O від трьох груп мавп. Ділянки атеросклеротичних уражень в грудних аортах не спостерігались у групі із нормальним харчуванням. У групі з високим рівнем холестерину дієта відношення атеросклеротичної площі до загальної площі становила 72 ± 6%, тоді як у групі, яка харчувалася дієтою з високим вмістом холестерину та лікуванням олмесартаном, це співвідношення було значно зменшено до 25 ± 14% (P Малюнок 2
Сегменти аорти, забарвлені Олійним Червоним O від мавп, яких годували (a) нормальне харчування, (b) дієта з високим вмістом холестерину та (c) дієта з високим вмістом холестерину плюс лікування олмесартаном (10 мг/кг/добу).
На малюнку 3 представлені типові фотографії поперечних зрізів аорти з груп, яким годували нормальну дієту, дієту з високим вмістом холестерину та дієту з високим вмістом холестерину, а також лікування олмесартаном. Інтимальна зона та відношення інтимної зони до медіальної в групі з високим рівнем холестерину були значно зменшені при лікуванні олмесартаном (P Малюнок 3
Типові поперечні зрізи грудних аорт мавп, яких годували (a) нормальне харчування, (b) дієта з високим вмістом холестерину та (c) дієта з високим вмістом холестерину плюс лікування олмесартаном (10 мг/кг/добу).
Судинна реакція
Ацетилхолін (10–1000 нмоль/л) викликав ендотелій-залежну релаксацію в залежності від концентрації у всіх групах. Ендотелій-залежне розслаблення у групі з високим рівнем холестерину в раціоні було значно знижено порівняно з такою в групі з нормальним харчуванням (P
Обговорення
Проліферація інтимної зони атеросклеротичних уражень головним чином залежала від накопичення макрофагів. Ці висновки також спостерігались при атеросклеротичних ураженнях людини. 19,20 Кейдар повідомив, що А II викликає модифікацію ЛПНЩ до окисленого ЛПНЩ, який потрапляє в макрофаги, щоб стимулювати утворення пінних клітин. 21 Ангіотензин II також індукує накопичення макрофагів шляхом індукції моноцитарного хемоаттрактантного білка-1, який, як відомо, індукує активацію та міграцію моноцитів. Більше того, у цьому дослідженні олмесартан схильний знижувати рівні M-CSF та ICAM-1 у сироватці крові, що також викликає інфільтрацію моноцитів у інтимний шар та активацію макрофагів, і ці дії можуть також зменшити накопичення макрофагів. в інтимному шарі. Тому зменшення накопичення макрофагів в інтимному шарі за допомогою олмесартану може бути основним механізмом придушення інтимної зони.
Ендотеліальна дисфункція спостерігалася при атеросклеротичних ураженнях у пацієнтів та на атеросклеротичних моделях. 23,24 В інтимному шарі атеросклеротичних уражень активовані макрофаги індукують утворення супероксиду шляхом активації 12- або 15-ліпоксигеназ. 23 Спостерігається, що клітини гладких м'язів, активовані A II, також індукують NAD (P) H-залежні оксидази, які сприяють утворенню супероксиду. 7 Збільшення утворення супероксиду в інтимному шарі індукує дисфункцію ендотелію за рахунок зменшення синтезу оксиду азоту з клітин ендотелію. 24 У цьому дослідженні дієта з високим вмістом холестерину значно зменшила релаксацію, спричинену ацетилхоліном, ендотелієм залежним вазодилататором, припускаючи, що судинні тканини атеросклеротичних уражень виявляють дисфункцію ендотелію, що є першим кроком у розвитку атеросклеротичного нальоту. Індукований ацетилхоліном релаксація у тих мавп, які харчуються дієтою з високим вмістом холестерину, значно покращився олмесартаном. Таким чином, антиатеросклеротичний спосіб дії олмесартану може брати участь у поліпшенні дисфункції ендотелію.
На закінчення, антиатеросклеротичний ефект, який спостерігається при застосуванні олмесартану, зумовлюється придушенням факторів росту, хемокінів та молекул адгезії, інгібуванням макрофагів в інтимних шарах та полегшенням дисфункції ендотелію.
Список літератури
Дзау В.Й. Патобіологія атеросклерозу та ускладнень нальоту Am Heart J 1994 рік 128: 1300–1304
Спенс Дж. Д., Пезаут А. Б., Мелмон КЛ. Вплив антигіпертензивних препаратів на швидкість крові у резус-мавп Інсульт 1977 рік 8: 589–594
Пісня К та ін. Індукція ферментів, що перетворюють ангіотензин, та рецепторів ангіотензину II в атеросклеротичній аорті мавп Cynomolgus, що харчуються Атеросклероз 1998 рік 138: 171–182
Міядзакі М, Такаї С. Антиатеросклеротичний ефект алацеприлу, інгібітора ангіотензинперетворюючого ферменту, у мавп, які харчуються дієтою з високим вмістом холестерину Hypertens Res 1999 рік 22: 49–54
Міядзакі М, Саконджо Х, Такай С. Антиатеросклеротичні ефекти інгібітора ангіотензинперетворюючого ферменту та антагоніста ангіотензину II у мавп Cynomolgus, які харчуються дієтою з високим вмістом холестерину Br J Pharmacol 1999 рік 128: 523–529
Ернандес-Преса М та ін. Інгібування ангіотензин-перетворюючого ферменту запобігає активації артеріального ядерного фактора-каппа В, експресії білка-хемоаттрактанта моноцитів та інфільтрації макрофагів у кролячої моделі раннього прискореного атеросклерозу Тираж 1997 рік 95: 1532–1541
Ворнгольц А та ін. Збільшення опосередкованого НАДН-оксидазою вироблення супероксиду на ранніх стадіях атеросклерозу: докази участі системи ренін-ангіотензин Тираж 1999 рік 99: 2027–2033
Кім Дж., Берлінер Дж., Надлер Дж. Ангіотензин II збільшує зв’язування моноцитів з ендотеліальними клітинами Biochem Biophys Res Commun 1996 рік 226: 862–868
Накано Н та ін. Негативна регуляція експресії місцевого фактора росту гепатоцитів ангіотензином II та трансформаційний фактор росту-бета в судинах: потенційна роль HGF у серцево-судинних захворюваннях Гіпертонія 1998 рік 32: 444–451
Нісімото М та ін. Залежне від хімази утворення ангіотензину II в підшкірній вені проти внутрішньої грудної артерії J Thorac Cardiovasc Surg 2001 рік 121: 729–734
Санц М, Ганадо П, Руїз Е, Теджеріна Т. Вплив трандолаприлу на судинну реакцію в холестеринових артеріях, ізольованих на кроликах Eur J Pharmacol 2000 рік 397: 359–365
Солом'яний СБ та ін. Пригнічення раннього атерогенезу лозартаном у мавп з індукованою дієтою гіперхолестеринемією Тираж 2000 рік 101: 1586–1593
Постон Р.Н. та ін. Експресія молекули міжклітинної адгезії-1 в атеросклеротичних бляшках Am J Pathol 1992 рік 140: 665–673
Раджавашіст туберкульоз та ін. Індукція експресії ендотеліальних клітин гранулоцитарних та макрофагових колонієстимулюючих факторів модифікованими ліпопротеїдами низької щільності Природа 1990 рік 344: 254–257
Ішібаші С та ін. Моноцитарний колонієстимулюючий фактор підсилює поглинання та деградацію ацетильованих ліпопротеїдів низької щільності та етерифікацію холестерину в макрофагах, отриманих моноцитами людини J Biol Chem 1990 рік 265: 14109–14117
Вейр М.Р., Дзау В.Дж. Система ренін-ангіотензин-альдостерон: конкретна мішень для лікування гіпертонії Am J Hypertens 1999 рік 12: 205S – 213S
Laviades C, Varo N, Diez J. Трансформація фактора росту бета у гіпертоніків із пошкодженням серцево-ниркової системи Гіпертонія 2000 рік 36: 517–522
Кіараш А та ін. Посилена регуляція експресії молекули міжклітинної адгезії серця щура в ангіотензині II, але не гіпертензії, спричиненої фенілефрином Гіпертонія 2001 рік 37: 58–65
Окамура А та ін. Посилення регуляції ренін-ангіотензинової системи під час диференціювання моноцитів до макрофагів J Гіпертенс 1999 рік 17: 537–545
Фукухара М та ін. Експресія ангіотензин-перетворюючого ферменту при атеросклерозі сонної артерії людини Гіпертонія 2000 рік 35: 353–359
Кейдар С. Ангіотензин, перекисне окислення ЛПНЩ та атеросклероз Life Sci 1998 рік 63: 1–11
Чен XL та ін. Ангіотензин II індукує експресію гена білка-1 хемоаттрактанта моноцитів у клітинах гладких м’язів судин щурів Circ Res 1998 рік 83: 952–959
Scheidegger KJ, Butler S, Witztum JL. Ангіотензин II збільшує макрофагів-опосередковану модифікацію ліпопротеїдів низької щільності через ліпоксигеназно-залежний шлях J Biol Chem 1997 рік 272: 21609–21615
Прасад А та ін. Гострий та хронічний антагонізм рецепторів ангіотензину-1 зволікає ендотеліальну дисфункцію при атеросклерозі Тираж 2000 рік 101: 2349–2354
Подяки
Це дослідження було частково підтримано грантом для заохочення молодих вчених 12770048, грантом для наукових досліджень (B) 11470027 від Міністерства освіти, науки, спорту та культури, Японія.
Інформація про автора
Приналежності
Кафедра фармакології Медичного коледжу Осаки, Осака, Японія
M Miyazaki & S Takai
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Права та дозволи
Про цю статтю
Цитуйте цю статтю
Міядзакі, М., Такаї, С. Антиатеросклеротична ефективність олмесартану. J Hum Hypertens 16, S7 – S12 (2002). https://doi.org/10.1038/sj.jhh.1001393
Опубліковано: 24 квітня 2002 р
Дата випуску: 01 травня 2002 р
Ключові слова
- ангіотензин II
- атеросклероз
- блокатор рецепторів
- мавпа
- олмесартан
Подальше читання
Лікування артеріальної гіпертензії блокаторами рецепторів ангіотензину: Сучасні дані та роль олмесартану
Серцево-судинна терапія (2018)
Знято: Молекулярні механізми придушення ірбесартану атеросклерозу у нокаутованих мишей аполіпопротеїну Е з високим рівнем холестерину
- Руй Яо
- , Сян Ченг
- , Йонг Чень
- , Цзян-Цзяо Се
- , Сянь Ю.
- , Мен-Ян Ляо
- , Ін-Цзюнь Дінь
- , Тін-Тін Тан
- & Ю-Хуа Ляо
Міжнародний кардіологічний журнал (2010)
Чи існують ефекти антагоністів системи ренін – ангіотензин поза контролем артеріального тиску?
Американський кардіологічний журнал (2010)
Сприятливе серцеве та аортальне ремоделювання у спонтанно гіпертонічних щурів, які отримували олмесартан
- Кароліна Фернандес-Сантос
- , Леонардо де Соуза Мендонса
- & Карлос Альберто Мандарим-де-Ласерда
Серце і судини (2009)
Ефективність та безпека олмесартану медоксомілу окремо та у комбінації з гідрохлоротіазидом
Експертний огляд серцево-судинної терапії (2009)
- Статті Європейський журнал генетики людини
- Збільшена здатність периферичного вивільнення серотоніну при ожирінні людини
- Астаксантин, каротиноїд, що має потенціал для здоров’я людини та харчування Журнал натуральних продуктів
- Новий метод призначення енергії для поліпшення схуднення - Frost - 1991 - Journal of Human
- Чи пов’язані аденовірус людини-5 та 36 із ожирінням у дитячому журналі дослідницької медицини