Амфетамін маніпулює рівнем та поведінкою моноаміноксидази-А, використовуючи тераностичні аптамери факторів транскрипції AP-1/NF-kB
Анотація
Передумови
Ферменти моноаміноксидази (МАО) відіграють важливу роль у контролі катаболізму моноамінових нейромедіаторів та біогенних мікроамінів та поведінки у людей. Однак механізми, що регулюють МАО, незрозумілі. Кілька білків фактора транскрипції пропонуються для модуляції транскрипції МАО ген, але дані, що підтверджують ці гіпотези, суперечливі. Ми мали на меті дослідити механізм білків-регуляторів транскрипції генів на індуковану амфетаміном поведінку. Ми застосували аптамери, що містять послідовність зв'язування ДНК, а також випадкову послідовність (без мішені) для вивчення модуляції індукованих амфетаміном рівнів МАО та гіперактивності у живих мишей.
Методи
Ми попередньо обробляли дорослих самців мишей C57black6 (Taconic Farm, Germantown, NY) (n ≥ 3 послідів за раз), віком від 2 до 3 місяців (вага тіла 23 ± 2 г) з дволанцюжковими (ds) аптамерами ДНК з послідовністю специфічно для активатора білка-1 (5ECdsAP1), ядерного фактора-каппа-бета (5ECdsNF-kB), спеціального білка-1 (5ECdsSP-1) або циклічногоAMP, що реагує на зв'язування білка (5ECdsCreB), ділянок зв'язування з білками, 5ECdsRan [випадкова послідовність без мішені], одноланцюговий AP-1 (5ECssAP-1) (8 нмоль ДНК на кг) або фізіологічний розчин (5 мкл, внутрішньоцеребровентрикулярна [icv] ін’єкція) перед введенням амфетаміну (4 мг/кг, в/в). Потім ми вимірювали та аналізували рухову активність та рівень активності МАО-А та МАО-В.
Результати
У патологічному стані впливу амфетаміну ми показали тут, що попередня обробка 5ECdsAP1 та 5ECdsNF-kB скасувала зменшення активності МАО-А (стор
Передумови
МАО каталізує окисне дезамінування ендогенних моноамінів в організмі людини [8]. Існують дві ізоформи МАО (МАО-А та МАО-В), локалізовані у зовнішній мітохондріальній мембрані; вони розподіляються по всій нервовій системі, а також в інших регіонах тіла, включаючи травну та кровоносну системи. Дефіцит МАО-А в результаті мутації в МАО-А ген може спричиняти характерний набір симптомів (тобто, легку розумову відсталість, імпульсивну асоціальну поведінку та розлади настрою та паніки), які разом називають синдромом Бруннера [9]. Мутації в миші МАО ген надає той самий фенотип [10]; отже, миша - ідеальна тваринна модель для доклінічних експериментів, що включають маніпуляції МАО-А.
Цікаво, що підвищені білки фактора транскрипції AP-1 та NF-kB та мікрогліальна активація також є відомими асоціаціями при ішемічно-реперфузійній травмі, моделі розладу Паркінсона та вірусної інфекції імунодефіциту людини. Варіація в МАО-А експресія була пов'язана з поліморфізмом в промоторній області [11, 12], яка також показала, що містить щонайменше одну консенсусну послідовність для зв'язування AP-1 та SP-1 [13-16]. Щоб краще зрозуміти, як ці два білки TF можуть впливати на активність МАО-А, ми застосували альтернативний підхід, використовуючи дволанцюжковий (ds) аптамер ДНК з консенсусною послідовністю для цих білків TF. Ми продемонстрували специфічне та чутливе зв'язування аптамерів dsAP1 та dsNF-kB з білками AP-1 та NF-kB відповідно [5], включаючи нульове зв'язування з аптамером AP-1 у мишей з мутантними білками AP-1 [ 17]. МАО-А міститься в цитоплазмі дофамінергічних нейронів в SN, pars compacta, гіпоталамусі та VTA середнього мозку. Оскільки мезолімбічні нейрони шляху винагороди мають аксональні проекції, що походять від VTA, ми дослідили антиген МАО-А в області VTA. Тут ми співвідносимо вплив аптамерів dsAP-1/NF-kB на рухову активність з експресією МАО-А у ВТА живих мишей, що зазнали дії амфетаміну.
Методи
Тварини та житло
Усі процедури, використані у цьому дослідженні, були затверджені Підкомітетом з досліджень догляду за тваринами в штаті Массачусетс, інституційним комітетом з питань захисту тварин, відповідно до Керівництва державної служби охорони здоров’я щодо догляду та використання лабораторних тварин. Дорослих самців мишей C57black6 (Taconic Farm, Germantown, NY) (n ≥ 3 послідів за раз), віком від 2 до 3 місяців (23 ± 2 gm BW), утримувались у клітках на підстилці з тирси, в кімнаті з контрольованим світлом цикли (12 год світло/12 год темно), де вони мали вільний доступ до води та харчувались стандартною лабораторною чау. Мишей навчали, оперували та тестували рандомізованим способом, при цьому сліпий спостерігач виконував поведінкове тестування.
Коротка dsDNA для білка, що зв'язує AP1
Двоцепочечна ДНК, що містить консенсусну послідовність (позначається великими літерами) для білка AP1 (5'-флуорецеїн ізотіоціанат [FITC] -tccggcTGACTCAtcaagcg-3 'та 3'-aggccgACTGAGTagttcgc-біотин-5') були модифіковані шляхом фосфоротіонізації яка сірка замінює немостовий кисень на фосфатних зв’язках трьох, чотирьох або п’яти нуклеотидів (малі літери) з обох кінців (кінцеві кришки, ЕС). Додаткові 5ECdsDNA для факторів транскрипції включають SP1 (5ECdsSP-1, 5’-ctcgcCCCGCCccgatcgaa-біотин та 3’-gagcgGGGCGGggctagctt); ядерний фактор каппа бета (5ECdsNF-κβ, 5’-agttgaGGGGACTTTCCcaggc-біотин та 3 ’tcaactCCCCTGAAAGGgtccg) та білок, що зв’язує елемент циклічної відповіді AMP (5ECdsCREB, 5’-ctctcTGACGTCAggcaat-біотин та 3’-гагагACTGCTGTccgtta). Коли в якості контролю використовували одноланцюгову ДНК, олігоДНК повністю модифікували шляхом фосфоротіонування.
Обидві нитки послідовностей, що зв'язують фактор транскрипції, змішували при кімнатній температурі, нагрівали при 65 ° C протягом п'яти хвилин і повільно охолоджували на термоциклері (падіння на 1 градус в хвилину) до 20 ° C, при якій температуру вони підтримували протягом 30 хв. . Короткі дсДНК зберігали в аликвотах по 0,05 мл (100 мкМ) при -20 ° C. За годину до використання одну аликвоту розморожували до кімнатної температури.
Доставка аптамерів 5ECdsDNA
Для досліджень поглинання ми знеболили мишей чистим O2 плюс 2% галотану зі швидкістю потоку 800 мл/хв і доставили аптамери dsDNA (8 нмоль ДНК на кг, n = По 4) шляхом ін’єкції icv [18, 19], прийнятий шлях доставки для введення контрастних речовин гризунам та приматам нелюдей [20–22]. Ми доставили 8 нмоль ДНК на кг (icv) для досліджень нокдауну білка TF [23]. Через три години після доставки ДНК ми вводили або фізіологічний розчин (0,1 мл, в/в), або амфетамін (4 мг на кг, в/в). Поглинання різних аптамерів 5EDdsDNA проводили та перевіряли, як описано раніше; всі фотографії були отримані з однаковим часом експозиції за допомогою CCD-камери Himatsu на мікроскопі Olympus (Optical Analysis Corp, NH) [5].
Тестування поведінки після амфетаміну
Всім мишам проводили попереднє кондиціонування щонайменше 48 год у випробовувальній клітці, яка була обладнана детектором руху [21]. Ми доставили dsDNA або контрольний (icv) за три години до введення амфетаміну [23]. Після доставки амфетаміну мишей негайно поміщали в домашні клітини, де ми вимірювали їх рух протягом 60 хв.
Поводження з тваринами
Для того, щоб мінімізувати ефект стресу, який тварини можуть відчувати, перебуваючи в різних середовищах до та під час стимуляції амфетаміном, кожна миша була розміщена в одній клітці протягом усіх експериментів, що включало тиждень звикання до нового середовища. За три дні до попередньої обробки амфетаміном ми звикли всіх тварин шляхом щоденного введення сольового розчину (0,25 мл) та оцінки поведінки як вихідного рівня кожного дня. Кожну домашню клітку розміщували безпосередньо в системі автоматичного запису, перш ніж тваринам вводили амфетамін. Ми розділили тварин на дві групи, щоб отримати або амфетамін, або сольовий розчин (транспортний засіб) на наступні дні. Мишей ніколи не садили в нову клітку для оцінки поведінки, як описано [21].
Експресія білка МАО
Імуногістохімія
Ми доставляли мишам фізіологічний розчин, dsAP1 або dsRan шляхом введення icv (2 мкл) та амфетаміну, описаного вище; зразки тканин отримували від мишей через 90 хв після амфетаміну. Ми вимірювали експресію МАО-А з використанням кролячих поліклональних антитіл проти МАО-А (1: 500, Novus Biologicals, Littleton, CO, NBP1-19796), використовуючи попередньо опубліковану процедуру [19].
Вестерн-блот експресії білка МАО
Статистичний аналіз
Отримавши перший набір даних, ми розрахували кількість тварин, необхідних у кожній групі для досягнення 95% потужності для стор значення 0,01 [21, 24]. Ми розрахували середню та стандартну похибку середнього значення (SEM) із середніх значень у кожній групі тварин та порівняли статистичну значимість цих значень за допомогою т тест (один хвіст, тип II або рівний варіант, GraphPad Prism IV, GraphPad Software, Inc., Сан-Дієго, Каліфорнія). A стор значення менше 0,05 було статистично значущим.
Результати
Амфетамін знижує рівень антигену МАО-А
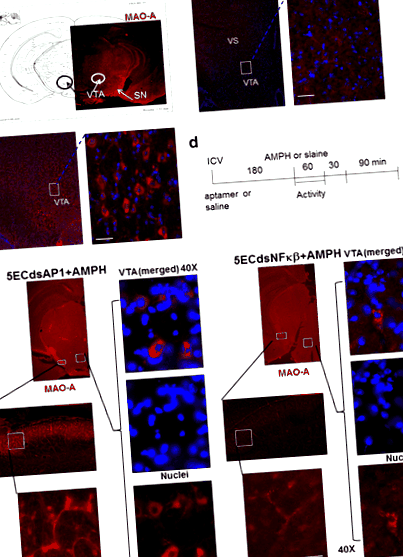
Ми виявили присутність МАО-А в цитоплазмі дофамінергічних нейронів, які у наївних мишей присутні переважно в СН, pars compacta, гіпоталамусі та VTA середнього мозку (кола, рис. 1а). У нормальному мозку миші без амфетаміну МАО-А розподіляється в межах соми та аксонів нейронів у ВТА (бокси, рис. 1b). Лікування амфетаміном знижувало антиген МАО-А в мезолімбічних нейронах СН, вентрального смугастого тіла та ВТА (графіки, рис. 1в).
Експресія антигену МАО-А в ЦНС (без ін'єкцій, панель a) у мишей після сольового розчину (100 мкл, в/в, панель b) або амфетаміну (4 мг/кг, с.к., панель c), як показано в протоколі (панель d). Попередня обробка AP-1 або NF-kB Aptamer усуває індукований AMPH дефіцит MAO-A (панель e). Миші, попередньо оброблені 5ECdsAP-1 або 5ECdsNF-kB аптамером перед тим, як амфетамін (AMPH), демонструють зворотну експресію білка МАО-А. Білок МАО-А присутній у цитоплазмі соми у ВТА (вентральна тегментальна зона та аксони в СН (substantia nigra) та VS (вентральний смугастий) мезолімбічного шляху. Результати імуногістохімії свідчать про те, що 5ECdsAP-1 може мати інший тимчасовий ефект від 5ECdsNF-kB на обернення рівня антигену МАО-А
Щоб дослідити механізм, за допомогою якого амфетамін знижує МАО-А, ми застосували аптамери з консенсусною послідовністю для білків TF, а також один аптамер із випадковою (Ran) послідовністю, який не має внутрішньоклітинної мішені. Ми застосовували 5ECdsAP1 або 5ECdsNF-kB (n ≥ 2 у кожній групі) до мишей згідно з протоколом, наведеним на рис. 1г. Миші з попередньою обробкою аптамером 5ECdsAP1 або 5ECdsNF-kB продемонстрували зворотне зниження індукованого амфетаміном МАО-А в сомі нейронів VTA, а також в аксонах нейронів в СН (рис. 1д).
Модуляція фактора транскрипції білка AP-1 на активність МАО-А
Рівні МАО-А та МАО-В після амфетаміну. Ми попередньо обробили мишей аптамером 5ECdsAP1 перед застосуванням амфетаміну згідно з рис. 1г; ми зібрали зразки тканин (n = 4 на групу) від VTA через 90 (60 + 30 хв. Рис. 1d) та 180 (60 + 30 + 90 рис. 1d) хвилин після амфетаміну. Ми отримали білок для вестерн-блот-кількісного визначення МАО-А (панель a) або MAO-B (панель b) рівень (верхні молекулярні фрагменти) з використанням актину (нижньомолекулярні фрагменти) як еталон, показаний на смугах 2–4 (зразки 90 хв) або смузі 5–6 (180 хв). Загальний білок (10 мкг) використовували для всіх доріжок, крім доріжок 7 і 9. Блот видаляли і використовували для МАО-В після МОА-А. Доріжка 1: маркер молекулярного розміру сходів 10 КД; доріжка 2: 5ECdsAP1 (4 нмоль/кг, icv, половина дози); доріжки 3 і 5: фізіологічний розчин (2 мкл, icv); смуги 4 і 6: 5ECdsAP1 (8 нмоль/кг, icv, повна доза); доріжки 7, 8, 9 є контролями наївних мишей (відсутність аптамеру або амфетаміну (зі збільшенням кількості білка: 5, 10 та 20 мкг, відповідно. Оскільки ми не спостерігали зміни рівня МАО-В (Панель) b), ми визначили, що 90 хв після амфетаміну є оптимальним часом для збору зразків VTA (панель a, доріжка 4) для кількісного порівняння зворотного рівня МАО-А в тканині VTA від мишей, оброблених аптемерами 5EC dsAP1, ssAP1, dsNF-kB, фізіологічного розчину (Sal), нічого (наївний), dsSP1, dsCREB та dsRan ( панель c). Aptamer 5ECdsAP1 підвищував MAO-A на 60–100% (т тест, показаний у вигляді стовпчастих графіків на панелі c). N = кількість мишей, використаних у тесті
5ECdsAP1 покращує рухову активність, спричинену амфетаміном
Ми реєстрували та вимірювали рухову активність за допомогою автоматичної системи реєстрації в контрольованому середовищі [21]. Потім ми порівняли вплив на рухову активність, вимірявши відстань, яку подолали миші, отримавши мінімальну дозу 8 нмоль/кг 5ECdsAP1, 5ECdsNF-kB, 5ECdsRan або фізіологічний розчин. Ми спостерігали, що попередня обробка аптамером 5ECdsAP1 або 5ECdsNF-kB суттєво пригнічувала індуковане амфетаміном збільшення рухової активності (стор Рис.3
Індукована амфетаміном гіперлокомоторна активність у контрольній групі [попередня обробка 5ECdsRan (панелі a & b) або фізіологічний розчин (панелі c & d) перед тим, як амфетамін] змінюється на майже нормальний рівень, коли мишей попередньо обробляли 5ECdsAP1 (панелі a - d) або 5ECdsNF-kB (панелі c & d). Іншою контрольною групою, не показаною на цьому графіку, є попередня обробка ssAP-1 (повністю модифікований фосфоротіоатом). Тонкий рух двигуна (рух передньої лапи без зміни положення тіла) відображається як частота в хвилину (панель b). Пройдена відстань дається зі швидкістю (м на годину (панель a) або в сантиметрах з кожним інтервалом 5 хв (панелі c & d, яка була розрахована за частотою амбулації (переміщення між сусідніми пучками світла 5 см за одну хвилину) x 5 см за хвилину x 5 хв за інтервал перекодування. Як правило, нормальні миші без лікування демонстрували не більше 30 частот амбулації на хвилину протягом 15 хв після обробки (базовий рівень). Не виявлено жодного значення між контролем (фізіологічний розчин) та dsAP-1 Full EC (панель c)
Обговорення
Наше дослідження демонструє специфічність аптамеру для МАО-А, оскільки 5ECdsAP1 не впливав на МАО-В. Ця специфіка підтримує регулювання різних шляхів цими двома ізомерами [29, 30]. Оскільки наш аптамер ефективно конкурує з білками TF in vivo, які є гетеро- та/або гомодимерними формами принаймні двох сімейств генів, наш аптамер забезпечує прямий підхід до генного збиття білків і діє як антагоніст, опосередковано модулюючий рівень МАО-А білок.
Наші спостереження, що специфічне зниження білка МАО-А відбулося без істотних змін мРНК МАО-А у ВТА після впливу амфетаміну, свідчать про те, що на активність транскрипції МАО безпосередньо не впливає опосередкована ТФ регуляція генів МАО, особливо за участю SP-1 фактор транскрипції [31]. Ми припускаємо, що зменшення білка МАО-А може бути результатом катаболічної дії до екзогенної детоксикації амфетаміну, швидше за все, як запальна реакція, пов'язана з білками TF AP-1/NF-kB. Більше того, відсутність значного підвищення рівня мРНК МАО-А після амфетаміну свідчить про те, що зменшення МАО-А не виробляє сигнал зворотного зв'язку досить швидко, щоб збільшити транскрипцію МАО-А, або сигнал блокується супресором. Гіпотеза супресорів підтримує результат деацетилювання гістону на промоторі гена c-fos [32]. Запропонований тут механізм може також пояснити нульовий ефект, який кокаїн викликає на гіперактивність, що спостерігається в інших дослідженнях у подвійному трансгенному штамі миші, який не продукує активного білка AP-1 TF [17].
Відомо, що як AP-1, так і NF-kB білки TF збільшуються після впливу амфетаміну. Подібне явище було описано на моделях тварин з реперфузійною мозковою травмою ішемії, серйозним розладом настрою та/або біполярним розладом, хворобою Паркінсона [33, 34] та в популяціях людей, інфікованих інфекціями, що передаються статевим шляхом [4, 35, 36]. Гострий стрес, що характеризується тривогою (безсонням, дратівливістю, поганою концентрацією уваги, руховим неспокоєм), серед інших станів людини, може бути експериментально викликаний у тварин [37, 38]. Враховуючи, що знижені рівні білка МАО-А пов’язані з гострим стресом у людей [39], ми передбачаємо, що наш аптемер 5ECdsAP1/5ECdsNF-kB може застосовуватися, теоретично, для корекції аномальної експресії МАО-А, що спостерігається під час гострого стресу.
Антисмислова реакція OligoDNA до сімейств Fos знижувала білок TF шляхом нокдауну відповідної мРНК [40, 41]. Ми показали, що аптамер 5ECdsAP-1 або 5ECdsNF-kB націлений на AP-1 або NF-kB білок TF в аналізі зсуву гелю відповідно [5]. Специфічне націлювання на живий мозок опосередковує МРТ внутрішньоклітинного білка TF у низьких дозах та зменшує дефектацію ферментів МАО-А, що опосередковується амфетаміном, та активність стресу при високих дозах. Остання подія підтримує нормальний рівень МАО-А в мезолімбічних дофамінергічних нейронах і підтверджує, що рівень МАО-А обернено пропорційний гіперактивності. Дані підтримують зв'язок активності МАО-А та нормальної поведінки [10]. Тому наше дослідження підтверджує, що націлювання на MR-CA за допомогою аптамерів може мати потенціал для терапевтичного застосування [21].
Ми не спостерігали повного обміну індукованої амфетаміном гіперактивності у відповідь на dsAP1 із загальним фосфоротіоуванням (рис. 2). Цей ефект ми пов'язуємо з неспецифічним зв'язуванням аптамера з іншими білками, що, отже, розбавляє ефективне зв'язування з цільовим білком АР-1. У ряді досліджень інших дослідників використовувались аптамери для націлювання на різні білки TF [42–45]. На додаток до аптамеру 5ECdsCreb, 5ECdsSP-1 не зміг модулювати рівень МАО-А, оскільки сайт зв'язування SP-1 відсутній у людського промотора МАО-А ген, але його можна знайти в промоторі людини МАО-Б ген [31]. Ми з'ясували механізм, за допомогою якого аптамер пом'якшує гіперактивність, пов'язану з амфетаміном, за рахунок ослаблення МАО-А; тому наш метод забезпечує додатковий засіб для оцінки механізму та внутрішнього обігу цих білків TF in vivo.
Висновок
Оскільки аптамер може бути маркований наночастинками оксиду заліза, золотом або флуоресцентними барвниками, наш підхід може бути застосований до мультимодальних зображень за допомогою МРТ (in vivo) та мікроскопії (ex vivo). Результати узгоджуються з повідомленням про те, що 5ECdsAP1 або 5ECdsNF-kB можуть конкретно керувати доставкою ДНК або контрастних речовин до клітин, які містять мішень унікальних внутрішньоклітинних білків TF. Крім того, внутрішньомозково-шлуночкова ін’єкція, яка безпосередньо обходить гематоенцефалічний бар’єр, клінічно прийнята для доставки терапевтичних засобів, підтверджуючи трансляційний потенціал нашого підходу. Ми очікуємо, що ця методика матиме потенціал для досліджень у реальному часі та поздовжніх досліджень, як в доклінічних, так і в клінічних цілях.
- Дослідження знань про харчування та дієтичну поведінку дітей початкової школи в Сеулі
- 10-денна детоксикаційна дієта з використанням періодичного голодування
- 5 закусок, щоб підвищити рівень енергії завдяки процвітанню на ринку
- Безкоштовний повнотекстовий аналіз рівня сприятливості агрономії клімату Севастопольської області для
- Реконструкція грудей за допомогою власних тканин (процедури клаптя)