Зондування кишечника споживання калію та його роль у гомеостазі калію
Jang H. Youn
Доцент, кафедра фізіології та біофізики, Університет Південної Каліфорнії, Медичний факультет Кека, Лос-Анджелес, Каліфорнія, США та міжнародний стипендіат, Департамент біохімії та молекулярної біології, Медичний факультет Університету Кюнг Хі, Сеул, Корея, Південний університет Каліфорнійська медична школа
Анотація
Позаклітинний гомеостаз K + пояснюється механізмами зворотного зв’язку, при яких зміни концентрації позаклітинного K + прямо чи опосередковано виводять ниркову екскрецію K + через стимулювання секреції альдостерону. Однак це не може пояснити каліурез, спричинений їжею, який часто трапляється без збільшення концентрації К + у плазмі крові або альдостерону. Недавні дослідження показали докази, що підтверджують прямий контроль, при якому зондування з кишечником дієтичного К + збільшує виведення К + з нирками (і надниркове поглинання К +) незалежно від концентрації К + у плазмі крові, а саме "фактор кишечника". Цей огляд фокусується на цих нових висновках та обговорює роль кишкового фактора у гострій та хронічній регуляції позаклітинного К +, а також у сприятливих наслідках високого споживання К + на серцево-судинну систему.
ВСТУП
ГОСТЕ РЕГУЛЮВАННЯ ПОЗАКЛІТИННОГО КАЛІЮ
Виклики гомеостазу K +
Порівняно з іншими основними електролітами, K + має більш високе співвідношення споживання їжі до величини позаклітинного басейну (тобто обороту), що представляє значну гомеостатичну проблему. Частково це пов’язано з невеликим позаклітинним пулом К +; лише 2% від загальної кількості тіла K + розподіляється в ECF, а переважна частина в ICF. Отже, їжа, збагачена K +, суттєво збільшила б позаклітинний [K +] за відсутності відповідного регулювання, викликаючи ризик гіперкаліємії. Для вирішення цієї проблеми гомеостатична система К + дуже ефективно очищає К + від плазми під час дієтичного споживання К +. Нирки збільшують виведення К + зі збільшенням споживання К +. Однак протягом перших 4–6 год після гострого навантаження K + у сечі з’являється лише половина введеної дози, що свідчить про те, що позаниркові тканини також відіграють важливу роль у усуненні гострого позаклітинного навантаження K + (10). Беручи до уваги виклики гомеостазу K +, можливо, випадково інсулін, який виділяється поживними поживними речовинами після їжі (тобто при поглинанні дієтичного K +), сприяє засвоєнню K + наднирковими тканинами і тим самим запобігає надмірному підвищенню плазми [K +].
Контроль зворотного зв'язку гомеостазу K +
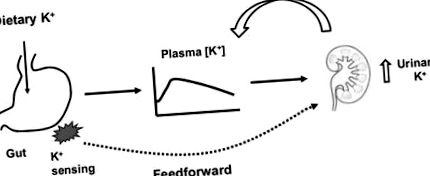
Відповідно до традиційного погляду, позаклітинний [K +] є головним фактором регуляції ниркової екскреції K + (11, 12). Позаклітинний [K +] збільшується під час вживання K + з їжею, і це збільшення стимулює виведення K + з нирками (рис. 1), безпосередньо впливаючи на секрецію K + у збірній протоці (11). Крім того, підвищений позаклітинний [K +] стимулює секрецію альдостерону, додатково стимулюючи ниркову секрецію і екскрецію K +. Посилена екскреція K + через нирки, як правило, відновлює позаклітинні [K +]. І навпаки, під час обмеження K +, зниження плазми [K +] зменшує ниркову екскрецію K +, що потім буде служити для підтримання позаклітинного [K +] в межах норми. Таким чином, підтримка гомеостазу K + традиційно розуміється на основі концепції контролю негативного зворотного зв'язку.
Принципова діаграма, що ілюструє зворотній зв'язок проти прямого контролю гомеостазу K +.
Подальший контроль гомеостазу K +
Зворотній зв'язок проти контролю прямого пересилання
Контроль прямого надходження в гомеостатичну систему глюкози
КЕРУВАННЯ ПЕРЕДАЧЕЮ КОРМУ В ГОМЕОСТАЗІ КАЛІЮ
Подальший контроль за допомогою інсуліну
Контроль прямого руху, активований дієтичним К +
Дослідження Лі та співавт. (8) надав значне розуміння гострої регуляції гомеостазу К +. У стані голодування системне вливання K + збільшувало плазму [K +], збільшувало виведення нирок K +, а також, можливо, клітинне поглинання K +. Ці ефекти плазми [K +] були б важливими для обмеження підвищення плазми [K +] під час прийому K + та нормалізації плазми [K +], коли припиняється споживання K + (рис. 2). Однак збільшення плазми [K +] під час інфузії K + було великим (тобто 1,3 мМ зі швидкістю інфузії 100 мг/кг/год) у стані голодування. Під час прийому їжі (тобто дієтичного споживання K +) інсулін допомагає запобігти надмірному підвищенню плазми [K +], стимулюючи надниркове поглинання K + (1, 28): підвищення плазми [K +] за допомогою системної інфузії K + під час їжі було зменшено до
0,6 мМ, що вказує на прийом їжі та/або інсуліну. Нарешті, коли K + вводили внутрішньошлунково під час їжі, існували дані про фактор (кишки) кишечника, який додатково збільшує кліренс K + у плазмі, що призводить до незначного підвищення плазми [K +].
Схематичний малюнок, що ілюструє вплив плазми [K +] на один сейсулін та гіпотетичний кишковий фактор на підвищення плазми [K +] під час прийому K +.
Кишкове зондування K + стимулює каліурез після їжі
Харчовий прийом K + може збільшити виведення K + з нирками або за рахунок збільшення плазми [K +] (традиційний вигляд), або за рахунок активації механізму, незалежного від плазми [K +], або за допомогою обох механізмів. О та ін. (9) оцінили ці механізми під час нормального споживання їжі K + у щурів. Після нічного голодування щурів годували невеликою кількістю (
15% щоденного споживання) дієти, що містить або 0%, або нормальний 1% K +, а також вимірювали екскрецію K + із плазмою [K +] та нирками. У третій групі щурів годували дієтою 0% K +, а KCl вводили, щоб відповідати плазмовому [K +] профілю та 1% -ної групи K +. Годування 1% K + суттєво збільшило виведення нирків K +, пов'язане з незначним збільшенням плазми [K +] (
0,2 мМ). У групі з дієтичним введенням KCl 0% K + екскреція K + через нирки була значно меншою, ніж у групі 1% K +, незважаючи на відповідні профілі плазми [K +]. Це дослідження вказує на те, що збільшення кількості виведення К + нирками після їжі не може бути повністю пояснено змінами в плазмі [К +], і зондування кишечника дієтичного К + було основним компонентом регуляції виведення К + через нирки. Рівень альдостерону в плазмі крові не змінювався ні вживанням їжі, ні вмістом К + в їжі. Таким чином, спостерігалося збільшення ниркової екскреції К + під час вживання К + з їжею, незалежно від рівня К + або альдостерону в плазмі, два фактори, які розглядались як класичні регулятори виведення нирок К +. Ці висновки узгоджуються з концепцією впливу кишкового фактора або прямим контролем позаклітинного гомеостазу K +.
МЕХАНІЗМИ ВПЛИВУ ФУКТОРУ КУШКИ
Чи беруть участь кишкові пептиди?
Точні механізми, що лежать в основі дії кишкового фактора, невідомі. Одна проста ідея полягає в тому, що кишечник може збільшувати (або зменшувати) секрецію гуморального фактора при виявленні дієтичного К +, щоб збільшити ниркову екскрецію К +. Існує безліч доказів взаємодії між шлунково-кишковим трактом та нирками; існує багато кишкових пептидів та гормонів, що виділяються у відповідь на надходження харчових поживних речовин та іонів, що впливають на функції нирок (29). Недавні дослідження показали, що кишково-ниркова вісь регулює ниркову екскрецію фосфату (30, 31). Як і K +, фосфат - це електроліт з високим співвідношенням споживання їжі до розміру позаклітинного басейну (тобто великої швидкості обороту). Хоча рівень фосфату в плазмі не настільки жорстко контролюється, як [K +] після їжі, є дані про те, що в кишечнику існує фосфатурна речовина, яка може виділятися для збільшення екскреції фосфатів із нирками під час вживання фосфатів з їжею (30). Таким чином, аналогічні механізми можуть брати участь у регуляції обох цих двох основних електролітів з високим оборотом (і гомеостатичним викликом).
Чи задіяний мозок?
Альтернативна гіпотеза полягає в тому, що зондування кишечника надходження K + передається в мозок, і мозок регулює роботу нирок та/або позанирків K +. Існують значні докази того, що мозок бере участь у гомеостазі K +, як це чудово розглянув Рабіновіц (37). Причини видалення однієї нирки (тобто, унінефректомія) у анестезованих щурів
У 2 рази збільшується екскреція Na + та K + з рештою ниркою. Серія елегантних досліджень Хамфріза та його колег (38–40) продемонструвала, що ці ефекти опосередковуються γ-меланоцитостимулюючим гормоном (МСГ), секреція якого з гіпофіза стимулюється після унінефректомії. Видалення введення ниркового аферентного нерва запобігло збільшенню γ-MSH після унінефректомії (38), що вказує на важливу роль аферентного нервового шляху від нирки. Одностороння оклюзія сечоводу, як і одностороння нефректомія, призвела до значного збільшення виведення Na + та K + контралатеральною ниркою (40). Ці дані свідчать про те, що мозок постійно контролює стан ниркової екскреції Na + та/або K + 2 і за необхідності робить відповідні корективи. Крім того, мозок може контролювати надходження в їжу K + (введення) і вносити корективи у виведення (виведення) K + з нирками, щоб підтримувати баланс K +. Таким чином, гіпоталамус може контролювати як вхід, так і вихід K + та координувати ці сигнали для регулювання ниркової (та/або позаниркової) обробки K + за допомогою гормонів гіпофіза (9). Наше попереднє дослідження (Oh YT, Youn JH; неопубліковані дані) показало, що адаптація K + до зміненого споживання K + була порушена у гіпофізектомізованих щурів, що відповідає ідеї про те, що мозок бере участь у зондуванні споживання K +.
О та ін. (9) дослідив, чи змінюються рівні γ-MSH у плазмі крові під час дієтичного споживання K +, що є необхідною умовою для медіатора ефекту кишкового фактора, як обговорювалося вище. Рівні γ-MSH (або γ-MSH) у плазмі не змінювались ні під час прийому їжі, ні через вміст K + в їжі, не забезпечуючи ніякої підтримки ролі γ-MSH у впливі фактора кишечника. У цьому дослідженні досліджуваним пептидом MSH був γ2-MSH, оскільки його вимірювали або вводили в дослідженнях Хамфріса та його колег. На основі послідовності генів POMC та потенційних місць розщеплення залишків двоосновних речовин було передбачено три пептиди MSH (γ1, γ2 та γ3-MSH) (41). Однак, хоча γ1 та γ3-MSH були виділені з клітин гіпофіза гризунів (42, 43), γ2-MSH ні, що призводить до припущення, що γ2-MSH може не існувати у гризунів (44). Отже, потенційну роль γ-MSH як медіатора ефектів кишкового фактора потрібно буде додатково дослідити та/або поширити на дослідження з γ1- та γ3-MSH. Крім того, інші пептиди гіпофіза можуть брати участь у регуляції ниркової екскреції К + за допомогою дієтичного К + .
Потенційні мішені кишкового фактора в нирках
Ванг та його колеги продемонстрували, що виснаження K + збільшує опосередковане білком тирозинкіназою фосфорилювання ROMK, що спричиняє втягнення K + каналів з апікальної мембрани для зменшення секреції та виведення K +, і ці ефекти опосередковані збільшенням NADPH оксидази і вироблення супероксид-аніонів (5, 48). Недавнє дослідження цієї групи також продемонструвало, що всі ці зміни відбувались при нормальній плазмі [K +] у щурів та мишей, які підтримували низьку (0,1%) дієту K + (49). Наше попереднє дослідження також показало, що скромна депривація K + збільшує експресію PTK та фосфорилювання ROMK за відсутності падіння рівня K + або альдостерону в плазмі (50). З іншого боку, споживання дієти з високим вмістом К + протягом 1–3 днів знижувало фосфорилювання РМК, опосередковане PTK (51). У сукупності ці дані дозволяють припустити, що НАДФН-оксидаза в нирках може бути іншою потенційною мішенню кишкового фактора. Якщо це правда, активність НАДФН-оксидази та вироблення супероксид-аніону в нирках можуть бути різко змінені після прийому їжі, щоб врахувати швидке збільшення екскреції К + через нирки.
РОЛЬ ФАКТОРА КИШКІВ У ХРОНІЧНОЇ АДАПТАЦІЇ K +
Ниркова адаптація K +
Коли дієтичне споживання К + збільшується або зменшується, нирки реагують відповідно збільшенням або зменшенням виведення К + відповідно (11, 52). Ця так звана "адаптація K +" є критично важливою для хронічного балансу K + і є добре визнаною протягом декількох десятиліть. У нирці K + фільтрується в клубочку, а відфільтрований K + навантаження майже повністю реабсорбується в проксимальному нефроні. При нормальному або високому надходженні K + K + виділяється в кортикальний збірний проток (CCD), що становить більшу частину виведеного K +. При дієті з низьким вмістом К + у ПЗЗ спостерігається чиста реабсорбція К +. Таким чином, секреція К + в ПЗЗ є дуже пристосованою до вживання К + з їжею і є основним місцем регуляції виведення К + (52). Молекулярні механізми, що лежать в основі ниркової адаптації K +, були широко вивчені, як це оглянув Пол Веллінг у цьому номері журналу. Таким чином, ефекторна система добре охарактеризована, хоча сигнал для ниркової адаптації K + (або те, як організм відчуває надходження в їжу K +), незрозумілий (13).
Адаптація надниркових тканин до низького споживання К +
Деякі позаниркові тканини, такі як скелетні м'язи та печінка, збільшують поглинання K + у відповідь на інсулін (1, 28), складаючи важливий механізм позаклітинного гомеостазу K + після їжі та прийому K +. Кілька років тому Чой та ін. представив нову методику кількісного визначення дії in vivoinsulin на клітинне поглинання K +, що отримала назву "затискач K +" (53, 54). У цьому методі плазма K + підтримується постійною під час інфузії інсуліну за допомогою різної екзогенної інфузії K +. Швидкість інфузії К +, необхідна для стиснення плазми К +, є мірою дії інсуліну для збільшення швидкості поглинання К + клітин (54). Використовуючи цю методику, ми продемонстрували на щурах, що стимульоване інсуліном клітинне поглинання K +, як виведення нирок K +, глибоко пригнічується під час депривації K + (50, 53, 54), що вказує на спільні зусилля організму щодо збереження позаклітинного K +. Таким чином, адаптація K + відбувається як у нирках, так і в надниркових тканинах у відповідь на зміни в споживанні K +.
Загальний сигнал для ниркової та позаниркової адаптації?
Цікаво, що Choi et al. виявили сильну кореляцію між ступенем зміни ниркової екскреції K + та наднирковим поглинанням K + під час депривації K + (54), припускаючи загальний сигнал або фактор для цих змін. Chen et al. продемонстрували, що ці зміни у поводженні з нирками та позанирками К + відбулися за відсутності змін у плазмі К + або концентрації альдостерону, коли споживання К + було зменшено до 1/3 контролю (50). Таким чином, здається, що організм зміг відчути зменшення споживання K +, навіть без змін у позаклітинному [K +], і зменшити обробку нирок та позанирків K + для збереження позаклітинного K +. Ці дані підтверджують роль кишкового фактора в нирковій та позанирковій адаптації K + (див. Нижче).
Фактор кишечника може пояснити швидку індукцію та перелом стану збереження K +
Зміни екскреції К + із сечею при зміненому споживанні К +. Щурів тримали на контрольній дієті 1,0% K + протягом 3 днів, на помірній K + (0,33% K +) дієті протягом наступних 3 днів, і знову контрольній дієті протягом останніх 3 днів. Тварин розміщували індивідуально і мали вільний доступ до їжі лише вночі (18:00 - 6:00). Виділення K + із сечею визначали для абсорбційного (6 вечора - 6 ранку, ніч) та післяабсорбційного періодів (6 ранку - 6 вечора, вдень). Дані є середніми значеннями ± SE (n = 4).
Схематичні схеми, що ілюструють зменшення ниркової екскреції К + після нічної депривації К + (A) або його швидкий зворотний розвиток після нічного годування за допомогою нормальної дієти 1% K + (B). Вплив фактора кишкового фактора Athe (з 1% K + їжі) на посилення виведення K + з нирок із попереднього вигодовування з часом зменшується, що призводить до глибокого зменшення виведення K + після обмеження K + протягом ночі (0% K + їжі; тобто, без активації кишкового фактора).
Дві фази адаптації K +
Більшість попередніх досліджень на тваринах щодо молекулярних змін, пов’язаних з депривацією K +, використовували тижні загальної депривації K +. Багато змін, що спостерігаються в цих дослідженнях, можуть представляти зміни, що виникають внаслідок гіпокаліємії, можливо, відрізняються від тих, що відповідають за ранні адаптації, що відбуваються без змін у плазмі [K +]. Оскільки адаптації K + можуть відбуватися протягом доби після зміни споживання K + та за відсутності плазми [K +], важливо вивчити молекулярні зміни в нирках (і позаниркових тканинах) в умовах нормальної [K +], або рано під час повної депривації K + або з частковою депривацією K +. Ці зміни виявлять молекулярні механізми, що беруть участь у впливі фактора кишечника, та допоможуть визначити сигнал для споживання K + з їжею.
КОРИСНІ ЕФЕКТИ ДІЄТИЧНОГО КАЛІЮ
Вплив дієти з високим вмістом К + на зниження артеріального тиску вже давно визнаний (57, 58). Крім того, існує безліч доказів того, що надмірне споживання дієти K + сприятливо впливає на інсульт та серцево-судинні захворювання (57, 58), але основні молекулярні механізми недостатньо вивчені. Янг та його колеги запропонували гіпотезу про те, що сприятливі ефекти збільшення споживання дієти К + викликані збільшенням позаклітинної концентрації К + ([К +]), заснованої на спостереженнях in vitro, що високі рівні К + надають клітинну дію для гальмування утворення вільних радикалів, проліферація гладких м’язів та утворення тромбу (58). Однак у клінічних дослідженнях спостерігався сприятливий ефект добавок К + без збільшення плазми [К +] (59). Наприклад, добавки калію (60 ммоль KCl/70 кг маси тіла) протягом 3 днів не змінювали сироватки крові [K +], але суттєво зменшували реактивність тромбоцитів у здорових чоловіків та жінок, забезпечуючи потенційний зв’язок між прийомом K + та оклюзійним інсультом (60 ). В іншому дослідженні збільшення калію в їжі (30 ммоль на добу) значно знижувало кров'яний тиск у добровольців, які страждають на норму, без зміни плазми [K +] (61). Ці висновки дозволяють припустити, що сприятливий вплив споживання К + з їжею може бути опосередкований механізмом, незалежним від плазми [K +] (62).
Подяка
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
1 Термін "кишковий фактор" використовується в цій статті, як правило, для позначення механізму, що активується внаслідок зондування кишечнику споживання K +, який підсилює виведення нирки K + та надниркове засвоєння K +, незалежно від плазми [K +]. Точна природа цього механізму наразі невідома; фактор може включати нейронну, не обов'язково гуморальну регуляцію, як це випливає з назви.
2 Дослідження Хамфріса та його колег значною мірою зосереджувались на ролі γ-MSH у регуляції виведення Na +, і тому роль γ-MSH у регуляції виведення K + менш чітка.
- Їжте банани щодня для чоловіків, що вживають калій; s Журнал про здоров'я в Австралії
- Дієтичне консультування або доповнення калію для збільшення споживання калію у пацієнтів з підвищеним вмістом крові
- Споживання калію при вагітності щодня, нормальний діапазон; Ефекти
- Щоденне споживання калорій, скільки калорій я повинен вживати, щоб схуднути
- Frontiers Роль різноманітності дієт та індексів дієти на результати алергії Педіатрія