Захисний ефект екстракту поліфенолів адлаю (Coix lachryma-jobi L. var. Ma-yuen Stapf) на окислювальний стрес у щурів, викликаний гіперхолестеринемією
Ліфен Ван
1 Школа харчових наук та технологій, Університет Цзяньнань, Усі, Цзянсу 24122, Китай; Електронна адреса: moc.361@8_gnefilgnaw
2 Школа харчових наук та техніки, Нанкінський фінансово-економічний університет, Нанкін, Цзянсу 210046, Китай; Електронна адреса: [email protected] (Q.Y.); moc.621@0782gnefeuxgnaw (X.W.)
Jing Sun
3 Ключова лабораторія функціональної молочної промисловості, Коледж харчових наук та харчової інженерії, Китайський сільськогосподарський університет, Пекін 100083, Китай; Електронна адреса: ten.haey@423gnijs
Qida Yi
2 Школа харчових наук та техніки, Нанкінський фінансово-економічний університет, Нанкін, Цзянсу 210046, Китай; Електронна адреса: [email protected] (Q.Y.); moc.621@0782gnefeuxgnaw (X.W.)
Сюефен Ван
2 Школа харчових наук та техніки, Нанкінський фінансово-економічний університет, Нанкін, Цзянсу 210046, Китай; Електронна адреса: [email protected] (Q.Y.); moc.621@0782gnefeuxgnaw (X.W.)
Xingrong Ju
1 Школа харчових наук та технологій, Університет Цзяньнань, Усі, Цзянсу 24122, Китай; Електронна адреса: moc.361@8_gnefilgnaw
2 Школа харчових наук та техніки, Нанкінський фінансово-економічний університет, Нанкін, Цзянсу 210046, Китай; Електронна адреса: [email protected] (Q.Y.); moc.621@0782gnefeuxgnaw (X.W.)
Анотація
У цьому дослідженні вивчається вплив екстракту поліфенолів адлаю (Coix lachryma-jobi L. var. Ma-yuen Stapf) (APE) на щурів, що харчуються високим рівнем холестерину (HCD). APE вводили перорально з допомогою сорту в дозах 10, 40 і 200 мг загальної кількості фенолів/кг маси тіла щурів один раз на день протягом 28 днів. Наприкінці чотирьох тижнів тригліцериди сироватки крові (TG), загальний холестерин (TC), холестерин ліпопротеїдів низької щільності (LDL-C) і холестерин ліпопротеїнів високої щільності (HDL-C), а також маркери окисного стресу, а саме, малоновий диальдегід (MDA) ), супероксиддисмутазу (SOD), каталазу (CAT) та глутатіонпероксидазу (GSH-Px) у сироватці та печінці HCD та нормальних щурів оцінювали та порівнювали. Результати показали, що введення АПЕ було суттєво ефективним у зниженні рівня ТС, ЛПНЩ і МДА в сироватці крові, підвищення рівня ЛПВЩ-С в сироватці та антиоксидантної здатності. Крім того, пероральне введення АРЕ може також збільшити антиоксидантну здатність, CAT та GSH-Px активність у печінці. Ці результати свідчать про те, що АПЕ проявляє високу гіпохолестеринемічну та антиоксидантну активність, що може характеризуватися захисною дією на здоров’я серцево-судинної системи in vivo.
1. Вступ
Ішемічна хвороба серця (ІХС), яка тісно пов'язана з атеросклерозом, є основною причиною смерті в розвинених країнах. Однією з початкових подій у розвитку атеросклерозу є накопичення клітин, що містять надлишок ліпідів у стінці артерій. Гіперхолестеринемія, особливо підвищений рівень холестерину в сироватці крові та ліпопротеїдів низької щільності (ЛПНЩ), була причетна до ініціювання атеросклерозу [1]. Крім того, оксидативний стрес також пропонується як механізм, що лежить в основі гіперхолестеринемії, яка є важливим етіологічним фактором при атеросклерозі [2]. Згідно з гіпотезою окисної модифікації, окислення ЛПНЩ має вирішальне значення для клітинного поглинання ЛПНЩ на перших етапах розвитку атеросклеротичних бляшок [3]. В даний час зниження рівня ліпідів у сироватці крові та підвищення антиоксидантної здатності можна здійснити за допомогою ліків. Хоча хімічні препарати характеризуються хорошою ефективністю, вони не можуть задовольнити потреби всіх пацієнтів з гіперліпідемією через потенційні несприятливі ефекти. Порівняно з ліками, рослинні продукти, як правило, вважаються менш токсичними та менш схильними до побічних ефектів, і останнім часом їм приділяється все більше уваги [4].
2. Результати та обговорення
2.1. Фітохімічна речовина в фенольному екстракті Адлай (APE)
Вміст загальних фенольних речовин та загальних флавоноїдів АПЕ визначали для оцінки експозиції в різних групах. Наші дані показали, що загальний вміст фенольної та загальної кількості флавоноїдів АПЕ становив 20 мг еквіваленту галової кислоти (GAE)/г АПЕ та 12,3 мг еквівалента катехіну (CE)/г АПЕ відповідно.
Загальний вміст фенолу, про який повідомлялося в нашому дослідженні, був вищим, ніж раніше повідомляли Choi et al. [10]. Різні результати між двома дослідженнями в основному були зумовлені методом екстракції, оскільки метод, який ми використовували, міг витягувати як вільні, так і зв’язані фітохімікати, а не лише вільні фракції. Крім того, зв’язані фітохімікати стійкі до перетравлення шлунка та тонкої кишки і можуть потрапляти в товсту кишку, щоб виділити фітохімікати після ферментації бактеріями товстої кишки, що частково може бути відповідальним за користь цільного зерна для здоров’я, що знижує ризик раку товстої кишки [11 ]. Отже, використання методу вилучення загальних фенолів стосувалося не лише більшого вмісту, але й потенційних корисних функцій зв’язаних фітохімікатів. Більше того, наші результати щодо загального рівня флавоноїдів у складі ефіру були вищими, ніж у попередніх дослідженнях із використанням методу AlCl3 [7], який вимірював лише часткові флавоноїди. Дані вказують на те, що флавоноїди є однією з основних фітохімікатів, і, можливо, частково відповідають за потенційні оздоровчі ефекти адлей.
Відповідно до американських (2010) та китайських (2007) дієтичних рекомендацій [12,13], рекомендована щоденна норма споживання зерна становить приблизно від 170 до 400 г. Якби все зерно, яке ми споживали, було цільнозерновим, це означає, що ми б споживали 129–304 мг загальної кількості фенолів з адлаю на день, оскільки загальний вміст фенолів у адлаї становив 76,04 мг GAE/100 г сухої маси. Потім, перетворивши його на тваринну модель, воно дорівнювало 10–30 мг загальної кількості фенолів/кг маси тіла. Таким чином, у цьому дослідженні ми використовували 40 мг загальної кількості фенольних речовин/кг маси тіла як середню дозу та досліджували корисні ефекти меншої дози - 10 мг та вищої дози - 200 мг загальної кількості фенольних речовин/кг маси тіла, і дозозалежний спосіб серед них.
2.2. Вплив APE на збільшення маси тіла, споживання їжі та вагу печінки щурів
Як показано в таблиці 1, протягом чотирьох тижневого експерименту споживання їжі та ефективність корму щурів у всіх групах стабілізувались приблизно на рівні 30 г/добу та 16%, і ніяких суттєвих змін не спостерігалося. Крім того, в кінці експерименту серед п’яти груп не було значущих відмінностей у прирості маси тіла (132–142 г), вазі печінки (11,86–13,19 г) та індексі печінки. Результати можуть бути підтверджені попереднім дослідженням [14], припускаючи, що АПЕ не викликав серйозної токсичності у щурів.
Таблиця 1
Збільшення маси тіла, споживання їжі, ефективність харчування, маса печінки та печінковий індекс щурів.
| Контроль | 136 ± 19 | 31,45 ± 1,39 | 16,03 ± 2,18 | 11,86 ± 1,22 | 2,82 ± 0,20 |
| Чол | 134 ± 32 | 31,24 ± 2,41 | 15,93 ± 3,77 | 12,48 ± 1,84 | 2,99 ± 0,20 |
| Чол/LAPE | 132 ± 24 | 30,87 ± 1,15 | 15,79 ± 2,93 | 12,33 ± 0,95 | 2,96 ± 0,12 |
| Чол/КАРТА | 142 ± 24 | 31,91 ± 0,97 | 16,48 ± 2,80 | 13,19 ± 1,50 | 3,10 ± 0,11 |
| Чол/HAPE | 141 ± 32 | 29,89 ± 1,76 | 17,44 ± 3,91 | 12,32 ± 1,51 | 3,04 ± 0,10 |
Контроль, базальна дієта; Хол, дієта з високим вмістом холестерину; Chol/LAPE, Chol + 10 мг загальної кількості фенолів/кг маси тіла щурів; Chol/MAPE, Chol + 40 мг загальної кількості фенолів/кг маси тіла щурів; Chol/HAPE, Chol + 200 мг загальної кількості фенолів/кг маси тіла щурів. Ефективність годування = приріст маси тіла (г/д) × споживання їжі -1 (г/д) −1 × 100%. Індекс печінки = вага печінки (г) × приріст маси тіла -1 (г) -1-100.
2.3. Вплив APE на сироватковий ліпідний профіль щурів
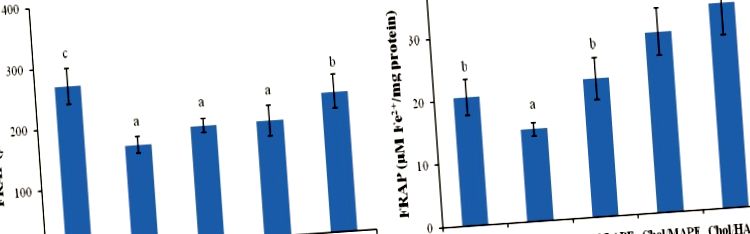
Вивчали in vivo гіпохолестеринемічну активність АПЕ, а параметри ліпідів у сироватці крові щурів серед усіх груп наприкінці дослідження були зведені на малюнок 1. Після чотирьох тижнів годування щури в групі Хол мали вищий загальний рівень холестерину (ТК) (2,3 ± 0,17 ммоль/л проти 1,92 ± 0,17 ммоль/л, р. Малюнок 2, рівень малонового діальдегіду в сироватці крові (MDA) щурів у група Хола продемонструвала помітне збільшення (8,52 ± 0,61 ммоль/л проти 7,33 ± 0,31 ммоль/л, р. Малюнок 3. Суттєвих змін (р> 0,05) в активності СОД, CAT та GSH-Px печінки між Контрольна група та група Хола, однак щури, які перорально отримували АПЕ у дозах 10, 40 та 200 мг загальної кількості фенольних речовин/кг маси тіла, призводили до значного підвищення дози (р 2+/мл проти 268,48 ± 29,25 мкМ Fe 2 +/мл; 14,66 ± 1,02 мкМ білка Fe 2+/мг проти 20,47 ± 2,86 мкМ білка Fe 2+/мг, p Рисунок 4).
Малюнок 4
Вплив APE на антиоксидантну здатність сироватки (A) та печінки (B) у щурів. Значення виражаються як середнє значення ± SD. Бари, що не мають загальних індексів, суттєво відрізняються (p Таблиця 2, і це розглядалося як нормальна дієта, тоді як дієта з високим вмістом холестерину була сформульована як 99% (мас./Мас.) Базальна дієта, доповнена 1% холестерину (мас.) Партії холестерину ретельно змішували з основними дієтами безпосередньо перед тим, як їх пропонували щурам [30]. Потім тварин випадковим чином розподіляли на п’ять груп по вісім тварин у кожній та отримували такі процедури: базальна дієта (контрольна група); дієта з високим вмістом холестерину (група Хола); дієта з високим вмістом холестерину + загальна кількість фенольних речовин 10 мг/кг маси тіла щурів (група Чол/LAPE); дієта з високим вмістом холестерину + загальна кількість фенольних речовин 40 мг/кг маси тіла щурів (Хол/МАПЕ група) та дієта з високим вмістом холестерину + загальна кількість фенольних речовин 200 мг/кг маси тіла щурів (група Chol/HAPE). Дієтичне споживання вимірювали щодня, а масу тіла реєстрували кожні шість днів. Водні суспензії АПЕ обробляли ультразвуком та енергійним вихором до введення. Усі суспензії іони (2 мл) вводили зондом один раз на день. Для збереження біоактивності APE суспензії слід готувати щодня.
Таблиця 2
Склад раціонів тварин.
| Казеїн | 182 | 180 |
| Соєва олія | 61 | 60 |
| Крохмаль пшеничний | 687 | 680 |
| Холестерин | 0 | 10 |
| Вітамінна суміш | 10 | 10 |
| Мінеральна суміш | 60 | 60 |
Вітаміни (на кг дієти): тіамін, 20 мг; рибофлавін, 15 мг; піридоксин, 10 мг; нікотинамід, 100 мг; пантотенат кальцію, 70 мг; фолієва кислота, 5 мг; біотин, 0,3 мг; ціанокобаламін, 0,05 мг; ретинілпальмітат, 1,5 мг; дл-а-токоферилацетат, 125 мг; холекальциферол, 0,15 мг; менадіон, 1,5 мг; аскорбінова кислота, 50 мг; міо-інозитол, 100 мг; носій пшеничного крохмалю, 1,36 г. Мінерали (на кг дієти): CaHPO4, 15 г; K2HPO4, 2,5 г; KCl, 5 г; NaCl, 5 г; MgCl2, 2,5 г; Fe2O3, 2,5 мг; Mn2SO4, 125 мг; CuSO4 · 7H2O, 0,2 мг; ZnSO4 · 7H2O, 100 мг; KIO3, 0,4 мг.
Після чотирьох тижнів експериментальних дієт тварини голодували протягом 16 годин. На наступний день, після реєстрації маси тіла, проби крові відбирали шляхом серцевої пункції під наркозом діетилового ефіру. Сироватку отримували центрифугуванням 3000 г протягом 15 хв при 4 ° C і негайно зберігали при -80 ° C до аналізу. Потім тварин приносили в жертву, а печінку виймали, зважували та негайно зберігали при -80 ° C для подальшого аналізу.
3.5. Аналіз ліпідів у сироватці крові
Рівні вмісту TC, TG, LDL-C та HDL-C у сироватці крові оцінювали за допомогою комерційно доступних наборів згідно з інструкціями виробника з клінічним аналізатором 7020 (Hitachi, Токіо, Японія).
3.6. Аналіз перекисного окислення ліпідів та антиоксидантних профілів
Концентрацію MDA в сироватці крові визначали за допомогою набору аналізів на реакційноздатні речовини тіобарбітурової кислоти, який базувався на реакції MDA з тіобарбітуровою кислотою з отриманням кольорового продукту, який можна виміряти при 532 нм за допомогою спектрофотометра UV-2102 (Unico Instruments Co., Ltd ., Шанхай, Китай).
Антиоксидантну здатність гомогенатів сироватки та печінки аналізували методом відновлення заліза/антиоксидантної сили (FRAP) [32]. Антиоксидантну активність оцінювали шляхом вимірювання здатності зразків відновлювати трипіридилтріазин заліза (Fe 3+ -TPTZ) до комплексу трипіридилтріазину заліза (Fe 2+ -TPTZ), який має інтенсивний синій колір, який контролюється при 593 нм. Коротко кажучи, 20 мкл зразків сироватки або гомогенатів печінки змішували на 96-лунковому планшеті з 200 мкл реагенту FRAP. Зразки інкубували протягом 10 хв при 37 ° С, а потім поглинання при 593 нм реєстрували на зчитувачі мікропланшетів (Bio-Rad, Hercules, CA, USA). Значення FRAP, отримані в результаті триразових аналізів, були виражені як мікромолельне заліза на мл на антиоксидантну здатність сироватки та мікромолельне заліза на мг на білок для антиоксидантної здатності гомогенатів печінки.
- Захисна дія та терапевтичний індекс індраліну у неповнолітніх мавп-резусів
- Гель для миття обличчя Шунгіт з омолоджуючим ефектом 200 мл, натуральна косметика для обличчя Шунгіт
- Екстракт гарцинії камбоджійський надзвичайно тонкий від 1000 мг до 1500 мг Кращі відгуки
- Ритуали проходження є необхідністю Ефект лоботомізації непереборного дитинства; Натхненна людина
- Екстракт чистого зеленого зерна кави - Форуми InfantRisk