Вміст макроелементів у об’єднаному донорському жіночому молоці до та після пастеризації Холдера
Анотація
Передумови
Донорське жіноче молоко (DHM) є найкращою альтернативою для недоношених дітей, коли молоко власної матері недоступне. DHM слід пастеризувати, щоб гарантувати мікробіологічну безпеку; однак цей процес може впливати на вміст макроелементів.
Метою цього дослідження було дослідити вплив пастеризації Холдера (HoP) на вміст макроелементів DHM.
Методи
Білок, лактоза, ліпіди (г/100 мл) та енергія (ккал/100 мл) пулів DHM аналізували до та після HoP (62,5 ° C протягом 30 хв) за допомогою інфрачервоної спектроскопії (HM-аналізатор Miris AB®). Середній вміст макроелементів до та після HoP порівнювали за допомогою парного t-тесту. Розраховано процентне зменшення (дельта%).
Результати
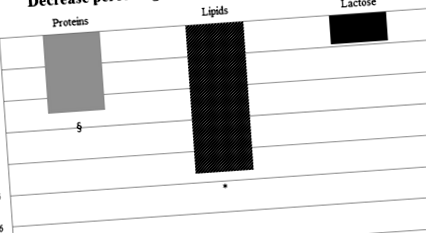
Визначено зміну вмісту макроелементів у 460 пулах. Білок, ліпіди та лактоза значно зменшились після HoP (0,88 ± 0,20 проти 0,86 ± 0,20 та 2,91 ± 0,89 проти 2,75 ± 0,84 та 7,19 ± 0,41 проти 7,11 ± 0,48 відповідно). Значення дельта% становили - 2,51 ± 13,12, - 4,79 ± 9,47 та - 0,92 ± 5,92 для білка, ліпідів та лактози відповідно (стор ≤ 0,001).
Висновок
Це дослідження підтверджує, що вміст макроелементів DHM, особливо щодо ліпідів та білків, знижується після HoP. Отже, для того, щоб виконати індивідуальне укріплення ДГМ, клініцисти повинні знати про дещо зменшений вміст поживних речовин ДГМ.
Передумови
Людське молоко широко визнано оптимальним вигодовуванням для новонароджених, особливо для недоношених дітей, через його різноманітні переваги з точки зору імунологічних, шлунково-кишкових та нервово-розвитку функцій [1].
Коли молоко власних матерів недоступне або недостатнє для задоволення вимог недоношених дітей, донорське жіноче молоко (ДГМ) є найкращою альтернативою для цих вразливих немовлят [2].
Дані вказують, що донорське жіноче молоко, особливо у поєднанні з молоком власних матерів, сприяє зменшенню частоти некротизуючого ентероколіту [3], пізнього сепсису [4] та бронхолегеневої дисплазії [5] та покращує толерантність до годування [6], порівняно до штучного вигодовування.
DHM слід пастеризувати, щоб гарантувати його мікробіологічну безпеку: пастеризація Холдера (HoP), проведена при 62,5 ° C протягом 30 хв, рекомендована у міжнародних рекомендаціях щодо банку жіночого молока [7,8,9]. В установі авторів DHM використовується для годування недоношених дітей (вага при народженні
Методи
Вміст макроелементів у зведеному DHM Банку людського молока в установі авторів визначали до та після HoP. Усі донори підписали письмову інформовану згоду на передачу свого молока для клінічного або дослідницького використання, тому комісія з питань етики Авторської установи постановила, що в цьому конкретному випадку офіційне затвердження етики не вимагається.
Відповідно до нашої внутрішньої процедури, критеріями включення донорів були: здорові матері протягом 15 днів до 12 місяців після пологів. Критерії виключення були перераховані в Керівних принципах італійської асоціації банків людського молока [15].
DHM виражали вручну або за допомогою електричного молочного насоса. Стерильні поліпропіленові пляшки використовувались для зберігання молока, зібраного протягом 24 годин, у будинках донорів. Усі зразки донорського молока заморожували у морозильній камері при температурі - 20 ° C у донора, а температуру контролювали за допомогою термометра, наданого Банком людського молока установи автора. Холодильний транспорт забезпечив холодний ланцюг молока від будинків донорів до банку молока. Згідно з італійськими рекомендаціями щодо Банку людського молока, час між датою збору молока та пастеризацією не може перевищувати 3 місяців.
DHM відбирали і розморожували протягом ночі в холодильнику. Згодом пляшки з молоком нагрівали до 40 ° C за допомогою термостатичної ванни, щоб забезпечити належну гомогенізацію зразків. Після цього пляшки з молоком перемішували та об’єднували, щоб створити пули з кількома донорами.
Усі процедурні етапи вимагали суворого дотримання асептичних методів, що досягається використанням кабінету біологічної безпеки.
З кожного пулу DHM було підібрано три аликвоти сирого молока по 10 мл, і одна з цих аліквот була зарезервована для перевірки мікробіологічної безпеки після пастеризації. Два інших зразки аналізували, один до і другий після пастеризації, на вміст макроелементів. Вміст білка, лактози та ліпідів у пулі DHM вимірювали за допомогою інфрачервоної спектроскопії, яка є сертифікованим методом аналізу жіночого молока. Аналізатор людського молока (HMA, Miris AB®, Упсала, Швеція) був розроблений для визначення фізіологічних змін у макроелементах жіночого молока. Прилад відкалібрований для вимірювання грудного молока з використанням методу Кельдаля для білка, ВЕРХ для лактози та методу Роуза - Готліба для жиру. HMA використовували в режимі для переробленого молока [16]. Були проведені аналізи зразків по 10 мл кожного пулу, які попередньо гомогенізували за допомогою ультразвукового гомогенізатора (Sonicator®, Уппсала, Швеція) зі швидкістю 1,5 с/мл, щоб гарантувати найкращу солюбілізацію жиру та руйнування міцел казеїну. Ці зразки розділили на три аликвоти по 3,3 мл, які аналізували за допомогою HMA.
Для отримання надійних результатів температуру всіх зразків контролювали за допомогою цифрового зондового термометра. Температуру підтримували від 35 до 40 ° C, як рекомендував виробник аналізатора жіночого молока.
Аналізи показують вміст білка, лактози та ліпідів (г/100 мл) та енергії (ккал/100 мл), який розраховується наступним чином: (9,25 Ккал/г х жиру г/100 мл) + (4,40 Ккал/г х білка г/100 мл) + (3,95 Ккал/г х лактози г/100 мл). Для кожного зразка було проведено три вимірювання, і були враховані середні значення макроелементів та енергії. Басейни DHM пастеризували пастеризатором людського молока (пастеризатор S90 Eco, стерилізований, Medicare Colgate Ltd., Англія) методом Холдера (62,5 ° C протягом 30 хв), відповідаючи вимогам міжнародних донорських банків людського молока [7,8,9].
Статистичний аналіз
Описові дані щодо білка, ліпідів, лактози та енергії подаються як середні значення та стандартні відхилення (середнє значення ± SD), будучи даними з нормальним розподілом. Вміст макроелементів до та після HoP порівнювали за допомогою парних t-тестів.
Варіації білка, ліпідів, лактози та енергії також розраховували як процентне зменшення (дельта%), що представляє співвідношення між різницею в макроелементах до і після пастеризації та значенням макроелементів до пастеризації. Для оцінки будь-яких відмінностей між зменшенням білка, ліпідів та лактози був проведений аналіз t-тесту.
Значення стор
Результати
Загалом 191 матір-донор була зарахована в період з квітня 2016 року по квітень 2018 року до банку людського молока клініки Мангіагаллі в Мілані, Італія. Інформована згода була отримана від усіх матерів. Середній вік донорів, включених у дослідження, становив 35,01 ± 4,23 року. Їх середня тривалість гестації становила 38,51 ± 2,73 тижні, розподілених наступним чином: 4,0% - до 32 тижнів, 5,1% - від 32 до 36 тижнів та 90,9% - після 37 тижнів. Початок донорства відбувся через 2,9 ± 2,3 місяці після пологів.
Склад макроелементів 460 пулів оцінювали до та після HoP. Басейни мали середній об’єм 1607,78 ± 644 мл, і кожен пул містив внески від 3,5 ± 1,7 матерів.
Обсяг молока, отриманого від різних донорів, був однаково збалансований для кожного пулу.
Середній вміст макроелементів до і після пастеризації описано в таблиці 1.
Як показано в таблиці 1, концентрація всіх макроелементів значно зменшилася після процесу пастеризації.
Середній дельта% становив - 2,51 ± 13,12% для білка; - 0,92 ± 5,92% для лактози, - 4,79 ± 9,47% для ліпідів та - 2,48 ± 5,19 для енергії. Серед усіх макроелементів ліпіди та білки мали найбільше зниження макроелементів після пастеризації, тоді як лактоза демонструвала незначне зниження (рис. 1).
Обговорення
Це дослідження показує, що HoP значно зменшує вміст макроелементів DHM. Ліпіди та білки є найбільш ураженими компонентами, тоді як лактоза дещо знижується. Отже, зменшення енергетичного вмісту відбувається головним чином за рахунок зменшення вмісту ліпідів.
Кілька досліджень показали значні зміни вмісту макроелементів DHM після пастеризації. Вієйра та ін., Проаналізувавши 57 зразків сирого людського молока, виявили значне зниження середньої концентрації жиру та білка після пастеризації (5,5 та 3,9% відповідно) [17]. Гарсія-Лара та ін., Загалом у 34 зразках замороженого грудного молока спостерігали значне зниження жиру (3,5%) та енергетичного вмісту (2,8%) після пастеризації, але суттєвих змін вмісту азоту не спостерігалось [18].
Щодо лактози, нещодавній огляд показав, що навіть із використанням різних аналітичних методів HoP не впливає суттєво на вуглеводи [13].
Процеси заморожування, розморожування та пастеризації можуть зменшити загальну антиоксидантну здатність молока [18]. Така поява та прилипання людського молочного жиру до стінки пляшки може навіть збільшити втрату ліпідів [19].
Для того, щоб обмежити залишкові поживні речовини, прикріплені до стінок контейнерів, усі пляшки з молоком нагрівали до 40 ° C за допомогою термостатичної ванни, щоб забезпечити належну гомогенізацію зразків. Крім того, щоб уникнути можливого упередження щодо визначення вмісту макроелементів, для збору та зберігання молока для всіх донорів до та після пастеризації використовували однотипні поліпропіленові контейнери.
Загальновідомо, що пастеризація впливає на біоактивні білки, які вищі в молозиві порівняно зі зрілим молоком [13,14,15,16,17,18,19,20]. Школа повинна зазначити, що у дослідження, як це рекомендовано у внутрішній процедурі автора, були включені донори принаймні через 15 днів після пологів, а середній післяпологовий вік на початку донорства становив 2,9 місяця життя. Отже, все пастеризоване молоко було зрілим. Крім того, використання об’єднаного молока має ту перевагу, що воно включає молоко від донорів на різних етапах лактації.
Завдяки своєму загальновідомому сприятливому ефекту запобігання супутнім захворюванням недоношеним немовлятам, DHM є найкращою альтернативою власному молоку матері у порівнянні з годуванням сумішами [21, 22]. Однак зміни DHM після HoP мають клінічні наслідки, які є основною проблемою для забезпечення адекватного постнатального росту. Дійсно, для досягнення високих потреб у харчуванні недоношених дітей [23], обов’язковим є укріплення, яке враховує зміни вмісту макроелементів, спричинені HoP. Індивідуальний підхід до укріплення ДГМ, враховуючи незначне зниження лактози після HoP порівняно з ліпідами та білками, не призведе до надмірного збільшення осмолярності без подальшої зміни шлунково-кишкової непереносимості. Дійсно, хоча нинішні рекомендації не ґрунтуються на вагомих наукових доказах, рекомендується, щоб осмолярність не перевищувала 450 мОсм/кг (тобто осмолярність 400 мОсм/л), щоб зменшити шлунково-кишкову толерантність і ризик некротизуючого ентероколіту [24].
Добре відомо, що HoP впливає на стимульовану жовчою сіллю ліпазу (BSSL), яка відповідає за перетравлення та всмоктування жиру [17]. У недавньому рандомізованому контрольованому дослідженні, проведеному з недоношеними дітьми, повідомляється, що інактивація BSSL не впливала на шлункове перетравлення ліпідів і що загальна кількість вільних від жиру кислот, що виділяються з тригліцеридів молока, від 35 до 90 хв після шлункового перетравлення. не було змінено HoP. Однак BSSL може впливати на травлення кишечника жиру, особливо для недоношених дітей, у яких є незріла людська ліпаза підшлункової залози [25].
Незважаючи на те, що HoP насправді є рекомендованим методом у всіх міжнародних рекомендаціях щодо банку людського молока [7,8,9], існує потреба дослідити інші процеси нагрівання, здатні обробляти DHM для забезпечення мікробіологічної безпеки при збереженні біоактивних та поживних компонентів молока . Баро та ін. досліджували різний вплив HoP та високотемпературної короткочасної пастеризації (HTST) на білковий профіль людського молока [26]. Крім того, в недавньому огляді Peila et al. досліджували інші технології обробки, крім HoP, зосереджуючись, зокрема, на обробці високого тиску, HTST, ультрафіолетовому опроміненні та ультразвуковій обробці. Автори дійшли висновку, що даних про мікробіологічну безпеку та про поліпшення харчових якостей та біоактивності молока, пастеризованого за цими новими технологіями, все ще мало [27].
Відомо, що для забезпечення адекватного постнатального росту недоношених дітей переважним є використання спеціального збагаченого жіночого молока [28, 29]. У цьому дослідженні було продемонстровано, що HoP призводить до зменшення макроелементів у жіночому молоці. Це зменшення, хоча і є значним, є клінічно досить неактуальним, перш за все, оскільки DHM має бути укріпленим, оскільки це, як правило, зріле молоко, яке здають жінки, які народили доношених дітей.
Висновки
Це дослідження продемонструвало, що пастеризація Холдера змінює вміст макроелементів у донорському жіночому молоці, особливо зменшуючи вміст ліпідів та білка.
- Вміст макроелементів у грудному молоці людини-донора - PubMed
- Лецитин зменшує втрату жиру в людському молоці під час ентерального відкачування - PubMed
- Розмова про каву для гурманів Яка їх калорійність та жирність Іди запитай Алісу!
- Отримав тарганове молоко HowStuffWorks
- Instagram вживає заходів щодо зниження ваги та вмісту косметичної хірургії - Business Insider