Витоки ожиріння в розвитку: запрограмований адипогенез
Міна Десай
1 Перинатальні дослідницькі лабораторії, кафедра акушерства та гінекології, Медична школа Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, 200 Medical Plaza, Suites 430 і 200, Лос-Анджелес, Каліфорнія, 90095, США;
2 Лос-Анджелеський біомедичний науково-дослідний інститут при Медичному центрі Харбор-UCLA, 1000 W. Карсон-стріт, Торранс, Каліфорнія 90509, США.
Марі Білл
3 Перинатальна асоціація Лос-Анджелеса, Лос-Анджелес, Каліфорнія, США
Майкл Г. Росс
1 Перинатальні дослідницькі лабораторії, кафедра акушерства та гінекології, Медична школа Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, 200 Medical Plaza, Suites 430 і 200, Лос-Анджелес, Каліфорнія, 90095, США;
2 Лос-Анджелеський біомедичний науково-дослідний інститут при Медичному центрі Харбор-UCLA, 1000 W. Карсон-стріт, Торранс, Каліфорнія 90509, США.
Анотація
Епідемія метаболічного синдрому, включаючи помітне збільшення поширеності ожиріння та гестаційного цукрового діабету (GDM) серед вагітних жінок, представляє значну проблему громадського здоров'я. Зростає визнання того, що на ризик ожиріння дорослих явно впливає пренатальне та дитяче вплив навколишнього середовища, особливо харчування. Цей принцип є фундаментальною основою програмування розвитку. Низька вага при народженні, разом із зростаючим ріст немовлят, асоціюється із значним ризиком ожиріння дорослих. Вплив ожиріння матері, із ГДМ або без нього, або з високою вагою при народженні також представляє підвищений ризик ожиріння серед дітей та дорослих. Моделі на тваринах повторили епідеміологічні висновки людини та висвітлили потенційні механізми програмування, які включають змінений розвиток органів, відповіді клітинних сигналів та епігенетичні модифікації. Пренатальна допомога досягла значних успіхів в оптимізації здоров’я матері, плода та новонароджених, і тепер вона має можливість розпочати втручання, що попереджають або зменшують ожиріння у дітей/дорослих. Рекомендації, що поєднують оптимальне харчування для вагітних та збільшення ваги, управління GDM та стратегії годування новонароджених, що мають довгострокові наслідки для ожиріння дорослих, залишаються незрозумілими.
Вступ
Важко переоцінити значення постійно розвивається епідемії глобального ожиріння, наслідки патологій, що розвиваються, та їх колективний вплив на здоров'я, добробут та якість життя. Ожиріння та пов'язані з ним захворювання є основною причиною смерті в західному суспільстві. В даний час 65% дорослих у Сполучених Штатах мають надлишкову вагу і більше третини страждають ожирінням [1], що є сучасною кризою в галузі охорони здоров'я. Гірше того, епідеміологічні дані вказують на те, що ожиріння продовжує невпинно зростати, особливо серед негрів та латиноамериканців. Паралельно зростає рівень цукрового діабету 2 типу (СД) у США та у всьому світі [2]. Що викликає занепокоєння акушерів, спостерігається помітне і постійне зростання поширеності ожиріння та гестаційного СД серед вагітних (
30%) [3,4], фактор, пов’язаний як з новонародженими з високою вагою, так і з відомим фактором ризику ожиріння у дітей [5,6]. Оскільки дитяче ожиріння є основним фактором ризику ожиріння у дорослих [7], 20% випадків ожиріння серед дітей [8] віщує подальше збільшення поширеності ожиріння серед дорослих та СД.
Ожиріння часто відносять до дієти із високим вмістом жиру в західному стилі в поєднанні зі зниженням рівня активності. Хоча мало сумнівів, що ці фактори є сильними чинниками, що визначають ожиріння, довготривала стійкість до дієти в поєднанні з фізичними вправами в основному виявилася невдалою. Останніми роками є переконливі дані нашої лабораторії та інших, які підтверджують ідею, що походження ожиріння починається ще внутрішньоутробно. Оскільки плід, що розвивається, залежить від харчової, гормональної та метаболічної середовищ матері, будь-яке збурення, яке «програмує» структуру органу, клітинний склад, експресію генів та/або епігеном, може в кінцевому рахунку змінити метаболізм та функції. Що важливо, взаємодія з постнатальним середовищем та ріст новонароджених додатково модулюють сприйнятливість до ожиріння. Цей огляд фокусується на впливі на пренатальний/неонатальний ріст та адипогенез на розвиток ожиріння.
Харчування та ріст
Зростання тканин і органів під час розвитку передбачає проліферацію, диференціацію та міграцію клітин в організовані структури. У людей, як і у інших видів ссавців, основна частина процесу розвитку, що стосується поділу клітин, відбувається протягом внутрішньоутробного життя, підкреслюючи необхідність оптимального внутрішньоутробного середовища. Безперечно, тому харчування є одним із наріжних каменів росту, розвитку та здоров’я. Заслуга харчових добавок, особливо під час вагітності, очевидна, як було продемонстровано при застосуванні йоду та фолієвої кислоти у профілактиці йоду, спричиненого дефіцитом йоду, кретинізму та спина біфіда відповідно. Сфера розвитку хвороб дорослих включає це явище і віщує, що неоптимальне материнське харчування впливає на ріст плоду, що веде до захворювань дорослих. На додаток до харчових впливів, фактори, включаючи GDM, стрес матері, передчасні пологи та терапію глюкокортикоїдами, серед інших, можуть суттєво впливати на здоров'я та захворювання дорослих. Докази концепції програмування здоров’я та хвороб дають як дослідження на людях, так і моделі на тваринах, які використовували вагу народження як приблизний показник внутрішньоутробного росту та розвитку.
Вплив матері на вагу при народженні
Крім генетичного потенціалу плода, харчування матері, оксигенація та перфузія плаценти мають переважний вплив на вагу при народженні. Моделі тварин, що використовують обмеження поживних речовин матері, плацентарну перев’язку маткових артерій або вплив глюкокортикоїдів, ефективно повторили результати, пов’язані з низькою вагою при народженні (LBW) [9-12]. І навпаки, надмірне харчування матері, спричинене ожирінням, дієтою з високим вмістом жиру або надмірною вагою під час вагітності, повідомляє про різний вплив на вагу при народженні. Однак у дорослих нащадків постійно спостерігається ожиріння та порушення обміну речовин [13-15], що свідчить про внутрішньоутробне програмування. Нащадки жінок із ГРМ постійно перевищують звичайний контроль, вага тіла при народженні пропорційна середньому рівню глюкози [16].
На сьогодні невідомо, чи ефекти програмної діяльності макросомії, пов’язаної з GDM, відрізняються від ефекту лише ожиріння матері.
Асоціація між вагою при народженні та ожирінням
Епідеміологічні дослідження та моделі на тваринах пов'язують вагу при народженні з ризиком ожиріння дорослих та метаболічним синдромом, включаючи резистентність до інсуліну. Особливо у людей як низька, так і висока вага при народженні призводять до підвищеного ризику ожиріння у дітей та дорослих, що свідчить про підвищений ризик ожиріння на обох кінцях спектру ваги при народженні [17,18].
Висока вага при народженні
Ожиріння під час вагітності має не тільки негативні наслідки для здоров'я матері та результатів вагітності, але й для плоду, що розвивається. Зокрема, ожиріння матері до і під час вагітності, включаючи збільшений приріст ваги під час вагітності, асоціюється з вищою масою тіла при народженні [16,19], а також з меншою вагою новонароджених, що пізніше призводить до частково збільшеного ризику передчасних пологів [ 20]. Збільшення ІМТ матері на 25–36% за останнє десятиліття призвело до приблизно 25% збільшення захворюваності на дітей з високою вагою при народженні [21]. Це особливо важливо, оскільки новонароджені з високою вагою при народженні демонструють збільшення маси жирової тканини та підвищений ризик ожиріння та ризику діабету в подальшому житті (огляд [22]). Однак дослідження як на людях, так і на тваринах вказують на те, що підвищений ІМТ перед вагітністю матері та надмірне збільшення ваги матері під час вагітності є більшими предикторами ожиріння потомства, ніж висока вага новонароджених [5,23,24]. Оскільки більшість жінок GDM страждають ожирінням, ефекти незалежного програмування GDM є невизначеними.
Низька вага при народженні
Ранні епідеміологічні дослідження спочатку продемонстрували, що немовлята з низьким рівнем тяжкості з швидким зростанням наздоганяння мають вищий ризик ожиріння та метаболічного синдрому. Поширеність метаболічного синдрому поступово зростала як серед чоловіків, так і серед жінок, від тих, хто мав найбільший до тих, хто мав найменшу вагу при народженні. З 64-річних чоловіків, вага яких при народженні становив 6,5 фунта або менше, 22% мали метаболічний синдром. Ті, у кого найнижча маса тіла при народженні, мали в 10 разів більше шансів мати метаболічний синдром порівняно з тими, хто був найважчим при народженні [25,26]. Знижений рівень ожиріння серед важких немовлят (народжених у 1935-1943 рр.), Також свідчить про те, що ожиріння матері та дієта/збільшення ваги при вагітності мають більший вплив на програмування ожиріння у нащадків, ніж лише вага при народженні. Численні епідеміологічні дослідження з різних груп населення підтверджують цю взаємозв'язок [17].
U-подібна крива
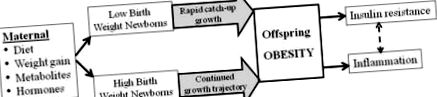
Епідеміологічні дослідження підтверджують, що взаємозв'язок між вагою при народженні людини та ожирінням дорослих, гіпертонічною хворобою та/або резистентністю до інсуліну є "U-подібною кривою" [27-30]. Можливо, найголовніше, що відношення росту плода до ожиріння потомства та метаболічного синдрому є континуумом [25], а не пороговою реакцією. Цілком може бути оптимальна вага новонародженого (потенційно специфічна для окремої матері), при якій програмування потенціалу ожиріння зводиться до мінімуму. Однак, в межах діапазонів меншої або вищої ваги при народженні порівняно із середніми значеннями, дослідження вказують на градацію схильності до програмування наслідків. Таким чином, відхилення від «оптимального» внутрішньоутробного росту, будь то від обмеженого або надмірного харчування, збільшують відносний ризик метаболічного синдрому у дорослих (рис. 1).
Змінене материнське харчування, гормональне середовище чи середовище метаболітів впливають на ріст плода, що призводить до новонароджених із низькою або високою вагою. В результаті цього відхилення внутрішньоутробного розвитку в поєднанні з прискореним/подібним постнатальним ростом викликає посилений адипогенез, що призводить до ожиріння у дітей та дорослих. Ожиріння в свою чергу призводить до інсулінорезистентності та запалення.
Аддитивний ризик постнатального зростання
Незважаючи на те, що довгострокові наслідки LBW пов'язані з ожирінням дорослих, кілька досліджень продемонстрували згубні наслідки зростання новонароджених або дітей в дитинстві (малюнок 1). Ті немовлята, які народились малими та залишаються малими, мають менший ризик ожиріння та метаболічного синдрому, а немовлята, які наздоганяють і перевищують нормальну вагу в дитинстві або в ранньому юнацькому віці [31,32]. Важливо зазначити, що НЛМ або недоношені діти з нагнаним зростанням у ранньому віці мають меншу масу тіла та більший жир, що демонструє переважний розподіл у животі [33,34]. Подібне явище спостерігається у новонароджених із нормальною вагою при народженні, у яких спостерігається прискорене збільшення ваги протягом перших двох років життя [35].
Ці висновки були успішно відтворені на тваринних моделях з використанням пренатального обмеження поживних речовин для вироблення НВВ новонароджених з подальшим нормальним годуванням для сприяння зростаючому зростанню. У дорослому віці потомство ЛБВ не тільки має більшу масу тіла та жир [36-39], але демонструє більшу сприйнятливість до дієт з високим вмістом жиру [40]. І навпаки, запобігання зростаючому зростанню новонароджених ЛБВ запобігає фенотипу дорослих із ожирінням [37]. Ці результати дозволяють припустити, що ступінь посилення поживних речовин для новонароджених та терміни зростання наздоганяючих новонароджених можуть визначати програмування ожиріння потомства [37,41]. Фундаментальне питання, яке виникає, полягає в тому, який механізм регулює переважне накопичення жиру [42] у цих нащадків. Знову ж таки, моделі на тваринах дали початкове розуміння того, що пренатальні фактори призводять до програмування гіперфагії, зменшення енергетичних витрат та/або посилення адипогенезу, що призводить до схильності до накопичення жиру у потомства [43-46].
Зростання та накопичення жиру
Адипоцити - це вузькоспеціалізовані клітини, які підтримують енергетичний гомеостаз всього тіла, регулюючи обмін глюкози та ліпідів [47]. Зовсім недавно адипоцити визнані за їх роль у запаленні та імунній відповіді [48]. Жирова тканина містить функціонально різні клітинні підтипи з білими адипоцитами, що служать депоми для зберігання енергії, тоді як коричневі адипоцити розсіюють енергію за допомогою термогенезу. Зберігання жиру сприяє інсулін, який стимулює поглинання адипоцитів і ліпогенез. Зміна маси жирової тканини, збільшення циркулюючих вільних жирних кислот та/або розподіл палива на адипоцити може призвести до дисліпідемії, ожиріння, резистентності до інсуліну та СД.
Збільшення жирової маси або адипогенез відбувається переважно під час пренатального та постнатального розвитку, хоча певний адипогенез триває протягом усього дорослого віку [49]. Процес адипогенезу включає диференціацію преадипоцитів до зрілих адипоцитів, які можуть накопичувати жир. Шлях диференціації жорстко регулюється каскадом факторів транскрипції, які помітні в преадипоцитах і послідовно виражаються у відповідь на подразники (поживні речовини, гормони), ймовірно, під впливом епігенетичного механізму (рис. 2). Обезогени, включаючи фактори навколишнього середовища, можуть змінювати ключові адипогенні шляхи, включаючи адипогенні фактори транскрипції, шляхом епігенетичних модифікацій промоторів або гістонів [50].
Адипогенез - це процес диференціювання клітин, за допомогою якого преадипоцити стають адипоцитами. Підвищений запас поживних речовин або підвищений рівень гормонального вмісту (наприклад, інсулін, кортикостерон, IGF1) стимулюють проліферацію та диференціацію клітин. Індукції диференціації адипоцитів сприяє адипогенний фактор транскрипції (PPARg), а накопичення жиру - ліпогенний фактор транскрипції (SREBP1). Підвищений адипогенез пов’язаний зі збільшенням інфільтрації макрофагів та посиленням секреції продіабетиків (TNFα, IL-6, лептин, вісфатин) із зменшенням секреції адипоцитокінів проти діабету (адипонектин).
Регуляція адипогенезу та ліпогенезу
Індукція диференціації адипоцитів зумовлена факторами транскрипції PPAR (активований проліфератором пероксисом рецептор) та C/EBP (білки, що зв’язують CCAAT-енхансер) [51-53]. З них, основний адипогенний фактор транскрипції, PPAR 2γ індукує ліпогенний фактор транскрипції SREBP1 (білок, що зв’язує регулюючий елемент стеролу), тим самим ініціюючи як диференціацію адипоцитів, так і ліпогенез [54-56]. SREBP1 також може активувати PPARγ, стимулюючи продукцію ендогенного ліганду [57], а також індукуючи активність промотору PPAR [54,57]. Ці дані свідчать про механізм зворотного зв'язку, в якому PPAR активує SREBP1 і навпаки, і який спрямований на сприяння адипогенезу та ліпогенезу [55]. SREBP1 сприяє ліпогенезу шляхом індукції позаклітинного ліполітичного ферменту (ліпопротеїнової ліпази) та ліпогенного ферменту (синтази жирних кислот), що, в свою чергу, призводить до збільшення поглинання та синтезу жирних кислот, сприяючи накопиченню ліпідів у адипоциті [58,59]. Вивільненню вільної жирної кислоти з адипоцитів сприяє внутрішньоклітинний ліполітичний фермент, гормоночутлива ліпаза [60].
Синтез жирних кислот (за допомогою ліпогенезу de novo) та тригліцеридів є важливими факторами накопичення жиру. Тригліцериди, призначені для накопичення жиру в жировій тканині, складаються з жирних кислот з дієтичних джерел та синтезу de novo. Синтезовані жирні кислоти De novo можуть зазнати модифікації шляхом створення подвійних зв’язків шляхом зненасичення та/або подальшого подовження за рахунок подовження ланцюга. Хоча синтез de novo та подовження ланцюга сприяють накопиченню енергії, розщеплення жирних кислот шляхом укорочення ланцюга та β-окислення сприяють вивільненню енергії. Оскільки тригліцериди включаються в жирову тканину для зберігання, збільшення співвідношення мононенасичених до насичених жирних кислот, отже, збільшує схильність до накопичення жиру [61].
Порушення метаболічної мережі може зрушити енергетичний баланс у бік збільшення виділення енергії або, як при ожирінні, збільшення накопичення енергії. Дослідження на тваринах дають деяке розуміння основної механістичної основи для запрограмованого посиленого адипогенезу/ліпогенезу або зміни функції/відповіді адипоцитів.
Вплив посиленого адипогенезу на ЦД у нащадків
Показано, що посилене накопичення жиру, особливо вісцерального, спричиняє порушення метаболізму глюкози та ліпідів, що призводить до інсулінорезистентності та СД [62]. Основна механістична основа включає збурення у виробництві жирових «адипоцитокінів», які модулюють чутливість до інсуліну. У стані ожиріння жирова тканина виділяє пропорційно більше адипокінів, що спричиняють резистентність до інсуліну (наприклад, TNFα, IL-6, лептин), і менше, що сприяють чутливості до інсуліну (наприклад, адипонектин) [63-65]. Дійсно, численні дослідження на людях підтвердили, що підвищення рівня TNFα, IL-6 та лептину та зниження рівня адипонектину у плазмі крові пов'язане із ожирінням/резистентністю до інсуліну [66-69] Цей зв'язок нещодавно був продемонстрований при ожирінні у дітей, припускаючи, що адипоцитокіни можуть як ранні маркери розвитку СД [68,70].
LBW Потомство
Оскільки ці зміни є очевидними на ранніх стадіях життя, це передбачає запрограмований шлях посиленої диференціації адипоцитів та ліпогенезу, який, ймовірно, сприяє розвитку ожиріння та СД у потомства НДГ (рис.2).
Ожиріння матері/Потомство з високим вмістом жиру
Програмування жирової тканини внаслідок внутрішньоутробного переїдання, ймовірно, передбачає взаємодію наслідків: раніше існуюче ожиріння матері, збільшення маси тіла під час вагітності, західна дієта з високим вмістом жиру та різний ступінь непереносимості глюкози у матері. Програмування адипогенезу може відбуватися за відсутності підвищеної ваги новонароджених. Обмежені механістичні дослідження програмованого адипогенезу, обумовлених ожирінням матері або дієтою з високим вмістом жиру, демонструють надзвичайно подібний фенотип, як у нащадків ЛЖВ. Це включає підвищену експресію PPAR у жировій тканині плода та новонародженого [82,83], а також підвищену експресію ферментів, що опосередковують біосинтез жирних кислот [84].
Клінічні наслідки та висновки
Подяка
Наша робота, про яку повідомляється, підтримується Національними інститутами грантів R01DK081756 та R01HD054751.
- Докази ролі генів розвитку у походженні ожиріння та розподілі жиру в організмі PNAS
- Клас 8А - Харчування та здоров’я - Питання студентів до іспиту 1 Як вилікувати ожиріння
- Збільшується навчальна програма з питань міждисциплінарного запобігання ожирінню (TOPRS)
- Кордони Цинк-α2-глікопротеїн асоціюється з ожирінням у китайців та ожирінням, спричиненим ВГЧ
- Вплив неомилюваних речовин із рисових висівок на ожиріння, спричинене дієтою, у мишей - шинка - 2015 - журнал