Відносний внесок NMDAR у збудливі постсинаптичні струми контролюється за допомогою інактивації, спричиненої Ca 2+
Фліза Валіулліна
1 OpenLab з нейробіології, Казанський федеральний університет, Казань, Росія
Юлія Захарова
1 OpenLab з нейробіології, Казанський федеральний університет, Казань, Росія
Марат Мухтаров
1 OpenLab з нейробіології, Казанський федеральний університет, Казань, Росія
Андреас Драгун
2 Кафедра фізіології та патофізіології, Університет Гейдельберга, Гейдельберг, Німеччина
Цвях Бурнашев
3 INMED, Інститут нейробіології медичного університету UMR901, Екс-Марсельський університет, Марсель, Франція
4 INSERM U901, Марсель, Франція
Андрій Розов
1 OpenLab з нейробіології, Казанський федеральний університет, Казань, Росія
2 Кафедра фізіології та патофізіології, Університет Гейдельберга, Гейдельберг, Німеччина
Анотація
Вступ
Ми повідомляємо, що маніпулювання буферною ємністю Ca 2+ пірамідних нейронів CA1 гіпокампа сильно впливає на амплітуду одиничних, допорогових EPSM, опосередкованих NMDAR. Більше того, при високочастотній аферентній стимуляції одночасне полегшення блокування Mg 2+ та CIIN збільшило внесок NMDAR у постсинаптичні EPSP та значно продовжило час їх розпаду. Отримані нами дані свідчать про те, що потік Са 2+, індукований під час унітарних синаптичних подій, є достатнім для того, щоб спричинити гальмування NMDAR. Повторна активація збудливих синапсів призводить до значного подовження вікна інтеграції для синаптично викликаних потенціалів дії (AP).
Матеріали і методи
Всі експериментальні протоколи виконувались згідно з положеннями Казанського федерального університету щодо використання лабораторних тварин (етичне схвалення Інституційним комітетом з догляду та використання тварин Казанського державного медичного університету N9–2013) або урядом штату Баден-Вюртемберг, Німеччина . Всі зусилля були докладені для мінімізації страждань тварин та зменшення кількості використовуваних тварин.
Поперечні зрізи гіпокампа розміром 250 мкм готували з мозку мишей 14–21-денної давності (C57 BL/6J), убитих вивихом шийки матки. Камера для нарізання містила кисневий крижаний розчин (модифікований від Dugue et al., 2005), що складається з (у мМ): K-глюконат, 140; N- (2-гідроксиетил) піперазин-N'-етансульфокислота (HEPES), 10; Na-глюконат, 15; етиленгліколь-біс (2-аміноетил) -N, N, N ′, N′-тетраоцтова кислота (EGTA), 0,2; і NaCl, 4 (рН 7,2). Зрізи інкубували протягом 30 хв при температурі 35 ° C, перш ніж зберігати їх при кімнатній температурі (22–24 ° C) у штучній СМЖ (ACSF), що містить (у мМ): NaCl, 125; NaHCO3, 25; KCl, 2,5; NaH2PO4, 1,25; MgCl2, 1; CaCl2, 2; і глюкоза, 25; барботується з 95% O2 і 5% CO2. Без Mg 2+ ACSF мав 0 мМ MgCl2 та 0,2 мМ ЕДТА.
Патч-електроди витягували з твердого боросилікатного капілярного скла (полум'яний/коричневий знімач мікропіпетки Sutter Instruments). В експериментах, проведених в режимі затиску напруги, внутрішньоклітинний розчин складався (в мМ): Cs-глюконат, 100; CsCl, 40; ХЕПЕС, 10; NaCl, 8; MgATP, 4; MgGTP, 0,3; фосфокреатин, 10 (рН 7,3 з CsOH). У експериментах зі струмовим затискачем Cs + замінювали K + у розчині піпетки.
Під час записів проводився моніторинг мембранної резистентності, а дані клітин, у яких мембранна резистентність варіювалась> 15%, були виключені з аналізу. У статті n посилається на кількість експериментів у групі.
Для статистичного аналізу був використаний тест Манна-Уітні, і дані представлені як середнє значення ± SD, якщо не вказано інше.
Результати
Входу Ca 2+ під час унітарних допорогових синаптичних відповідей достатньо, щоб викликати CIIN
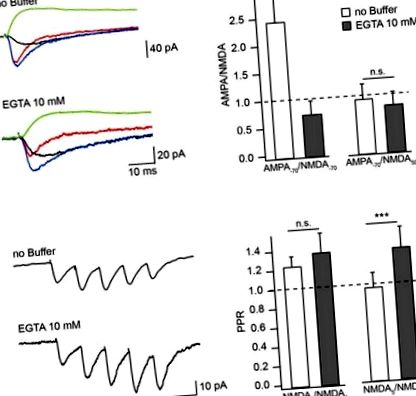
Вплив буферів Ca 2+ на амплітуду опосередкованого NMDAR EPSC у позаклітинному розчині без Mg 2+. (A) Усереднені виділені сполуки EPSC (синій), aEPSC (червоний), nEPSC (чорний) при -70 мВ та nEPSC (зелений) при 50 мВ, записані безкліфними та містять EGTA внутрішньоклітинними розчинами. Гістограми стовпчиків порівнюють вплив буферного навантаження на співвідношення амплітуд aEPSC, виміряних при -70 мВ, до nEPSC, виміряних при -70 мВ (ліворуч) та 50 мВ (праворуч). (B) Середні поїзди опосередкованих NMDAR EPSC, зафіксованих з розчинами, що не містять EGTA та EGTA. Гістограми стовпчиків показують вплив навантаження EGTA на співвідношення амплітуд (PPR) другого (лівого) та п'ятого (правого) nEPSC до амплітуди першого відгуку. Зірочки вказують на значну різницю.
Щоб перевірити, чи можна збільшити ступінь CIIN за допомогою тривалої підпорогової синаптичної стимуляції, ми виміряли та порівняли співвідношення амплітуд другого (NMDA2) та п'ятого (NMDA5) nEPSC до першого nEPSC (NMDA1), використовуючи протокол стимуляції з п'ятьма імпульсами (10 Гц) у нейронах, завантажених внутрішньоклітинними розчинами, що не містять буфер, або містять EGTA (Рисунок (Рисунок 1B). 1B). Середнє співвідношення NMDA2/NMDA1 було незначно збільшено, але не суттєво, за допомогою буферного завантаження (без EGTA: 1,23 ± 0,11, n = 6; EGTA, що містить: 1,36 ± 0,21, n = 5; p = 0,662). Пізніші відповіді, однак, були чітко посилені буферизацією Ca 2+: співвідношення NMDA5/NMDA1 становило 0,9 ± 0,15 у нейронах, заклеєних розчином без EGTA (n = 6), і 1,28 ± 0,21 у нейронах, що містять EGTA (n = 5; р = 0,009). Ці дані вказують на те, що CIIN дійсно змінює внесок NMDAR в унітарні реакції, маючи сильніший вплив на опосередковані NMDAR струми під час тривалої повторюваної активності.
У присутності Mg 2+ CIIN впливає на опосередковані NMDAR струми незалежним від напруги способом
CIIN сильно зменшує амплітуди nEPSC при негативних потенціалах, але не змінює залежність напруги блоку Mg 2+. (A) Нормалізовані (50 мВ) синаптично викликані NMDAR-опосередковані відповіді, зафіксовані при -70, -35, 0, 35 і 50 мВ від пірамідних клітин CA1, діалізованих внутрішньоклітинними розчинами, що не містять буфер, EGTA або BAPTA. (B, C) Співвідношення напруги струму nEPSC нормуються до амплітуд при 50 мВ (B) і -70 мВ (C) отримані з безбуферними (червоний), EGTA- (чорний) та BAPTA-містять (зелений) внутрішньоклітинними розчинами.
Відносний внесок NMDAR у постсинаптичні відповіді суворо контролюється CIIN
Для подальшого обґрунтування модулюючої ролі CIIN у фізіологічних умовах та оцінки його впливу на амплітуду сполучених EPSC ми порівняли реакції, опосередковані AMPAR- та NMDAR, виміряні при -70 та -35 мВ у нейронах, заклеєних безбуферною та буферсодержащей піпеткою рішення. При обох потенціалах утримання відносні амплітуди nEPSC, зареєстровані з клітин, діалізованих безклітинним внутрішньоклітинним розчином, були значно меншими в порівнянні з вимірюваними з EGTA (10 мМ) або BAPTA (1 мМ), як вказують набагато менші співвідношення AMPA/NMDA (Рисунки 3A, B).
Вплив CIIN на внесок NMDAR у складні EPSC. (A) Реакції, опосередковані AMPAR- (червоний) та NMDAR- (чорний), зафіксовані при -70 та -35 мВ від нейронів з розчином піпетки, що не містить буфера або містить буфер. (B) Гістограми барів порівнюють вплив навантаження EGTA або BAPTA на співвідношення AMPA/NMDA, отримані при -70 (ліворуч) та -35 мВ (праворуч). (C) Зважені IV внутрішньоклітинних синаптичних aEPSC (кола) та nEPSC (трикутники), виміряні з нейронів, діалізованих безбуферними (червоний), EGTA- (чорний) або BAPTA-містять (синій) внутрішньоклітинними розчинами. (D) Залежність напруги відносного внеску NMDAR до синаптичного EPSC за наявності або відсутності буферів Ca 2+. Позначення те саме, що і на (C). Зірочки вказують на значну різницю.
Щоб оцінити вплив CIIN на відносний внесок NMDAR у відповідь сполуки, ми реконструювали зважені синаптичні IV-криві aEPSC та nEPSC, записані розчинами, що не містять буфер і містять буфер. Реакції, опосередковані як AMPAR, так і NMDAR, були нормалізовані до середньої амплітуди aEPSC, виміряної при -70 мВ (рис. (Рис. 3C). 3C). Як і очікувалося, амплітуди aEPSC не залежали від вмісту внутрішньоклітинного буфера, а внутрішньовенні введення aEPCS були майже лінійними. Однак вага внеску NMDAR у складні EPSCs сильно залежала від присутності буферів Ca 2+. У клітинах, діалізованих безбуферним розчином при -70 мВ, внесок nEPSC становив 6 ± 1% відповіді сполуки. Вплив NMDAR збільшився при -35 мВ (24 ± 8%), але все ще був значно нижчим, ніж вплив AMPAR (n = 8; p Рисунок 3D). 3D). У нейронах, завантажених буферами, внесок каналів NMDAR був сильно посилений при -70 мВ (10 мМ EGTA: 18 ± 6%, n = 6; 1 мМ BAPTA 21 ± 4%, n = 5), крім того, при -35 Амплітуди nEPSC, зважені mV, були значно більшими, ніж aEPSC (59 ± 10% та 56 ± 5%, р 0,05; Рисунок 4A). 4А). Однак у нейронах, завантажених BAPTA, активація синаптичних NMDAR суттєво вплинула на розпад EPSP. При 50 Гц значення тау були, в контролі 74 ± 23, і зменшувались до 36 ± 14 мс у присутності APV (n = 5; p = 0,008; Рисунок Рисунок 4B). 4B). При 20 Гц прискорення констант розпаду EPSP за допомогою APV все ще було значним (58,4 ± 21 проти 34 ± 12 мс; p = 0,029), тоді як при 10 Гц блок NMDAR не викликав суттєвого зменшення тау (51 ± 9,2 проти 36,1 ± 6,24 мс; p = 0,2). Зверніть увагу, що часові константи, виміряні у присутності APV, були дуже схожими на ті, що були у нейронах, заплямованих розчинами, що не містять буфер та BAPTA.
CIIN значно прискорює розпад EPSP і скорочує часовий проміжок для формування потенціалу дії. (A) EPSP, викликані поїздами 10, 20 та 50 Гц, у клітинах, заклеєних безбуферним внутрішньоклітинним розчином у присутності (чорний) та відсутність (червоний) 50 мкМ APV. Діаграма показує вплив блокування NMDAR на постійну часу розпаду останньої реакції при різних частотах стимуляції. (B) Те саме, що в (A), отримані з нейронів, завантажених 1 мМ BAPTA. (C) Синаптично викликані точки доступу, записані безрозрядними (чорними) та BAPTA-містять (червоними) розчинами для піпеток. Графік представляє залежність затримок AP (затримок) від вмісту клітинного буфера.
Відповідно до подовження розпаду EPSP, затримки AP (латентність), виміряні як інтервал між артефактом 3-го стимулу та піком AP, були значно більшими в нейронах, навантажених BAPTA. Малюнок Рисунок 4C 4C показує накладені сліди, записані від нейронів, записаних розчинами піпетки, що не містять буфер (чорний) та BAPTA (червоний). Графіки кумулятивної ймовірності (праворуч) показують перехід до більш тривалих затримок AP в присутності BAPTA (об’єднані дані з п’яти клітин у кожній групі; p 2+, що надає NMDAR центральну роль як у синаптичній пластичності, так і в виживанні нейронів у фізіологічних умовах та смерть нейронів при екситотоксичних патологічних станах (Paoletti et al., 2013).
Функціональні наслідки модуляції NMDAR різними сигнальними молекулами та біохімічними каскадами у фізіологічних умовах були широко вивчені протягом останніх двох десятиліть. Однак функціональна роль CIIN залишається недостатньо вивченою.
CIIN як механізм саморегуляції NMDAR у фізіологічних умовах
Явище інгібування Ca 2+ інгібування NMDAR було добре задокументовано та досліджено на рівні внутрішньоклітинних молекулярних механізмів (Legendre et al., 1993; Medina et al., 1994; Rosenmund et al., 1995; Ehlers et al., 1996; Wang and Wang, 2012; Paoletti et al., 2013; Bajaj et al., 2014; Yang et al., 2014). Однак важливим питанням залишалось відкритим, а саме: чи введення Са 2+, пов'язане з одиничними синаптичними подіями, опосередкованими NMDAR, у фізіологічних умовах є достатнім для самоінгібування реакцій, опосередкованих NMDAR. Іншими словами, чи працюють механізми, що регулюють CIIN, за шкалою часу EPSC (мілісекунди)?
Ці аспекти CIIN не були розглянуті в попередніх дослідженнях, де CIIN був спричинений або входом Ca 2+ через кальцієві канали, керовані напругою, або тривалою активацією NMDAR (Medina et al., 1994, 1995, 1996). Ці дослідження також не давали чітко визначити величину "самоінгібування" NMDAR, особливо за фізіологічних умов. Однак Ehlers et al. (1996) надали переконливі докази того, що 50 мкМ [Ca 2+] i у присутності кальмодуліну викликає a
4-кратне зменшення ймовірності відкриття та скорочення часу відкриття каналів NMDAR вдвічі.
Ми виявили, що Ca 2+, потрапляючи через NMDAR під час унітарної синаптичної події, може сильно послабити амплітуду nEPSC, вказуючи на те, що CIIN працює у швидкому часовому масштабі в кілька мілісекунд. Ці дані узгоджуються з нашими попередніми висновками щодо рекомбінантних каналів, де у зовнішніх плямах приплив Са 2+, викликаний короткочасною (1 мс) активацією проникних Са 2+ АМПАР, був достатнім для зменшення амплітуди струму коекспресованого та ко- активований Ca 2+ -непроникний мутант NMDAR (Rozov et al., 1997). Більш того, у фізіологічних концентраціях Mg 2+, навіть навколо мембранного потенціалу спокою, де сила блоку Mg 2+ майже максимальна, NMDAR все ще можуть проводити достатню кількість Ca 2+, щоб майже в чотири рази зменшити функцію каналу . Дійсно, згідно з Ковальчуком та співавт. (2000) за цих умов субпорогова аферентна стимуляція призводить до виявлення [Ca 2+] i у хребтах пірамідних клітин CA1, який майже виключно опосередковується NMDAR. Разом з тим, що приплив Са 2+ через NMDAR можна виявити принаймні до +20 до +40 мВ (Бурнашев та ін., 1995; Ковальчук та ін., 2000), це свідчить про те, що CIIN працює в фізіологічних умовах.
Наші дані настійно припускають, що цього підвищення рівня [Ca 2+] i є достатнім для запуску CIIN, і початок інгібування є досить швидким, щоб сформувати окремі постсинаптичні реакції. Ця знахідка повністю узгоджується з даними про величину CIIN на рівні одного каналу (Ehlers et al., 1996). Таким чином, ми надаємо перші докази того, що за фізіологічних умов синаптичні NMDAR в клітинах з низькою буферною ємністю різко самоінгібуються припливом Ca 2+, опосередкованим NMDAR.
Можлива роль CIIN під час старіння та нервово-психічних розладів
Зміна функції NMDARs також була пов'язана з розвитком психотичних симптомів у ряді нервово-психічних захворювань (Lakhan et al., 2013). Поряд з цим експресія ендогенних буферів Ca 2+ змінюється під час старіння та деяких неврологічних розладів (Bu et al., 2003; Riascos et al., 2011). Отже, селективна вразливість холінергічних нейронів базального переднього мозку до дегенерації при хворобі Альцгеймера пояснюється віковою втратою ЦБ від цих нейронів і, як наслідок, зростанням внутрішньоклітинного Ca 2+ (Riascos et al., 2011). За цих умов CIIN може відігравати внутрішню компенсаторну роль, протидіючи підвищенню внутрішньоклітинного Ca 2+, зменшуючи вхід Ca 2+, опосередкований NMDAR.
Цікаво, що зміна експресії буферів Ca 2+ часто узгоджується із зміною функції NMDAR. Наприклад, залежність від віку зменшення експресії CR в зернистих клітинах гіпокампа збігається з регуляцією імунореактивності GluN1 (Газзалі та ін., 1996). Нарешті, ряд неврологічних розладів пов’язані з порушенням регуляції як функції NMDAR, так і ендогенного синтезу буфера Са 2+ (Heizmann and Braun, 1992; Paoletti et al., 2013; Kook et al., 2014). Існує припущення, що зміни PV при шизофренії можуть призвести до гіпофункції NMDAR. Шизофренія часто пояснюється гіпофункцією NMDAR, це може відображати порушення регуляції рецептора, а не дефіцит кількості NMDAR (Kantrowitz and Javitt, 2010; Gonzalez-Burgos and Lewis, 2012). Крім того, зміна концентрації позаклітинного Са 2+ за певних умов може також послабити вплив CIIN. Наприклад, вимірювання in vivo позаклітинної концентрації Са 2+ у приматів під час судом показало, що рівень Са 2+ падає в межах 100 мкМ (Pumain et al., 1985). У цьому випадку знижений CIIN може збільшити вікно для синаптичної інтеграції через подовження реакції, опосередкованої NMDAR, і призвести до надмірної збудливості нейронів.
На закінчення, наші висновки дозволяють припустити, що індукована Ca 2+ інактивація NMDAR, що діють на часовій шкалі EPSC, може сприяти специфічній для клітини тонкій настройці збуджуючої синаптичної передачі в нормальних та патологічних умовах.
Внески автора
Концепція та дизайн дослідження: AD, NB та AR. Збір даних: FV, YZ та AR. Аналіз та інтерпретація даних: FV та AR. Аналіз даних: М.М. Складання рукопису: AD, NB та AR. Критичний перегляд: NB та AR.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів. Редактор рецензії доктор Сінція Коста заявляє, що, незважаючи на належність до тієї ж установи, що і заступник редактора, доктор Марія Крістіна Д’Адамо, процес огляду оброблявся об’єктивно.
Подяка
Ця робота була підтримана програмою конкурентоспроможного зростання Казанського університету, субсидією, виділеною на державне призначення у сфері наукової діяльності, грантом РФФІ (14-04-01457), Bundesministerium für Bildung und Forschung (Центр обчислювальних технологій Бернштейна Neurosciences 01GQ1003A) та за підтримки проекту A * MIDEX (n ° A * M-AAP-TR-14-02-140522-13.02-BURNASHEV-HLS), що фінансується програмою уряду Франції «Investissements d ′ Avenir», керованою Французьким національним дослідницьким агентством (ANR). Ми дякуємо Девіду Джеппі за корисні коментарі до рукопису.
- Проект "Здоровий старт" проводив рандомізоване, контрольоване втручання для запобігання надмірної ваги серед нормальних
- Поради щодо правильного харчування для покращення стану дитини; s Імунна система
- Чому зараз НЕ час роздуватися про весільні дієти
- Фінський довгий напій
- Поради щодо харчування в обідній школі - Поговоріть сьогодні о 13:00 за тихоокеанським часом - Руда мама