Так-асоційований білок (YAP) полегшує дисфункцію серця у діабетику, спричинену перевантаженням
Шохей Ікеда
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
b Кафедра серцево-судинної медицини, Вища медична школа університету Тохоку, Сендай, Японія
Ріса Мукай
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Ватару Мізусіма
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Пейюн Чжай
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Шін-ічі Ока
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Мічінарі Накамура
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Домінік П. Дель Ре
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Себастьяно Шиарретта
c Відділ медико-хірургічних наук та біотехнологій Римського університету Сапієнца, Латина, Італія
d Istituto Di Ricovero e Cura a Carattere Scientifico Neuromed, Поцціллі, Італія
Тяо-По Хсу
e Відділ серцево-судинної хірургії, відділення хірургії, Тайбейська лікарня для ветеранів, Національна медична школа університету Ян-Мін, Тайвань
Хіроакі Сімокава
b Кафедра серцево-судинної медицини, Вища школа медицини університету Тохоку, Сендай, Японія
Джунічі Садосіма
кафедра клітинної біології та молекулярної медицини, Інститут серцево-судинних захворювань, Медична школа Рутгерса, Нью-Джерсі, Ньюарк, Нью-Джерсі
Пов’язані дані
Візуальний реферат
Резюме
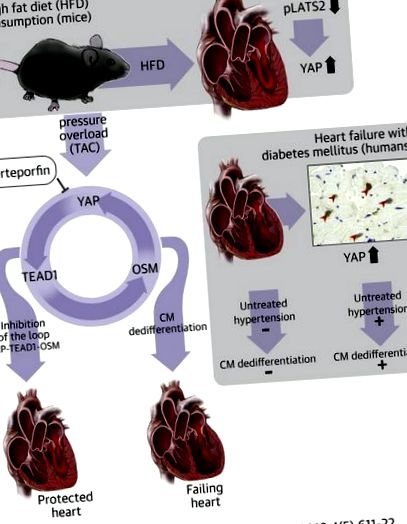
Пацієнти з діабетом схильні до розвитку серцевої недостатності за наявності високого кров'яного тиску, ніж ті, хто не страждає на діабет. Так-асоційований білок (YAP), ключовий ефектор сигнального шляху Бегемота, постійно активізується в серцях діабетиків, і YAP відіграє важливу роль у опосередкуванні загострення серцевої недостатності у відповідь на перевантаження тиску в серцях мишей, яких годують високо -жирна дієта. Індукована YAP дедиференціація кардіоміоцитів за допомогою активації фактора посилення транскрипції 1 (TEAD1), фактора транскрипції. Таким чином, YAP та TEAD1 є перспективними терапевтичними цілями для хворих на цукровий діабет з високим кров'яним тиском для запобігання розвитку серцевої недостатності.
Серцево-судинні захворювання є основною причиною смертності у розвинених країнах (1). Останнім часом кількість випадків серцево-судинних захворювань, пов'язаних з метаболічним синдромом, таких як ожиріння та цукровий діабет, швидко зростає у всьому світі (2). У цих пацієнтів часто розвивається серцева недостатність (СН) із збереженою фракцією викиду лівого шлуночка або зменшеною фракцією викиду лівого шлуночка, хоча метаболічні порушення, такі як резистентність до інсуліну, часто сприяють розвитку СН із збереженою фракцією викиду лівого шлуночка у хворих на ожиріння із діабетом 2 типу нецукровий (3). В даний час молекулярні механізми кардіоміопатії, пов'язані з метаболічним синдромом, залишаються недостатньо вивченими, а отже, конкретного лікування не існує.
Сигнальний шлях Бегемота - це еволюційно збережений сигнальний шлях, який бере участь у контролі розміру органів, регенерації тканин та пухлинах через регуляцію апоптозу та проліферації клітин (4). Основні компоненти шляху Бегемота включають серинові/треонінкінази, розташовані вище за течією, а саме Mst1/2 (стерильні 20-подібні ссавці 1) і Lats1/2 (великі супресорні кінази пухлини 1 і 2), а також кофактори ядерного фактора транскрипції YAP (Так- асоційований білок) та TAZ (транскрипційний коактиватор з PDZ-зв'язуючим мотивом), де Mst1/2 та Lats1/2 негативно регулюють ядерні рівні YAP та TAZ (4). YAP і TAZ зв'язуються з факторами транскрипції, такими як TEAD (фактор посилення транскрипції) та FoxO1 (роздільна коробка O1), тим самим регулюючи різноманітні клітинні функції, включаючи проліферацію клітин та виживання клітин (5). Активація шляху Бегемота безпосередньо пов’язана з патогенезом серцевих захворювань, включаючи ішемію/реперфузійне пошкодження 6, 7, реконструкцію серця та СН 8, 9. ЯП також бере участь у регенерації серця після пологів після інфаркту міокарда 10, 11, 12.
Було запропоновано, що або придушення компонентів шляху шляху бегемота, або стимуляція YAP потенційно можуть бути використані як терапевтичне втручання для полегшення відновлення та регенерації серця після гострого інфаркту міокарда 10, 11, 12; однак стійка інактивація шляху Бегемота та подальша активація YAP індукує серцеву дисфункцію за наявності перевантаження тиском (PO) через активацію дедіференціації кардіоміоцитів (13). Це свідчить про те, що функція ЯП різко змінюється залежно від типу стресу. Залишається важливим питання про те, чи відбувається стійка активація YAP в клінічно значущих умовах і чи придушення YAP покращує такі умови.
ЯП регулюється в клітинах раку печінки у відповідь на високий рівень глюкози (14) та в діабетичних клітинах епітелію нирок (15). Пацієнти з інсулінорезистентністю більш схильні до розвитку гіпертонії, а співіснування діабету та гіпертонії сприяє розвитку СН 2, 16. Ми запитали: 1) чи сприяє ЯП порушенню серцевої дисфункції у відповідь на РО у мишей, які харчуються дієтою з високим вмістом жиру ( HFD), мишача модель цукрового діабету 2 типу; 2) чи супроводжується загострення кардіоміопатії у мишей, що харчуються HFD, у присутності РО дедіференціацією кардіоміоцитів; та 3) чи регулюється ЯП у серці діабетика людини.
Методи
Моделі миші
Усі експерименти на тваринах проводились відповідно до протоколів, затверджених Комітетом з догляду та використання тварин Університету Рутгерса. Фон усіх мишей був C57BL/6J. Були описані системні миші TEAD1 +/− (13). В якості контролів використовували вікових та статевих збігових мишей чоловічої статі. Для лікування HFD мишей-самців випадковим чином розподіляли на 2 групи і годували нормальною дієтою (ND) або HFD протягом 8 тижнів (17). Для експериментів з вертепорфіном мишей випадковим чином розподіляли на 2 групи: вертепорфін або контрольну групу DMSO. Дванадцятитижневим мишам після фіктивних операцій або поперечного звуження аорти (TAC) ін'єктували внутрішньочеревно вертепорфін у дозі 100 мг/кг через день протягом 10 днів. Для вимірювання градієнтів артеріального тиску використовували високоточні мікроманометричні катетери (1,4-F, Millar Instruments Inc., Х'юстон, Техас).
Поперечне звуження аорти
Описано методи, що використовувались для накладання PO мишам (13). Самців мишей у віці 12 тижнів випадковим чином розподіляли на 2 групи: РО з TAC або підробленою операцією. У цьому дослідженні ми зосередилися на мишах-самцях, оскільки попередні дослідження втрати функції YAP в серці, проведені в цій лабораторії, також зосереджувались на мишах-самцях (13). Мишей знеболювали пентобарбіталом натрію (60 мг/кг) та провітрювали механічно. Кількість використовуваних тварин описана в кожній легенді фігури. Успішне застосування ТАС підтверджено поперечною швидкістю аорти вище 4 м/с, оціненою за допомогою допплерівської ехокардіографії. Миші, які померли від СН, були включені в аналіз виживання, але були виключені з оцінки серцевої функції та гістології. Під час процедури не було несподіваних побічних явищ. Всі операції та аналізи виконувались сліпим способом щодо генотипу мишей.
Ехокардіографія
Мишей знеболювали, використовуючи 12 мкл/г маси тіла 2,5% авертину (Sigma-Aldrich, Сент-Луїс, Міссурі), і проводили ехокардіографію, як описано раніше (13).
Зразки людини з експлантованих сердець
Зразки для імунозабарвлення
Дослідження було схвалено Комітетом з етики Вищої медичної школи університету Тохоку. Усі пацієнти надали письмову згоду на використання тканин серця для дослідження. Зразки біопсії міокарда були отримані від пацієнтів із СН в університетській лікарні Тохоку. Імуноофарбовування проводили з використанням 66 послідовних зразків біопсії, що спостерігаються, отриманих з січня 2016 року по червень 2017 року (Додаткові таблиці 1 і 2). У двадцяти п’яти пацієнтів діагностували цукровий діабет, і їх середній рівень глікозильованого гемоглобіну становив 6,98 ± 0,68% (порівняно з 5,66 ± 0,32% у пацієнтів без діабету; p Рисунок 1A, Додатковий малюнок 1). Імунофарбування зрізів серця показало, що споживання HFD суттєво збільшило кількість кардіоміоцитів з YAP-позитивними ядрами (рис. 1В). Імуноблот-аналізи підтвердили, що рівень загального білка YAP також був підвищений у серцях мишей, яких годували HFD (рис. 1С). Крім того, споживання HFD протягом 8 тижнів суттєво знижувало рівень фосфо-латів2, що свідчить про те, що ця модель імітує дефіцит бегемота (рисунок 1С, додатковий малюнок 2). Ехокардіографічні вимірювання (додаткова таблиця 3) та гемодинамічні вимірювання (додаткова таблиця 4) показали, що споживання HFD протягом 8 тижнів не викликало систолічної серцевої дисфункції, що узгоджується з нашими попередніми результатами (17).
- Система обміну продуктами харчування для діабетиків не є планом схуднення - де горили беруть свій білок
- Чому дієта для важких атлетів містить багато білка
- Потреба в харчових білках кочевого сома, Mystus nemurus (Cuvier & Valenciennes),
- Правда про велосипедистів та білок АКТИВНИЙ
- Чому вживання білка робить вас почуттям щастя