SNARE (білок)
Білки SNARE - це група білків, які мають вирішальне значення для злиття мембран та екзоцитозу нейромедіаторів з клітини і включають синаптобревін (асоційоване з везикулами мембранне сімейство білків [VAMP]), синтаксин та SNAP-25.
Пов’язані терміни:
- Екзоцитоз
- Синтаксин
- Ферменти
- Злиття мембран
- Мутація
- Білки
- Нейрони
- Плазматична мембрана
- Синаптичні везикули
Завантажити у форматі PDF
Про цю сторінку
Планарні ліпідні двошарові шари (BLM) та їх застосування
1. ВСТУП
Білки SNARE - це молекулярні двигуни, що забезпечують біологічне злиття двох мембран [1]. Частина двигуна знаходиться в мембрані везикул (v-SNARE), а частина - в мембрані-мішені (t-SNARE) [2,3]. Під час злиття багато відповідних пар v- і t-SNARE переплітаються, щоб підтягнути протилежні мембрани близько, щоб вони зрослися. Це поєднання викликає образ, запропонований абревіатурою білків, SNARE. Однак саме цей образ, а не значення абревіатури, швидше за все, запам’ятається. SNARE означає SNAP-рецептор, SNAP - розчинний NSF кріплення сторротеїн, а NSF позначає чутливий до N-етилмалейміду фактор! Останнім часом використовується менш інформативне, але більш безпосереднє вживання абревіатури SNARE: sрозчинний N-чутливий до етилмайлу імід фактор-aбілок татаменту ррецептори [1, 4-5] .
До того, як відбувається злиття, везикула доставляється і стикується з цільовою мембраною. Після того, як везикула стикується, білки SNARE можуть активуватися для злиття везикул і мембран цілі. Незважаючи на те, що етапи доставки та стикування є цікавими та перебувають під напруженим розслідуванням, саме етап термоядерного синтезу є основним в цій главі. Злиття двох мембран - це процес, який піддається дослідженню з використанням принципів електрофізіології та техніки чорної ліпідної мембрани (BLM).
Зв’язування стимулу та секреції в ацинарних клітинах підшлункової залози
50.5.4 Білки SNARE
Інші асоційовані з SNARE білки та потенційно взаємодіючі білки також були виявлені. Модулюючий білок SNARE, Munc18c. було виявлено в клітинах ацинарних клітин, локалізовано в базолатеральній мембрані та показано, що дисоціює у відповідь на високі концентрації CCK або PKC. 347 Це було запропоновано для посередництва базолатеральної секреції. Зовсім недавно було показано, що етанол посилює цей ефект. Відомо, що 350 Munc18b взаємодіє із синтаксином 2 та 3 та бере участь у вивільненні амілази з привушних клітин. Cab45b був визначений партнером, що зв'язує Munc18b, і антитіло проти Cab45b пригнічувало вивільнення амілази, стимульоване Ca 2+, у проничених SLO ацинусах щурів. 351 Нещодавно було показано, що інший модулятор SNARE, комплексин 2, модулює екзоцитоз ZG, регульований VAMP-2. 352 Інші білки, про які повідомляється про ZG, і які, можливо, відіграють роль у секреції, включають білок цистеїнової струни, 353 синколін, 354,355 та гетеротримерні G-білкові субодиниці αq/11 237 та Gαo та Gαs. 238
Висновок про структури кінетичних проміжних сполук при ініційованому Са2 + екзоцитозі
1 SNARE
Білки SNARE становлять велику родину з широким спектром функцій у різних формах мембранного обігу. Синаптичні SNARE, синаптобревін (VAMP), SNAP-25 та синтаксин є важливими для екзоцитозу, спричиненого Ca 2+ (Jahn & Scheller, 2006; Schiavo, Matteoli, & Montecucco, 2000). Гомологічні домени всередині цих білків ∼70 амінокислот об’єднуються, утворюючи комплекс, що складається з 4 паралельних α-спіралей. Кристалічна структура цього комплексу, проведена Саттоном, Фассауером, Яном та Брюнгером (1998), мала великий вплив на мислення в цій галузі. Ця структура є важливим елементом більшості механізмів, запропонованих дослідниками для екзоцитозу, і на неї неодноразово посилалися в моделях злиття мембран. Однак ці моделі залежать від деяких критичних невирішених питань. Перш за все, якщо злиття опосередковується більш ніж одним комплексом SNARE (тобто комплексом комплексів SNARE), тоді нам потрібно знати кількість комплексів SNARE, які об’єднуються під час злиття однієї везикули. По-друге, нам потрібно знати зв’язок між ступенем складання комплексу SNARE та прогресом плавлення.
Біохімічні дослідження показали, що комплекси SNARE утворюють високомолекулярні олігомери (Hayashi, Yamasaki, Nauenburg, Binz, & Niemann, 1995; Hayashi et al., 1994), що узгоджується із спільною роботою в клітинах. Крім того, повідомляється про обмін доменами між комплексами SNARE (Kweon et al., 2002). Рання оцінка кількості комплексів SNARE, необхідних для злиття, базувалася на супралінійній залежності від концентрації інгібування фрагментом синаптобревіну, що перешкоджає утворенню комплексу SNARE. Це дослідження дало значення 3 (Y. Hua & Scheller, 2001), що було підтверджено тісно пов'язаним експериментом, що включає конкуренцію між функціональною та нефункціональною формами SNAP-25 (Mohrmann, de Wit, Verhage, Neher, & Sorensen, 2010). Дії токсинів клостридії, які розщеплюють синаптичні білки SNARE, дозволяють припустити, що їх кількість може бути набагато вищою (Montecucco, Schiavo та Pantano, 2005). Ці оцінки, засновані на крутій залежності від концентрації SNARE, слід приймати як нижчі межі фактичної кількості комплексів SNARE, що беруть участь.
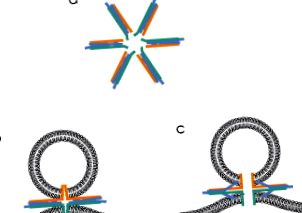
Аналізи злиття ліпосом також використовувались для оцінки кількості комплексів SNARE, які обумовлюють подію злиття мембрани. Одне дослідження припустило, що лише один комплекс SNARE може виконувати це завдання (van den Bogaart et al., 2010), але ці автори не оцінювали швидкість злиття як функцію кількості SNARE на міхур. Інші дослідження відновлених систем свідчать про необхідність декількох (5–11, Karatekin et al., 2010; 6–8, Domanska, Kiessling, Stein, Fasshauer, & Tamm, 2009). Фактична кількість може залежати від умов; варіації кількості білків в одній ліпосомі призводять до різних результатів (Domanska, Kiessling, & Tamm, 2010). Якщо для злиття необхідні кілька комплексів SNARE, то найбільш вірогідним буде розташування пучків з 4 спіралями, паралельних площині мембран, що сплавляються, і випромінюючих назовні від центрального фокусу, як спиці колеса. Ці білки мають мембранні якорі (обговорено нижче), і розміщення цих мотивів у центрі фокусу зосередило б сили, що генеруються комплексами SNARE, щоб максимізувати їх здатність деформувати мембрани (Jackson, 2010) (рис. 4, а). Дійсно, електронна мікроскопія показала, що комплекси SNARE, виділені з мозку, утворюють зіркоподібні агрегати (Hohl et al., 1998; Rickman, Hu, Carroll, & Davletov, 2005).
Малюнок 4. Злиті проміжні продукти, що спираються на білки SNARE. (а) Зіркоподібна конфігурація комплексів SNARE, імовірно оточуюча порою синтезу. (b) Закрита щілина, схожа на пори плавлення, утворену мембранними якорями SNARE. (c) Відкрита щілина, схожа на пори плавлення. Примітка: Зниження плазматичної мембрани до везикули робить це гібридною структурою. (Див. Кольорову вставку.)
На основі вимірювання електропровідності пор плавлення було оцінено радіус пор за умови простої циліндричної геометрії пор (рівняння 1). Кількість α-спіралей, необхідних для вирівнювання циліндра такого розміру, оцінювалась у 5–8 (Han et al., 2004; Z. Zhang, Zhang, et al., 2010). Таким чином, ці експерименти надають ще одну оцінку кількості комплексів SNARE, які співпрацюють у спрацьовуванні злиття, як обговорювалося вище. Зменшення потоку пор, що спостерігається при C-кінцевому відсіченні (Fang et al., 2008), може свідчити про те, що нижчий потік пори злиття і повільніші показники екзоцитозу є результатом утворення порів злиття з меншої кількості комплексів SNARE.
Міжнародний огляд клітинної та молекулярної біології
Кортні Челізе Вінкл, Стефані Л. Гуптон, у Міжнародному огляді клітинної та молекулярної біології, 2016
2.1.3 Синтаксини
Синтаксин t-SNARE-1 експресується в нейронах, локалізується в плазматичних мембранах, утворює комплекс SNARE з SNAP25 і VAMP2 і бере участь у вивільненні нейромедіаторів (Söllner et al., 1993a). Як і у випадку з делецією SNAP25, генетична делеція гена синтаксину1А (STX1A) не асоціюється із суттєвими нейроанатомічними відмінностями (Фудзівара, 2006). Навпаки, лікування нейротоксином ботуліну С (BoNTC1), який розщеплює як SNAP25, так і синтаксин1, спричиняє колапс конуса росту та гальмує переростання невритів у ДРГ курчат, і блокує упереджений вихід невриту до асиметричного джерела нетрину-1 у мишачих гіппокампальних експлантатах (Cotrufo et al., 2012; Hayashi et al., 1994; Igarashi, 1996). Оскільки лікування BoNTA, який розщеплює SNAP25 і залишає синтаксин недоторканим, не підсумовує ці результати, синтаксин1, ймовірно, необхідний для переважного переростання до нетрину, тоді як інший член сім'ї SNAP, як видається, компенсує втрату функції SNAP25.
Ще два члени сімейства синтаксинів, синтаксин 13 і синтаксин 16, були ідентифіковані в мозку, що розвивається (Chua and Tang, 2008; Hirling et al., 2000). Синтаксин13 бере участь як в екзоцитозі, так і в ранньому ендосомному обігу аксонів і дендритів і збагачується в конусі росту нейронів кори (Hirling et al., 2000; Prekeris et al., 1999). Хоча поки незрозуміло, чи синтаксин13 відіграє особливу роль у переростанні невритів у нейронах, надмірна експресія синтаксину 13 в клітинах PC12 збільшує переростання невритів. Враховуючи експресію синтаксину13 в головному мозку та специфічну локалізацію в невритових процесах, синтаксин13 може відігравати певну роль у розширенні нейрональної плазматичної мембрани, утворюючи комплекси з SNAP25 та сприяючи розширенню плазматичної мембрани (Hirling et al., 2000; Sarria et al., 2002 ). Синтаксин 16 збагачений дендритами нейронів на аванпостах Гольджі. Експресія домінантного негативного варіанту синтаксину 16 пригнічує розростання невритів у нейронах кори миші (Chua and Tang, 2008), вказуючи на роль ендогенного синтаксину16 у нейритогенезі. Чи грає синтаксин13 або 16 зайві або унікальні ролі для синтаксину1, невідомо.
Злиття мембран
Білково-білкові взаємодії
Молекулярна характеристика аутофагічних відповідей, частина А
Дж. Діао,. Q. Zhong, in Methods in Enzymology, 2017
3.3 Відновлення SNARE
Для зразка везикул t-SNARE змішайте синтаксин 17 і SNAP-29 (молярне співвідношення синтаксину 17/SNAP-29 1: 2) у пухирчастому буфері, що містить 1 мас.% OG, легким перемішуванням протягом 0,5–1 год при 25 ° C, утворюючи комплекс t-SNARE.
Відновіть білки t-SNARE (синтаксин 17/SNAP-29) та v-SNARE (VAMP8) з ліпідними пухирцями, що містять ліпофільні барвники, у співвідношенні білка до ліпідів 1: 50–1: 200 у буферах, що містять 0,8 вагу% розчину миючого засобу ОГ. Для зразка, що змішує вміст (лише везикули v-SNARE), 50 мМ сульфородаміну В розчиняють у розчині білка VAMP8 і змішують із v-везикулами, що містять 50 мМ сульфородаміну В, при співвідношенні білка до ліпідів 1: 50–1: 200 у буферах, що містять 0,8 мас.% розчину миючого засобу OG. Тримайте білки та пухирці на льоду. Захистіть пухирці від впливу світла.
Оберніть пробірки фольгою та обертайте їх у холодному приміщенні (4 ° C) на 30 хв.
Для зразків, що змішують ліпіди, розведіть суміш везикул/білок удвічі буферним міхуром. Для зразка, що змішує вміст (лише везикули v-SNARE), розведіть суміш везикул/білок удвічі буфером для пухирців, що містить 50 мМ сульфородаміну В. Міхур, що містить білок SNARE, утворюється, оскільки концентрація OG знижується нижче критичної концентрації міцели.
Перемістіть розчини в попередньо зволожені діалізні пробірки та проведіть діаліз проти 2-літрового буфера для діалізу (20 мМ HEPES, 90 мМ NaCl, 2 мМ DTT, рН 7,4) протягом 10–12 год, а потім ще 2 л діалізного буфера протягом 4 год. Діаліз слід проводити при 4 ° C. Біо-кульки SM-2 (Bio-Rad, Геркулес, Каліфорнія) можуть бути використані для видалення ОГ. Для зразка, що змішує вміст (лише везикули v-SNARE), перед стадією діалізу v-везикули згодом реформували, а вільний барвник сульфородамін B видаляли методом ексклюзивної хроматографії за допомогою колонки Sepharose CL-4B.
Зберіть діалізовані везикули в пробірки для мікрофугів. Виміряйте об'єм для розрахунку концентрації ліпідів. Концентрація ліпідів може змінюватися внаслідок зміни обсягу під час діалізу. Відновлені з білками зразки везикул можна зберігати при 4 ° C і використовувати їх протягом 3 днів.
Домени С2 та злиття мембран
Саша Мартенс, Харві Т. Макмехон, у "Поточні теми в мембранах", 2011
IV Висновок
Хоча білки SNARE і синаптотагміни беруть участь у кінетиці злиття мембран, а отже, у самій події злиття існує безліч інших допоміжних білків, які, ймовірно, регулюють розміщення місця злиття, збірка злитих комплексів та інших білків також може брати безпосередню участь у випадку термоядерного синтезу. Таким чином, білки, що демонструють фенотипи при стикуванні або праймуванні злиття везикул, не можуть бути виключені з відігравання ролі на пізніх стадіях. Дійсно, зараз пропонується синаптотагмін-1 відігравати певну роль у стикуванні, злитті та у післязливному розтині пори злиття (колапс везикули). Нарешті, хоча синаптичне злиття пухирців є залежним від Ca 2+, багато інших подій злиття є основними і не включають тригер Ca 2+, але все ж, ймовірно, буде потрібно відбір ідентичності мембрани та грунтування мембрани допоміжними білками комплексу SNARE аналогічно домену C2.
Том І
Регуляція екзоцитозу кальцієм
Нейронні білки SNARE, необхідні для регульованого екзоцитозу, є нейроендокринними аналогами сімейства білків, члени яких необхідні для обороту мембран та реакцій злиття в конститутивному секреторному шляху. 121122 Унікальною особливістю нервового синаптичного міхура та ендокринного екзоцитозу пухирців із щільним ядром є його жорстка регуляція, опосередкована цитоплазматичним кальцієм. 137,123,161 Як вивчали в проникних нейроендокринних клітинах або шляхом контролю рівня кальцію в інтактних клітинах, регульований екзоцитоз щільних серцевинних міхурів повністю залежить від кальцію і активізується концентрацією іонів кальцію в мікромолярному діапазоні. 103161 Базальна секреція гормону в інтактних ендокринних клітинах, що виявляється за відсутності секретагогів, яка опосередковується екзоцитозом щільних серцевинних міхурів, а не конститутивними везикулами,.
Регулювання екзоцитотичного шляху щільного ядерного міхура за допомогою кальцію відбувається на багатьох ділянках, включаючи набір гранул, грунтування, екзоцитоз, розширення пір та розростання ендоцитарної мембрани. Готові до випуску гранули виснажуються за рахунок сильної стимуляції, а поповнення готового до випуску пулу відбувається протягом декількох хвилин після виснаження. 103 170 Ставки поповнення басейну залежать від цитоплазматичного кальцію при концентраціях, нижчих від порогу для екзоцитозу. 171 Залежне від кальцію поповнення пулу може бути опосередковане за допомогою активації кальцієм протеїнкінази С та Munc-13. 157 170 170
Молекулярна основа відмінностей у чутливості до кальцію та кінетиці екзоцитозу везикул незрозуміла. Кілька ізоформ синаптотагміну, які відрізняються чутливістю до кальцію, присутні на різних класах везикул, і різні композиції можуть надавати різну чутливість до кальцію. 187 Синаптотагміни-1, -7 та -9 на везикулах з щільним ядром, швидше за все, опосередковують чіткі кінетичні реакції на підвищення рівня кальцію. 182188 синаптотагмін-1 демонструє низьку спорідненість, але швидке зв'язування кальцію порівняно з більш повільним зв'язуванням синаптотагмін-7. 173174 гранули клітин РС12 надниркових залоз щурів містять синаптотагміни-1 та -9, 178, але надмірна експресія синаптотагміну-7 підвищує чутливість до кальцію екзоцитозу щільних серцевинних міхурів, що узгоджується з думкою про те, що композиція ізоформи синаптотаміну на щільних серцевинах формує реакцію на кальцій піднімається. 189 На додаток до синаптотамінів, інші кальцієзв'язуючі домени, що містять домен С2, такі як Doc2, сприяють зондуванню кальцію для злиття везикул. 190 191
Після злиття швидкість розширення пори плавлення регулюється рівнем кальцію. 192 Дослідження показують, що білки синаптотагміну беруть участь у формуванні та розширенні пір. 186,193,194 Крім злиття, отримання кальцієвої мембрани з щільним ядром шляхом ендоцитозу стимулюється кальцій-залежним процесом. 195 При ендоцитозі синаптичних пухирців кальциневрин, кальцієво-активована, кальмодулінозалежна білкова фосфатаза, яка дефосфорилює кілька білків, що беруть участь в ендоцитозі (динамін, амфіфізин, синаптоянін), може опосередковувати регуляцію отримання кальцію. 196,197 Подібний механізм може лежати в основі регуляції кальцію ендоцитарного вилучення мембрани з щільним ядром гранул, компоненти якої передаються назад до Гольджі. 2 Також повідомлялося, що синаптотагмін-1 опосередковує аспекти кальцієво-регульованого ендоцитозу. 198 199
NSF та SNAP ☆
SNARE
Фігура 1 . Структура комплексу SNARE (a) та Sec17 (b). (а) Спіралі забарвлені наступним чином: синтаксин, червоний; VAMP, синій; SNAP-25, зелений. Вказано відносне розташування N- та С-кінців.
- Фізична привабливість - огляд тем ScienceDirect
- Пілокарпін - огляд тем ScienceDirect
- Житнє борошно - огляд тем ScienceDirect
- Scutellospora - огляд тем ScienceDirect
- Антидепресант другого покоління - огляд тем ScienceDirect