Синдром Лідла внаслідок нової мутації γ-субодиниці епітеліального натрієвого каналу (ENaC) у родині з Росії: випадок
Анотація
Передумови
Синдром Ліддла - це моногенне захворювання з аутосомно-домінантним успадкуванням. Основними характеристиками цього захворювання є гіпертонія, знижена концентрація активності альдостерону та реніну, а також підвищена екскреція калію, що призводить до низького рівня калію в сироватці крові та метаболічного алкалозу. Причиною синдрому Ліддла є помилки або мутації зміщення кадрів у SCNN1A, SCNN1B, або SCNN1G гени, що кодують епітеліальні субодиниці натрієвих каналів.
Презентація справи
Ми описуємо родину з синдромом Ліддла з Росії. У 15-річного пробанда є артеріальна гіпертензія, гіпокаліємія, гіпоренінемія, метаболічний алкалоз, але рівень альдостерону знаходиться в межах норми. У 12 років вперше була помічена артеріальна гіпертензія. Ми виявили нову мутацію зсуву кадру c.1769delG (p.Gly590Alafs) у SCNN1G, який кодує γ субодиниця ENaC у хребетних. Батько і молодша сестра також містять цю гетерозиготну делецію. Лікування амілоридом пробанда та його сестри не нормалізувало артеріальний тиск, а нормалізувало рівень активності реніну в плазмі.
Висновки
Наші результати розширюють мутаційний спектр синдрому Ліддла та надають додаткові докази того, що збережений мотив PY є вирішальним для контролю активності ENaC. Генетичний аналіз має значення для лікування гіпертонії, специфічного лікування амілоридом та консультування у сім'ях із синдромом Ліддла.
Передумови
Синдром Ліддла (псевдоальдостеронізм, OMIM 177200; 618,114; 618,126) є генетично гетерогенним аутосомно-домінантним розладом. Ключовими клінічними характеристиками цього синдрому є ранньо проявлена солечутлива гіпертензія з низьким рівнем K +, метаболічний алкалоз, пригнічення активності реніну та секреції альдостерону [1].
Мутації (помилкове зміщення або зсув кадрів) у генах епітеліальних натрієвих каналів (ENaC) викликають синдром Ліддла. Ці канали належать до сімейства ENaC/DEG (дегенерин) протонованих катіонних каналів. ENaC опосередковує транспорт Na + через апікальну мембрану від просвіту до епітеліальної клітини [2]. Оскільки ENaC регулює баланс іонів Na + у позаклітинній рідині (ECF) та в нирках, ці канали становлять значну частину регуляції об’єму ECF та артеріального тиску (BP) [3].
Канали ENaC присутні в апікальній частині епітеліальних клітин дистального нефрона, дистальної частини ободової кишки, легені та протоках екзокринних залоз. Канал складається з трьох субодиниць, кодованих трьома генами: α (SCNN1A), β (SCNN1B) і γ (SCNN1G). Усі субодиниці мають подібну структуру: цитоплазматичний N-кінець, позаклітинна петля, два коротких гідрофобні сегменти (трансмембранні домени 1 і 2) та цитоплазматичний С-кінець. N- і С-кінці повернуті до цитозольної поверхні, тоді як позаклітинна петля - до позаклітинної поверхні [4]. С-кінець всіх субодиниць ENaC має дуже консервативну послідовність - мотив PY (пролін-тирозин) [5]. Дослідження нокауту генів, інактивуючи гени субодиниць ENaC у мишей, продемонстрували, що всі три субодиниці є важливими для виживання. Миші-нокаути без жодної субодиниці ENaC гинуть через дихальну недостатність або порушення функції нирок [6, 7]. Подібні симптоми спостерігались у людей із псевдогіпоальдостеронізмом, тип 1 (OMIM 264350). Ця хвороба розвивається, якщо пацієнт має дві мутантні копії одного з генів субодиниць ENaC і є прихильним до синдрому Ліддла [8].
Синдром Ліддла пов'язаний з мутацією зародкових ліній в алелі SCNN1A, SCNN1B або SCNN1G гени [9]. Ці гени розташовані в різних хромосомах: SCNN1A знаходиться на хромосомі 12p13.31, SCNN1B і SCNN1G знаходяться на хромосомі 16p12.2 [4]. Найбільше мутацій виявлено в SCNN1B і SCNN1G гени. Повідомлялося про одиночну мутацію гена SCNN1A: Салих та ін. описав гетерозиготну місенс-мутацію у позаклітинному домені α-субодиниці ENaC як причину синдрому Ліддла [10]. Патогенні варіанти в SCNN1B і SCNN1G видалити або модифікувати внутрішньоклітинні мотиви пролін-тирозину в ENaC [9].
Тут ми описуємо російську сім'ю, яка страждає на синдром Ліддла через мутацію зсуву кадру в SCNN1G ген.
Презентація справи
Ми описуємо російську сім’ю з синдромом Ліддла: пробанд, його мати, батько та сестра. Нижче наведено детальний опис клінічних особливостей пробанда та його сестри. Основні біохімічні характеристики цих пацієнтів узагальнені в таблиці 1.
Пробанд - це 15-річний чоловік із російської республіки Дагестан. Він народився після другої вагітності та других пологів здорових батьків, що не є кровними. Його вага при народженні становила 3500 г. Період новонароджених пройшов безперебійно. Він ріс і розвивався відповідно до свого віку.
Під час занять спортом у віці 12 років вперше була виявлена артеріальна гіпертензія. Починаючи з 13,5 років, пацієнт скаржився на головний біль та задишку під час вправ. Його АТ був стабільним на рівні 160/100 мм рт.ст. Виявлено гіпертрофію міокарда лівого шлуночка та ангіопатію судин сітківки. Рівень гормонів щитовидної залози в плазмі крові, АКТГ (адренокортикотропний гормон), кортизол, дегідроепіандростерон, альдостерон (23 пг/мл, норми 10–160 пг/мл), адреналін, норадреналін, дофамін та серотонін був нормальним. Рівень метанефринів у сечі був нормальним. Рівень активності реніну в сироватці крові знизився до 0,1 нг/мл/год (нормальний діапазон 1,2–2,4 нг/мл/год). Лікування лізиноприлом (інгібітором ангіотензинперетворюючого ферменту, АПФ) та амлодипіном (ангіоселективний блокатор кальцієвих каналів) було неефективним.
Поступив у Науково-клінічний інститут педіатрії ім. В.І. Велтіщева Російського національного дослідницького медичного університету ім.
Під час прийому через 14 років у нього був високий АТ (160/120 мм рт.ст.), знижений рівень калію (3,4 ммоль/л, норма 3,7–5,12 ммоль/л) та активність реніну (0,5 нг/мл/год). УЗД не показало відхилення функції нирок. Лікування амлодипіном та бісопрололом (бета-адреноблокатор) не приводило до нормалізації гіпертонії.
Протягом року пацієнт отримував Ірбесартан, Амлодипін, Бісопролол та Моксонідин. Але артеріальна гіпертензія зберігалася.
При надходженні в 15 років його вага становила 70 кг, зріст - 175 см. Інтелектуальний розвиток відповідав його віку. Максимальна АТ становила 159/109 мм рт. Ст. Частота серцевих скорочень лежачи становила 66 ударів на хвилину, частота серцевих скорочень стоячи - 76 ударів на хвилину. Серце не було збільшеним; тони серця були чіткими та ритмічними. Біохімічний аналіз показав знижений рівень калію (3,4 ммоль/л), знижену активність реніну (0,1 нг/мл/год), підвищений рівень лактатдегідрогенази (ЛДГ, 479 ОД/л, норма 0-450 ОД/L) та креатинкінази (CK, 317 U/L, нормальний діапазон 15–190 U/L). Кислотно-лужний баланс зміщується в бік метаболічного алкалозу: pH 7,45, BE (базовий надлишок) + 7,4 ммоль/л, HCO3 ст. 31 ммоль/л. Інші біохімічні показники (рівні натрію, креатиніну та інших), а також рівень альдостерону (88 968 пг/мл), гормональний профіль щитовидної залози та показники серцевої діяльності були в межах норми. Аналіз сечі не зазнав значних змін.
Ехокардіографія показала концентричну гіпертрофію лівого шлуночка, регургітацію трикуспідального та мітрального клапанів. Глобальні систолічні та діастолічні функції міокарда не були ненормальними. Щоденний моніторинг АТ показав стабільну систолічну та діастолічну артеріальну гіпертензію протягом ночі та доби. УЗД черевної порожнини не виявило значних змін.
Через наявність гіпертонії, гіпокаліємії, гіпоренінемії та метаболічного алкалозу у пацієнта очікувалася моногенна форма артеріальної гіпертензії. Диференціальну діагностику проводили між двома станами: синдромом Лідла та синдромом явного надлишку мінералокортикоїдів.
Молодша сестра (14 років, 46 кг, 162 см) пробанда мала нормальний АТ (120/80 мм рт.ст.) з періодичним збільшенням до 160/100 мм рт.ст. З 12 років вона скаржиться на головний біль і нудоту вранці. У неї був знижений рівень альдостерону в сироватці крові (9,7 пг/мл), знижена активність реніну (1,01 нг/мл/год) та нормальний рівень калію (4,0 ммоль/л). Рівень натрію (141 ммоль/л) та кортизолу (12,5 мкг/дл) знаходився в межах норми. У крові сестри не було ознак метаболічного алкалозу (pH 7,4; BE - 3,4 ммоль/л, HCO3 ст. 22 ммоль/л). Аналіз сечі не зазнав значних змін. Ехокардіографія показала симетричну гіпертрофію лівого шлуночка.
Батько пробанда (47 років) також мав артеріальну гіпертензію (АТ 170/120 мм рт.ст. з періодичним підвищенням до 210/140 мм рт.ст.) з 18 років. УЗД показало кісту нирок. Неможливо описати докладні клінічні симптоми батька через його відмову пройти обстеження та лікування.
Геномну ДНК витягували із зразків периферичної крові пробанда, його матері, батька та молодшої сестри.
Секвенування клінічно значущих генів (клінічний ексом) було проведено компанією Genotek Ltd. Комітет з етики Genotek (08/2018) схвалив усі дослідження. Батьки дали письмову інформовану згоду на дослідження та публікацію фотографій, клінічних та секвенційних даних про себе, пробанда та його сестру.
NEBNext Ultra DNA Library Prep Kit для Illumina (New England Biolabs, MA, USA) був використаний як реагент для підготовки бібліотек ДНК. Цільове збагачення проводили за допомогою системи SureSelect XT2 (Agilent Technologies, CA, USA). Наступні зразки були послідовно розподілені на Illumina HiSeq 2500 (зчитування в парі на 100 bp). Для обрізки 3′-нуклеотидів ми використовували Cutadapt [11]. Зчитування було вирівняно до GRCh37.p13 з BWA MEM [12]. Проведено аналіз зчитувань за допомогою FASTQS для контролю якості [13]. Ми назвали короткі варіанти з використанням GATK HaplotypeCaller [14] відповідно до найкращих практик GATK DNA-seq [15, 16]. Варіантні ефекти оцінювали за допомогою snpEff [17]. Для оцінки патогенності була взята інформація з баз даних dbNSFP [18], Clinvar [19], OMIM [20] та HGMD [21]. Обмеження інструментів передбачення silico - SIFT та PolyPhen-2 - не дозволили нам використовувати ці інструменти для такого типу мутацій. Частоти мутантних алелів були вилучені з баз даних 1000Genomes [22], ExAC [23] та Genotek. Патогенність оцінювали відповідно до міжнародних рекомендацій: ACMG (Американський коледж медичної генетики та геноміки), CAP (Коледж американських патологів), AMP (Асоціація молекулярної патології) [24].
Всі екзони генів SCNN1A, SCNN1B та SCNN1G були секвенувані. Додатковий файл таблиці показує інші гени та екзони, які були секвенувані [див. Додатковий файл 1].
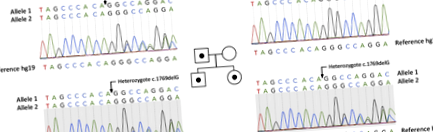
SCNN1G патогенний варіант був ідентифікований у пробанда та його родичів за допомогою секвенування екзоми (клінічний ексом), а потім був перевірений секвенуванням Сангера.
Після секвенування екзома пробанд і його сестра почали приймати амілорид (з гідрохлоротіазидом) та дієту з низьким вмістом солі.
Доза 5 мг амілориду/50 мг гідрохлоротіазиду викликала важкі побічні ефекти (слабкість, втома) у пробанда. Дозу препарату зменшили до 2,5 мг амілориду/25 мг гідрохлоротіазиду. Після 6-місячної терапії АТ пробанда не нормалізувався з максимальним підвищенням до 160/110. Також виявлено підвищений рівень гомоцистеїну (20,5 мкмоль/л, нормальний діапазон 5–12 мкмоль/л). Інші біохімічні показники, а також рівень активності альдостерону та реніну були в межах норми. Однак УЗД виявило дифузні зміни ниркової паренхіми.
Доза 5 мг амілориду/50 мг гідрохлоротіазиду спричинила підвищення рівня креатину до 85 мкмоль/л у сестри пробанда. Дозу препарату зменшили до 2,5 мг амілориду/25 мг гідрохлоротіазиду. Після 6-місячної терапії АТ сестри, як правило, нормалізувався з максимальним підвищенням до 141/98. Інші біохімічні показники, а також рівень активності альдостерону та реніну були в межах норми. Однак УЗД виявило збільшення об’єму та потовщення ниркової паренхіми.
Обговорення та висновки
Ми виявили нову гетерозиготну мутацію c.1769delG (p.Gly590Alafs) SCNN1G (NM_001039.3) за допомогою аналізу NGS та підтвердженого секвенуванням Сангера. Ми виявили цю мутацію у зразках пробанда, його батька та сестри. Не було мутації SCNN1G у матері (рис. 1).
Родовід сім'ї з синдромом Ліддла. Квадрати і гуртків представляють чоловіків та жінок відповідно. Особи з мутацією p.Gly590fs показані як заповнені символи. Особи, яким не вистачає мутації, відображаються як відкриті символи
Ми також виявили, що у пробанда, його матері та сестри є гетерозиготна мутація DSG2 ген: c.458A> G, p.Asn153Ser (NM_001943.3). Згідно з рекомендацією ACMG, ця мутація вважається ймовірно патогенною. Вважається, що мутація цього гена спричиняє аритмогенну (правошлуночкову) дисплазію (OMIM 610193). Інших патогенних варіантів та SNVs не виявлено.
Мутація c.1769delG - це видалення в екзоні 13, який змістив рамку зчитування. Mutalyzer [25] передбачає, що цей варіант призводить до вилучення амінокислот з 590 до 649 і заміни їх короткими послідовностями з 8 амінокислот (рис. 2). Ця послідовність закінчується стоп-кодоном. Згідно з рекомендацією ACMG, мутація c.1769delG вважається ймовірно патогенною. Про цю мутацію ніколи не повідомлялося в літературі та базах даних (включаючи ExaC та 1000 геномів). Також варіант c.1769delG не був виявлений у 2000 пацієнтів бази даних Генотек.
Прогнозування змін γ-субодиниці каналу ENaC через мутацію c.1769delG SCNN1G
Гетерозиготні мутації в SCNN1G може призвести до синдрому Ліддла. На сьогоднішній день існує 6 різних мутацій SCNN1G зареєстровано у 8 сім’ях з Фінляндії, Китаю та Японії [26,27,28,29,30,31,32] (Таблиця 2).
Більшість описаних мутацій видаляють багатий на пролін сегмент (мотив пролін-тирозину, PPPxY) у карбоксильному цитоплазматичному хвості γ-субодиниці (624 PPPKY 628). Цей сегмент займається негативною регуляцією каналу та його переактивацією [5]. PPPxY, служить областю для з'єднання Nedd4 (клітина-попередник нервової системи, що експресує регульований у процесі розвитку білок 4). Цей фермент є убиквітин-білковою лігазою і бере участь у інтерналізації та протеасомній деградації ENaC [33]. Видалення PPPxY пригнічує інтерналізацію та деградацію каналу за допомогою шляху убіквітації-протеасом. Також це призводить до накопичення ENaC у дистальній нефронової верхівці мембрани, що, в свою чергу, збільшує реабсорбцію натрію [4].
Результатом мутації p.Gly590Alafs є укорочення С-кінця γ ENaC за відсутності мотиву PY. Термінація відбувається далі по амінокислотній послідовності, ніж у всіх описаних випадках (Таблиця 2). Це дозволяє нам зменшити межу критичного укорочення γ-субодиниці для синдрому Ліддла. Hansson та ін. повідомляється про мутацію p.Trp574Ter в японській родині з синдромом Ліддла [30]. За даними браузера Genome Browser [34], область від 574 до 590 амінокислот є неконсервативною. Мутаційні помилки, які змінюють цю область, навряд чи матимуть великий вплив на функцію білка. Мутації, що ведуть до передчасного припинення синтезу білка з видаленням мотиву PY, спричиняють зміну функції каналу. Виявлена нами мутація надає подальший доказ того, що видалення збереженого мотиву PY є вирішальним для функціонування субодиниць ENaC.
За допомогою аналізу послідовності ДНК ми діагностували пробанд та його родину. Проникність клітинних мембран для натрію значно збільшується у пацієнтів із синдромом Ліддла. Нирки цих пацієнтів у стані, ніби вони споживають і утримують надмірну кількість солі, а дієта з низьким вмістом солі є значною частиною терапії [35]. Для лікування цього синдрому необхідні калійзберігаючі діуретики, такі як амілорид та триамтерен. Амілорид та триамтерен діють, точно блокуючи ENaC. Терапія синдрому Лідла амілоридом або тріамтереном знижує АТ, а також коригує гіпокаліємію та алкалоз. Амілорид був призначений пробанду та його сестрі. Батько відмовився від лікування. Лікування амілоридом не призвело до нормалізації АТ, але активність реніну в плазмі досягла нормального рівня.
Класичний фенотип синдрому Ліддла характеризується важкою гіпертензією та гіпокаліємією, але це захворювання може бути клінічно неоднорідним. У пацієнтів може бути високий АТ без інших симптомів. Генетичне тестування в поєднанні з гормональними дослідженнями може допомогти у ранньому виявленні моногенної артеріальної гіпертензії. У нашому випадку ідентифікація SCNN1G мутація дозволила розпочати терапію молодшої сестри до розвитку стійкої гіпертензії та патологічних змін у серці. Її АТ після лікування амілоридом має тенденцію до нормалізації.
Існує кілька форм моногенної гіпертензії: синдром Лідла, альдостеронізм, що відновлюється глюкокортикоїдами, синдром Гордона, очевидний надлишок мінералокортикоїдів, вроджена гіперплазія надниркових залоз. Майже всі ці форми характеризуються пошкодженням транспорту електролітів у дистальному нефроні або синтезом або активністю мінералокортикоїдних гормонів [36].
Визначення молекулярної основи синдрому Ліддла є корисним для ранньої діагностики, розуміння патофізіології захворювання та підбору персоналізованої терапії. Складність виявлення моногенних форм гіпертонії збільшує частоту помилкових діагнозів. Неправильне діагностування та неправильне лікування можуть спричинити інсульт на початку захворювання, термінальну стадію ниркової недостатності, інфаркт міокарда та раптову смерть.
Підсумовуючи, ми описали сім'ю, яка страждає синдромом Ліддла, спричиненим новою мутацією зміщення кадру (c.1769delG) у гені, що кодує γ-субодиницю епітеліального натрієвого каналу.
Наявність даних та матеріалів
У статті ми не використовували нове програмне забезпечення, бази даних чи програми/інструменти. Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора на обґрунтований запит.
- Хвороба зберігання глікогену пізнього періоду типу II (хвороба Помпе) з новою мутацією Малайзія
- Синдром активації тучних клітин (частина 3) Роль харчування та стресу - для травного миру
- Синдром активації мастоцитів - що він є, а що ні; Практичне гастро
- Користь для здоров’я капусти - Садівничий канал
- Користь для здоров’я нектарину - Садівничий канал