Сенсорні нерви змінюють функцію, протилежну монотерапії, і можуть сприяти симетричному поширенню запалення
Анотація
Вступ
Симетрія запалення є фундаментальною характеристикою ревматоїдного артриту (RA; Arnett et al., 1988) і призводить до широко розповсюджених важких вад розвитку та нерухомості суглобів (Clarke et al., 1994; Zangger et al., 2005). Незважаючи на велику літературу про етіологію та патогенез РА, недостатньо розуміння причин (причин) симетрії цього захворювання.
Хоча імунна відповідь має очевидне значення при прогресуванні РА, важко зрозуміти, як саме це може лежати в основі симетричної моделі участі суглобів. Левін та його колеги припустили, що ця симетрія може бути підкріплена суглобовою іннервацією, і запропонували нейрогенний внесок як у існуюче запалення, так і в симетричну структуру РА (Levine et al., 1985a, b; Levine & Basbaum, 1990). Зараз значна кількість доказів підтримує „нейрогенну” гіпотезу (Donaldson et al., 1995; Rees et al., 1996; Decaris et al., 1999). Епідеміологічні дослідження демонструють, що уражені суглоби мають тенденцію відображати дзеркальний малюнок (Egger et al., 1995; Zangger et al., 2005). У пацієнтів, у яких розвивається РА після пошкодження нерва, спостерігається щадіння денервованих суглобів (Thompson & Bywaters, 1962; Glick, 1967; Glynn & Clayton, 1976; Veale et al., 1993), і РА може розсмоктатися в уражених суглобах, які згодом втрачають свою сенсорну іннервацію (Лападула та ін., 1997).
Тваринні моделі РА підтримують нейрогенну гіпотезу. Добре налагоджена модель повного ад'юванту Фрейнда (CFA) у щурів демонструє симетрію ураження суглобів через 2–4 тижні залежно від місця та концентрації ін’єкції CFA (Donaldson et al., 1993; Decaris et al., 1999). CFA-індуковане запалення залишається одностороннім після ураження контралатерального гомологічного нерва нейротоксином капсаїцином (Donaldson et al., 1995), внаслідок чого ванілоїдні рецептори підтипу 1 (TRPV1; також відомий як VR-1) експресують нейрони у розповсюдженні запалення. Крім того, в контралатеральному суглобовому нерві було зафіксовано механічно викликану антидромну (поза ЦНС) нейрональну активність (Rees et al., 1996). Вазоактивні нейропептиди, речовина P (SP), і пептид, пов’язаний з геном кальцитоніну (CGRP), вивільняються з первинних аферентних терміналів після активації (White & Helme, 1985); вони підвищують як проникність судин, так і розширення судин (Brain et al., 1985; Ferrell & Russell, 1986; Holzer, 1998) і є хемотаксичними для лімфоцитів, тим самим ініціюючи запалення (Helme et al., 1987; Mantyh, 1991; Holzer, 1998) . Вміст синовіальних SP та CGRP швидко та двосторонньо зростає після індукції артриту CFA (Bileviciute et al., 1993) і, ймовірно, сприяє контралатеральному ураженню суглобів (Lam et al., 2004).
Хоча зараз загальновизнано, що нервова система відіграє важливу роль у контралатеральному розповсюдженні запалення, більша частина цього розуміння базується на дослідженнях ураження нервів. Дуже мало досліджень безпосередньо вивчали функцію контралатеральних нервів на моделях РА. Нашою метою було перевірити гіпотезу про те, що функція контралатерального нерва змінюється після розвитку артриту. Далі, наше дослідження мало на меті визначити, чи може та як ця змінена функція модулюватися, і чи є приховані зміни, що свідчать про запалення в контралатеральному суглобі.
Матеріали і методи
Тварини
Всі процедури на тваринах виконувались відповідно до законодавства Великобританії [Animal (Scientific Procedutions) Act, 1986], були ліцензовані Міністерством внутрішніх справ Великобританії та відповідали рекомендаціям Міжнародної асоціації з вивчення болю (Zimmermann, 1983). Самців щурів Wistar (250–300 г) отримували з групи В і К (Брістоль, Великобританія), утримували по чотири в клітці і утримували на їжі та воді ad libitum з 12-годинним циклом світло-темрява.
Наркотики
Пентобарбітал натрію був отриманий у формі натрієвої солі від Sigma (Дорсет, Великобританія) і виготовлений власноруч для внутрішньовенного введення. та i.v. ін’єкція для ін’єкції та підтримки анестетика відповідно. Капсаїцин отримували з компанії Tocris (Брістоль, Великобританія) і готували у 10% етанолі, 10% Твін 80 та 80% сольовому розчині. Дипірон (метамізол) отримували від Sigma (Дорсет, Великобританія) і розчиняли у фізіологічному розчині. Лігнокаїн, 2%, був отриманий від Deproco Ltd (Кент, Великобританія).
Індукція CFA-індукованого запалення
Короткий наркоз був введений галотаном (3% в O2); як тільки арефлексія була досягнута, 250 мкг/100 мкл CFA (Mycobacterium tuberculosis у мінеральній олії) вводили через сухожилля надколінка в правий колінний суглоб для індукції артриту (Rees et al., 1994). Щурів повертали в домашню клітку, дозволили їм відновитися, і щодня спостерігали за порушенням ходи. Вимірювання діаметра іпсилатерального та контралатерального колінного суглоба проводили у артритних щурів за допомогою штангенциркулів у день електрофізіологічних експериментів.
Хірургічні процедури
Через три-п’ять днів після внутрішньосуглобової ін’єкції CFA анестезію індукували пентобарбіталом натрію (60 мг/кг, в/в), а зовнішню яремну вену і трахею канюлювали для підтримання анестезії (10 мг/кг/год, в/в) і очищення дихальних шляхів, відповідно. Температуру тіла в основному підтримували (36,5–37,5 ° C) за допомогою датчика ректальної температури, підключеного до нагрівальної лампи через блок управління зворотним зв’язком. Шкіру та сполучні тканини, що перекривають передні сторони лівого коліна та медіальний аспект стегна, розрізали від пахової ямки до точки безпосередньо під медіальним виростком гомілки. Нижня частина ноги була прикріплена до платформи для стійкості. Оголили медіальний аспект ноги і створили масляний басейн, використовуючи шкіру задньої кінцівки; її заливали підігрітим (37 ° С) мінеральним маслом (Sigma, Великобританія). Лівий підшкірний нерв (контралатеральний до запалення), який іннервує задню кінцівку, включаючи колінний суглоб, був розсічений вільно від сполучної тканини в точці, що знаходиться проксимальніше колінного суглоба, і розрізаний для запобігання реєстрації аферентної активності з більш дистальних частин задньої частини щура -піднімання.
Позаклітинний запис
Експерименти з плазмової екстравазації
Щурів, які отримали ін'єкцію колінного суглоба CFA (за 4 дні до цього), знеболювали (пентобарбітал 60 мг/кг, внутрішньовенно), а зовнішню яремну вену та трахею канюлювали. Через певний проміжок часу, щоб забезпечити стабілізацію після гострих наслідків хірургічного втручання (~ 30–40 хв), ін’єктували синій барвник Evans (50 мг/кг, в/в). Через двадцять хвилин після прийому Еванса синіх щурів перфузували транскардально фізіологічним розчином. Обидва колінних суглоби швидко розтинали, очищали від шкіри та м’язів, зважували і поміщали у формамід, а потім на валик на 24 години при кімнатній температурі. Рівні вилученого синього барвника Еванса вимірювали спектрофотомічно (620 нм) і виражали у мкг/мл/г. Техніка Еванса Блю - добре відомий метод, який зазвичай використовується для оцінки ефектів ноцицептивної аферентної стимуляції на функцію судин (Janig & Lisney, 1989; Bharali & Lisney, 1992; Kolston & Lisney, 1993).
Статистичний аналіз
Дані виражаються як середнє значення та SEM. Статистичний аналіз проводили за допомогою непараметричного t-критерію (Манна – Уітні), парного t-критерію та непараметричного одностороннього anova, де це доречно.
Результати
Розвиток артриту
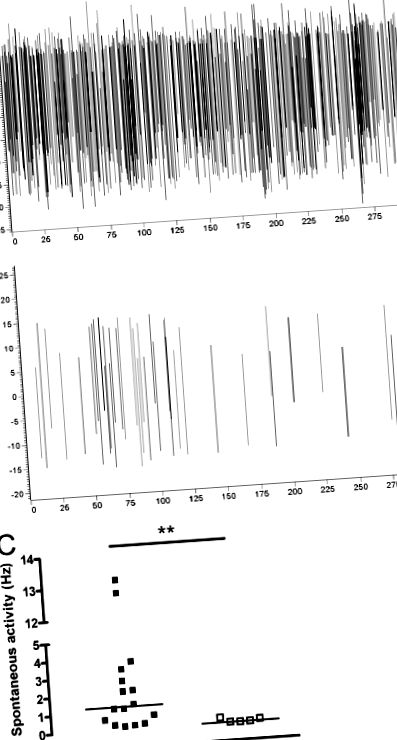
У всіх щурів, які отримали внутрішньосуглобову ін’єкцію CFA, за 3–5 днів до цього, розвинувся значний односторонній і локалізований набряк правого колінного суглоба (іпсилатеральний, 1,32 ± 0,03; контралатеральний, 0,91 ± 0,01 см у діаметрі; P Рис. 1A та В). Механічно викликана активність не була ні надійною, ні відтворюваною, і тому ми зосередилися на вивченні спонтанної нейрональної активності. Щоб визначити, чи обумовлена ця активність нейронів наявністю запалення в правому колінному суглобі, ми провели однакові експерименти на контрольних неін’єкційних щурах (n = 5). За той самий час запису, що і у щурів CFA (0–20 хв), контрольні щури виявляли дуже низький рівень антидромної активності (рис. 1В та С); коли було проведено статистичне порівняння між двома групами, активність, зафіксована протилатерально запаленню у щурів CFA, була значно вищою, ніж у нелікованих контрольних щурів (P Рис. 1C). В одному експерименті перетин підшкірного нерва, який іннервує запалений суглоб під час запису, тим самим перериваючи посилений вхід з місця запалення, не впливав на спонтанну активність контралатера (дані не наведені).
Вплив CFA-індукованого запалення колінного суглоба на контралатеральну антидромну активність. (А і В) Ділянка спонтанних потенціалів антидромної дії (від піку до піку), зафіксованих з лівого підшкірного нерва протягом 5-хвилинного періоду з типового експерименту на (А) щурі CFA та (В) контрольному щурі. (C) Середня частота спонтанних антидромних AP, зафіксованих з лівого підшкірного нерва протягом 20-хвилинного періоду, була значно вищою у щурів, які отримували внутрішньосуглобову ін’єкцію CFA (250 мкг/100 мкл; n = 16) в праву колінний суглоб, ніж у контрольних неін’єкційних щурів (n = 5); ** P Рис. 2A). Лігнокаїн спричинив майже повне скасування зареєстрованої активності протягом декількох секунд після застосування (рис. 2А). Спонтанна антидромна активність почала відновлюватися через ~ 15–20 хв і завершилась через 1 год (дані не наведені). Оскільки відомо, що підшкірний нерв містить як сенсорні, так і симпатичні нервові волокна у приблизному співвідношенні 4: 1 (Baron et al., 1995), ми прагнули з'ясувати, чи спостерігається діяльність сенсорного чи симпатичного походження. Ми застосували капсаїцин (2%), агоніст рецептора TRPV1, який, як відомо, блокує сенсорну передачу, безпосередньо на нерв в місці, розташованому проксимальніше місця запису (n = 6; рис. 2B). Капсаїцин зміг майже повністю скасувати зареєстровану активність, яка не відновилася протягом досліджуваного періоду часу (рис. 2Б). У деяких експериментах спостерігалася невелика кількість залишкової активності після застосування капсаїцину.
Спонтанні потенції антидромної дії виникали централізовано і передавалися чутливими нейронами, чутливими до капсаїцину. (A) Лігнокаїн (2%) і (B) капсаїцин (2%), нанесені безпосередньо на нерв, проксимальніше місця реєстрації у щурів CFA (n = 5 або 6), блокували генерацію спонтанних антидромних AP. * P Рис. 3B). Для того, щоб дослідити, чи може клінічно важливий фармакологічний засіб модулювати зростаючі рівні спонтанної антидромної активності, що спостерігаються після індукованого CFA запалення, ми ввели парацетамол (ацетамінофен), аналгетик центральної дії, дипірон (50–250 мг/кг, iv), та вивчав вплив на частоту спонтанних потенціалів антидромної дії. У більшості випадків (5/7 експериментів) дипірон знижував частоту спонтанної антидромної активності до рівнів, що наближаються або навіть нижче базових рівнів активності (рис. 3А). В цілому, введення дипірону зменшило активність контралатеральних сенсорних нейронів, пригнічуючи збільшення активності з часом, що було очевидним в експериментах із сольовим контролем (рис. 3B). З часом спостерігався значний ефект дипірону, як показало значне зменшення площі під кривою (AUC) у присутності дипірону порівняно з експериментами з контролем сольового розчину (рис. 3C; P ig. 3
Вплив CFA-індукованого запалення колінного суглоба на іпсилатеральну та контралатеральну екстравазацію синього барвника Evans (мкг/мл/г тканини). (А) Кількість синього кольору Еванса, вилученого з іпсилатеральних та контралатеральних колінних суглобів щурів CFA (n = 11), була значно більшою, ніж кількість, отриманого з колінних суглобів (лівого та правого) контрольних щурів (n = 4), *** P 4B) вони не виявляють набряків. Це свідчить про те, що екстравазацію синього кольору Еванса можна збільшити за обставин, коли судинна проникність чітко не змінена. Це означає, що в суглобах, контралатеральних від явного запалення, судинна функція змінюється, але проникність судин (що призводить до набряків), ймовірно, не.
Обговорення
Моделі RA на тваринах демонструють симетрію залучення суглобів (Donaldson et al., 1993) і дають ідеальну можливість для вивчення основних механізмів та розробки потенційних стратегій лікування. У минулому використання цих моделей у поєднанні з ураженням нервів забезпечило докази того, що нейрогенні механізми мають центральне значення для розвитку та підтримання контралатеральних ефектів (Levine et al., 1985b; Bileviciute et al., 1993; Mapp et al. ., 1993; Donaldson et al., 1995; Kidd et al., 1995; Rees et al., 1996; Decaris et al., 1999; Lombard et al., 1999; Lam et al., 2004). Однак було проведено мало електрофізіологічних досліджень для безпосереднього дослідження функціональної пластичності, яка виникає в контралатеральних сенсорних нервах після індукції артриту. Наші дані вперше описують, що чутливий нерв, контралатеральний артриту, здійснює спонтанні дії до периферії. Крім того, наші дані свідчать про те, що функція судинної системи також змінена в контралатеральному колінному суглобі. Ми повідомляємо, що ці зміни відбулися до явних ознак симетричного запалення, і ми припускаємо, що описана пластичність має важливі наслідки для поширення запалення в цій моделі і може відображати зміни, виявлені у людини. Важливо те, що ми змогли продемонструвати, що втручання з анальгетиком центральної дії змогло модулювати контралатеральну нейрональну активність.
У цьому дослідженні контралатеральна спонтанна антидромна нервова діяльність залежала від наявності запалення і могла бути скасована за допомогою лігнокаїну та капсаїцину, що застосовуються безпосередньо до нервового стовбура. Таким чином, ми підтвердили, що ця активність була нейронною, виникла централізовано і відбувалась у сенсорних волокнах, що експресують TRPV1 (Pini & Lynn, 1991). У деяких тварин CFA ми спостерігали, що після застосування капсаїцину була присутня невелика кількість залишкової активності нейронів, що означає, що може спостерігатися зміна активності у контралатеральних симпатичних еферентів (Helliwell et al., 1998; Tominaga et al., 1998; Smith et al., 2004; Moalem et al., 2005). Однак периневральний капсаїцин запобігає симетричному розповсюдженню артриту в цій моделі (Donaldson et al., 1995), маючи на увазі, що саме сенсаційні нейрони, чутливі до капсаїцину, є основними для симетричного прогресування артриту.
Отримані нами дані вказують на те, що центральні зміни, що сприяють генерації антидромної активності та подальшим змінам функції судин, вже встановлені через 3-5 днів після ін’єкції CFA. Порівняно короткі часові рамки повідомлених змін узгоджуються з попередніми звітами про двосторонні наслідки (Kidd et al., 1995; Rees et al., 1996). Цікаво, що антидромна стимуляція нервів при інтенсивності C-волокон викликає як односторонню (Janig & Lisney, 1989), так і двобічну екстравазацію плазми (Ferrell & Russell, 1986), що свідчить про те, що змінений сенсорний вхід у спинний мозок може спричинити дуже швидкі зміни в контралатеральних вихід. Екстравазація плазми колінного суглоба внаслідок стимуляції периферичного нерва залежить від сенсорної аферентної залежності без внеску симпатичних еферентних факторів, які фактично відповідають за зменшення плазмової екстравазії (Ferrell & Russell, 1986). Хоча симпатичні еференти були причетні до розвитку артриту (Aloe et al., 1992; Bileviciute et al., 1995; Lubahn et al., 2004) та до поширення запалення (Levine et al., 1986), їх можливий внесок досі незрозуміло.
Підводячи підсумок, наші дані показують, що в основі контралатеральних запальних змін лежить нейрональний корелят, який проявляється як триваюча антидромна активність у сенсорних нейронах, яка здатна змінити контралатеральну суглобову перфузію дуже рано на початку захворювання. Ранній початок контралатеральних змін буде проблемою для лікування РА, але наш висновок про те, що анальгетик центральної дії дипірон може зменшити контралатеральну антидромну активність, вказує на те, що раннє втручання з цим класом препаратів може бути корисним для запобігання поширенню артриту. Розуміння нейрональних механізмів, що лежать в основі поширення артриту, має чітке клінічне значення, щоб ми могли сповільнити прогресування цього руйнівного та виснажливого захворювання.
- Поживний коктейль підтримує молодіжні функції у старінні новин щодо старіння
- Skinny s fitness Що приймати вітаміни для схуднення, комплекси, що сприяють схудненню,
- Системи громадського транспорту сприяють зниженню ваги та покращенню стану здоров’я
- Гастректомія рукава швидко посилює функцію острівців незалежно від маси тіла
- Збереження м’язової маси та функцій у прикутих до ліжка дорослих літніх людей - Повний текст