Регулювання перекладу в найпростіших паразитних лейшманіях
Земфіра Н. Карамишева
1 Відділ біологічних наук, Техаський технічний університет, Лаббок, Техас 79409, США
Снайдер Олександр Гутьєррес Гуарнісо
2 Відділ клітинної біології та біохімії, Техаський університет, Центр наук про здоров'я, Лаббок, Техас 79430, США; ude.cshutt@zinraugs
3 Програма естудії та управління де Енфермедадес Тропікалес, Університет Антіокія, Медельїн 050010, Колумбія
Андрій Л. Карамишев
2 Відділ клітинної біології та біохімії, Техаський університет, Центр наук про здоров'я, Лаббок, Техас 79430, США; ude.cshutt@zinraugs
Анотація
Лейшманіоз є серйозною проблемою здоров'я у всьому світі, і стійкість до наркотиків викликає все більшу стурбованість. Паразити лейшманії використовують незвичні механізми контролю своєї експресії генів. На відміну від багатьох інших видів, вони не мають регуляції транскрипції. Відсутність контролю транскрипції в основному компенсується механізмами посттранскрипції, включаючи жорсткий контроль трансляції та регулювання стабільності/трансляції мРНК за допомогою РНК-зв’язуючих білків. Модуляція трансляції відіграє важливу роль у виживанні паразитів та адаптації до різко різних середовищ під час зміни господаря; проте наші знання про тонкомолекулярні механізми трансляції в Лейшманії залишаються обмеженими. Тут ми розглядаємо поточний прогрес у нашому розумінні того, як зміни в поступальному механізмі сприяють диференціації паразитів під час передачі від піщаної мухи до хазяїна ссавця, та обговорюємо, як поступове перепрограмування може сприяти розвитку стійкості до наркотиків.
1. Вступ
Види лейшманій - це одноклітинні найпростіші, які спричиняють лейшманії, що вражають близько 12 мільйонів людей у всьому світі [1]. В даний час визнано 53 види лейшманій, з них 20 патогенні для людини [2]. Вісцеральний лейшманіоз, також відомий як кала-азар, є найважчою формою захворювання, із смертністю майже 100%, якщо її не лікувати [3,4]. Зазвичай це викликано L. donovani та L. infantum. У пацієнтів спостерігається збільшення селезінки та печінки, лихоманка та втрата ваги. Інший тип, слизово-шкірний лейшманіоз, утворює ураження, які можуть призвести до серйозного руйнування слизових оболонок носа, порожнини рота та горла. Викликається в основному L. braziliensis та L. panamensis. Шкірні форми лейшманіозу є найпоширенішими і характеризуються наявністю шкірних виразок; вони становлять близько 90% усіх нових випадків [5]. До 20 видів можуть викликати шкірний лейшманіоз [2]. На жаль, можливості лікування лейшманіозу дуже обмежені, а стійкість до наркотиків є великою проблемою [6,7].
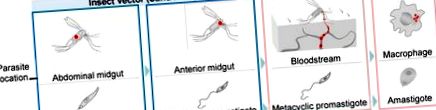
Протягом свого життєвого циклу ці венозні найпростіші чергуються між джгутиковими промастиготами, які живуть у позаклітинній формі в середній кишці піщаних мух, та амастиготами, які мешкають у фаголізосомному відділі макрофагів ссавців (рис. 1). Контроль над лейшманіозом утруднений відсутністю безпечної вакцини, обмеженим вибором препаратів, їх високою токсичністю та появою штамів, стійких до лікарських засобів [8,9].
Основні етапи диференціації паразитів Лейшманії. Протягом життєвого циклу Лейшманії паразити переходять від векторів фліботомінних піщаних мух до господарів хребетних ссавців. У безхребетних господарів Leishmania spp. приймає два різні етапи. Проциклічні промастиготи розмножуються в середній кишці живота комахи, поступово стаючи метациклічними промастиготами, мігруючими до передньої середньої кишки. Далі паразити передаються господарям ссавців під час прийому крові. Потрапивши в хазяїна хребетних, паразити потрапляють у фагоцити і перетворюються на внутрішньоклітинні амастиготи. Амастиготи можуть виживати та розмножуватися всередині фаголізосоми, врешті-решт руйнуючи клітину-хазяїна, заражаючи нові клітини ссавців та відновлюючи інфекцію під час укусу нового комахи. Червоні крапки вказують на місцезнаходження паразитів.
Паразити лейшманії мають унікальні молекулярні особливості, такі як поліцистронна транскрипція та, як результат, відсутність контролю транскрипції [10,11]. Довгі поліцистронні транскрипти, що кодують функціонально не пов'язані білки, виробляються РНК-полімеразою II. Поліцистронні РНК обробляються шляхом 5 ′ транс-сплайсингу з обмеженою сплайсированною лідерною послідовністю та 3 ′ поліаденілювання для утворення зрілих мРНК [12]. Отже, відсутність контролю транскрипції робить Лейшманію гарною моделлю для вивчення посттранскрипційної регуляції, включаючи трансляцію мРНК, що представляє основний механізм експресії генів у видів Лейшманії.
Оскільки Leishmania spp. не маючи контролю транскрипції, вони еволюціонували, щоб мати різноманітні РНК-зв’язуючі білки (RBP) для контролю експресії генів після транскрипції. RBP сприяють диференціації паразитів та підтримують їх виживання у безхребетних та хребетних господарів, де вони стикаються з таким різко іншим середовищем. Ця тонка настройка регуляції експресії генів протягом життєвого циклу паразита досягається модулюванням стабільності рівня мРНК та участю транскриптів у трансляції.
У цьому огляді ми зосереджуємося на ролі трансляційного контролю та RBP у регуляції життєвого циклу паразита та здатності виживати та процвітати під час передачі іншому хазяїну. Особливий акцент приділяється ролі трансляційного перепрограмування у розвитку стійкості до наркотиків. Розкриття молекулярних механізмів поступального контролю, що використовуються паразитами Лейшманії для процвітання в різних хазяїнах, таких як піщані мухи та ссавці, та розшифровка ролі трансляційного перепрограмування у стійкості до лікарських засобів допомагають виявити нові фармакологічні цілі та розробити нові методи лікування в майбутньому.
2. Трансляційний контроль під час диференціації лейшманії
Найпростіші паразити лейшманії мають складний життєвий цикл паразитів, що чергується між переносчиком піщаної мухи та господарем ссавців. Вони існують як високо рухливі промастиготи, що містять джгутики (у комах), і як амастиготи з дуже короткими джгутиками (у ссавців). Джгутикові промастиготи живуть вільно в середній кишці комахи і зазнають значної трансформації у господаря ссавців, де стають амастиготами, що живуть усередині макрофагів.
Регуляція трансляції на різних стадіях життєвого циклу у паразитів лейшманії. Паразити лейшманії зазнають різких змін у трансляції під час зміни господаря. Під час переходу від вектора комах до хребетних господарів зміни температури, рН та живлення сприяють загальній поступальній репресії через фосфорилювання eIF2α. Одночасно в амастиготах регулюється селективна трансляція, щоб забезпечити виживання та адаптацію паразитів у макрофагах. У піщаної мухи паразити відчувають значне зниження температури та зміну рН та живлення. Це сприяє значному збільшенню трансляції та диференціації амастиготів до сильно проліферативних промастиготів. MΦ, макрофаг; PP, проциклічні промастиготи; МП, метациклічні промастиготи; AM, амастиготи.
Ініціювання трансляції може зіграти велику роль у поступальному перепрограмуванні, коли паразити потрапляють в іншого господаря. Ініціювання трансляції відбувається шляхом зв'язування зв'язуючого ковпачок білка eIF4E з 5 'структурою ковпачка, разом з його партнером по зв'язуванню eIF4G, який служить білком риштування [20]. Потім набирається велика субодиниця рибосоми, коли комплекс ініціації досягає першого AUG [27]. Цікаво, що геноми трипаносоматидів, включаючи види Leishmania, мають велику кількість комплексів, що зв’язують ковпачок, включаючи шість паралогів eIF4E та п’ять паралогів для білка риштування eIF4G [30,31,32,33,34,35]. Наявність багатьох паралогів з різною зв'язуючою активністю та профілями експресії протягом життєвого циклу паразита свідчить про те, що кожен паралог еволюціонував, виконуючи різну біологічну функцію та дуже складну регуляцію експресії генів, під час ініціації трансляції для підтримки паразита. виживання в постійно мінливих умовах. Однак точна роль цих білків у паразитах Лейшманії залишається незрозумілою і вимагає подальшого дослідження.
3. Білки, що зв'язують РНК, та їх роль у регулюванні трансляції та диференціації паразитів
Схематичне зображення взаємодії РНК-зв’язуючих білків (RBP) з мРНК під час трансляції у паразитів Leishmania. RBP Leishmania згруповані у чотири основних класи: білки Alba (ацетилювання знижує спорідненість), білки Puf (Pumilio та Fem-3-фактор зв’язування), білки пальця цинку CCCH та мотиви розпізнавання РНК (RRM). RRM включають білки, що зв’язують мРНК у різній частині 3 ′ нетранслируемой області (3′UTR) та полі (A). Полі (А) -зв’язуючий білок (PABP) показаний як приклад білків RRM. RBP модулюють селективний переклад шляхом стабільності мРНК, розпаду мРНК, асоціації полісом або процесу зберігання мРНК.
Білки CCCH (Cys3His Zinc finger) характеризуються наявністю певного цинково-пальцевого мотиву з перевагою зв'язування багатих на АС елементів у РНК [40]. Білки трипаносоми ZFP1 та ZFP2 належать до сімейства CCCH, і обидва вони важливі для диференціації від кровотоку до проциклічних форм [40,53,54]. Хоча ZC3H20 необхідний для проциклічних форм, ZC3H11 є важливим для паразитів крові [55,56]. Запропоновано ZC3H11 виступати в якості платформи при наборі PABP до 3′UTR та регулювати стабільність і трансляцію мРНК [57]. ZC3H11 захищає підмножину мРНК від поступальної репресії під час теплового шоку, а багато з індукованих теплом мРНК також підвищуються під час диференціювання до інфекційних форм ссавців [14]. Біоінформаційний аналіз бази даних геному TriTryp виявив, що Trypanosoma brucei має 48 білків CCCH, тоді як Leishmania major містить 54 білки, 8 з яких є унікальними; однак роль білків CCCH у регуляції диференціації паразитів Лейшманії ще не розглядалася [58,59].
Відомо, що білки Puf беруть участь у регуляції локалізації, стабільності та трансляції мРНК через зв'язування з мотивом послідовності в 3'UTR специфічних мРНК [60,61,62]. Білки Puf містять РНК-зв'язуючий домен, що складається з декількох недосконалих повторень амінокислот, які називаються повторами Puf. Білки Puf сприяють трансляційній репресії та деградації мРНК завдяки взаємодії з цис-елементами в 3'UTR специфічних мРНК [63,64,65,66]. Види Leishmania та Trypanosoma містять до 10 різних білків Puf [67,68,69,70,71]. Білок Puf6 регулює селективні рівні транскрипту протягом життєвого циклу паразита за рахунок деградації мРНК [72,73]. Білки Puf можна знайти разом із LeishIF4E-3 у гранулах стресу, спричинених голодом, у Leishmania [20]. Однак загалом про біологічні функції білків Puf в Лейшманії відомо дуже мало.
Іншими білками, що взаємодіють з 3′UTR, є білки Alba [74]. Вони є рясними мРНК-зв’язуючими білками, що регулюють трансляцію в трипаносоматидах, і їх можна знайти у поєднанні з полісомами та трансляцією мРНК [75]. Експресія білків Альби регулюється стадією у трипаносоми та сприяє диференціації паразитів під час їх розвитку у мухи цеце [76]. У той час як Трипаносома має чотири білки з домом Alba, геном Leishmania infantum має лише два білки Alba [39,77]. Білок LiAlba3 може зв’язувати дельта-амастин 3′UTR та регулювати стабільність мРНК амастину у Leishmania infantum під час стадії амастиготи [74]. Встановлено, що обидва білки Альби пов'язані з рибосомальними субодиницями в Лейшманії, на відміну від Трипаносоми, де білки Альби спостерігаються в полісомах; проте незрозуміло, як це сприяє різниці у функціях [78].
Таким чином, паразити Лейшманії мають велику різноманітність РНК-зв’язуючих білків (RBP), що відіграють особливо важливу роль у регуляції трансляції білків через контроль стабільності/трансляції мРНК та забезпечуючи точну настройку трансляції білка під час диференціювання паразита за відсутності контролю транскрипції . Незважаючи на те, що етапи життєвого циклу Лейшманії добре вивчені, ми лише на початку розуміємо, які молекулярні механізми поступального контролю діють на різних стадіях життєвого циклу паразита, і як різні RBP сприяють цьому.
4. Стійкість до наркотиків та переклад
Дослідження резистентності до наркотиків у Лейшманії зосереджувались в основному на Sb V, оскільки це основний препарат, що використовується в даний час для лікування. Дослідження показують, що Лейшманія використовує принаймні чотири основних механізми протидії препарату Sb V: (а) зменшення споживання наркотиків; (b) запобігання активації наркотиків; (c) секвестрація наркотиків; і (d) збільшення потоку ліків (рис. 4 А).
Зменшення споживання ліків може бути досягнуто шляхом зниження регуляції мембранних білків у вигляді аквагліцеропорину (AQP1) [91]. Активація препарату може бути заблокована негативною регуляцією специфічних ферментів редуктази, захищаючи паразитів, запобігаючи відновленню від Sb V (проліки) до тривалентної сурми (Sb III, активна лікарська форма). Дія Sb V може бути інактивована утворенням метало-тіолових кон'югатів, що призводить до секвестрації ліків. Нарешті, надмірна експресія транспортерів ABC посилює витікання лікарських засобів кон’югатів метало-тіолу через везикули, які зливаються з плазматичною мембраною під час екзоцитозу [92].
Добре задокументовано, що перепрограмування трансляції мРНК відіграє ключову роль у стійкості до лікарських засобів під час лікування раку, і орієнтація на конкретні елементи механізму перекладу стає новою стратегією терапії раку [101,102,103,104,105]. Незважаючи на те, що стійкість до наркотиків у Лейшманії вивчалася протягом останніх 20 років, роль трансляційного регулювання залишалася по суті нехтуваною. Обговорені тут дослідження дозволяють припустити, що під тиском наркотиків Лейшманія повинна активувати скоординоване перепрограмування трансляції, модулюючи селективний переклад мРНК та активуючи шляхи боротьби з наркотиком (рис. 4 Б). Цей процес може бути вузько спеціалізованим на трипаносоматидних організмах, які не мають контролю транскрипції. Хоча дані свідчать про важливість поступального контролю, виявлення того, як паразити перепрограмують свій переклад, щоб протистояти присутності препарату та розвинути резистентність, вимагає майбутніх досліджень.
5. Висновки та перспективи
Мета цього огляду - забезпечити поточний прогрес, досягнутий у дослідженнях щодо поступального контролю над паразитами лейшманії. Трансляційний контроль є основним механізмом, що сприяє перетворенню промастиготів (стадія піщаної мухи) в амастиготи (стадія ссавців), що досягається за рахунок зменшення глобальної трансляції за допомогою фосфорилювання eIF2α. Ініціювання факторів трансляції та величезна різноманітність білків, що зв’язують РНК, є важливими для диференціації, проте точні біологічні функції характеризуються лише для деяких з них. Подальше вивчення ролі різних трансляційних регуляторів та RBP є необхідним для кращого розуміння біології дигенічного паразита.
Резистентність до наркотиків є однією з основних проблем у лікуванні лейшманіозу, і обхід проблеми резистентності до ліків є критичним для успішного лікування в майбутньому. Для ефективної боротьби з цією хворобою необхідне краще розуміння тонких механізмів розвитку резистентності до наркотиків. Хоча зміни на геномному рівні, що сприяють розвитку стійкості до наркотиків, дуже добре вивчені, роль трансляційного перепрограмування залишається в основному невивченою. Розуміння механізму, відповідального за глобальне поступальне перепрограмування під час розвитку стійкості до наркотиків, буде дуже цінним при розробці нових високоефективних терапевтичних альтернатив для лікування лейшманіозу.
Скорочення
| eIF2α | альфа-субодиниця еукаріотичного фактора ініціації 2 |
| RBP | РНК-зв’язуючі білки |
| Puf | Пуміліо та фактор зв'язування Fem-3 |
| Альба | ацетилювання знижує спорідненість до зв'язування |
| RRM | РНК-розпізнавальний мотив |
| PABP | Полі (А) -зв’язуючий білок |
| CCCH | Cys3His цинковий палець |
| ZFP1 | цинковий білок пальця 1 |
| ZFP2 | цинковий білок пальця 2 |
| UTR | неперекладений регіон |
| CDPK1 | кальційзалежна протеїнкіназа 1 |
| TCA | цикл трикарбонової кислоти |
Внески автора
Z.N.K. та А.Л.К. написав рукопис; S.A.G.G. брав участь у написанні частини рукопису про резистентність до наркотиків, розробляв та готував малюнки; всі автори обговорювали та редагували рукопис. Усі автори прочитали та погодились з опублікованою версією рукопису.
Фінансування
Ця робота була підтримана стартовими коштами від Технічного університету Технічного університету з питань охорони здоров’я компанії A.L.K.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів. Фінансисти не мали ролі в розробці дослідження; під час збору, аналізу чи інтерпретації даних; під час написання рукопису або рішення про публікацію результатів.
- Регулювання та контроль якості харчових добавок; Дослідіть інтегративну медицину
- Регулювання негативних зворотних зв’язків опосередкованої RIG-I противірусної сигналізації індукованою інтерфероном ISG15
- Регулювання; Проблеми контролю якості в галузі харчових добавок; Новини лікарів-натуропатів
- Рецепти очищення від паразитів; Очистити довідку
- Очищення від паразитів; Детокс - Чай Суей