Простий спосіб виробництва великих 3D макропористих гідрогелів для сучасних біотехнологічних, медичних та екологічних застосувань
Предмети
Анотація
Вступ
Результати
Звичайний синтез макропористих гелів
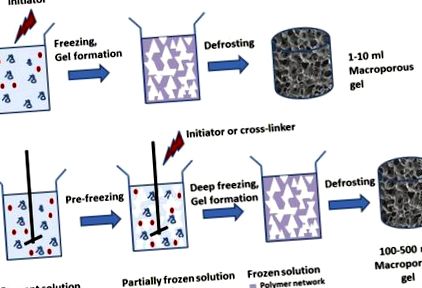
Макропористі гелі готували кріогелюванням, включаючи заморожування вихідного гелеутворюючого розчину та проведення полімеризації або гелеутворення при температурі 12-18 градусів нижче точки замерзання розчинника (рис. 1а).
Схематичне зображення способу приготування кріогелю звичайним методом (a) та новий (попередньо заморожувальний) підхід, викладений тут (b).
Кристали розчинника (льоду), що утворюються при заморожуванні розчинника, діють як пороген. Пори, заповнені водою, утворюються після розморожування матеріалу. Щоб отримати макропористий гель, кристали розчинника потрібно утворити до утворення гелю. Для зменшення градієнта температури, а також уповільнення реакції, що призводить до утворення гелю, розчин реагенту попередньо охолоджували на льоду перед додаванням ініціатора або зшивального агента, а також зменшували концентрацію ініціатора для уповільнення самої полімеризації . Макропористий гель утворюється після розморожування. Морфологія гелю залежала від швидкості охолодження та геометрії гелю. Коли гель готували в чашці Петрі, зануреній у охолоджуючу етанольну ванну, заморожування починається на дні посуду, де швидко утворюються дрібні кристалики льоду, в результаті чого утворюються менші пори середнього розміру 30 мкм (рис. 2А, внизу). Остигання було повільнішим у верхній частині зразка, залишаючи більше часу для росту кристалів льоду, що призводить до утворення більших пор 76 мкм (рис. 2А, вгорі). Розмір вибірки становив лише кілька (приблизно 2) міліметрів. Тому не дивно, що збільшення розміру зразка призведе до більшого градієнта температури в зразку та великих коливань морфології гелю.
(A) Конфокальна лазерна скануюча мікроскопія (CLSM) зображення перерізу желатинового гідрогелю, приготовленого в чашці Петрі. Заморожування починалося з дна чашки Петрі, де утворювалися дрібні пори, тоді як більші пори утворювались при контакті з повітрям (зверху). Шкала шкали становить 500 мм. (B) Температурні профілі, виміряні в зразках кріогелю HEMA: а) чотири різні зразки по 5 мл, б) та в) зразок 100 мл, підготовлений за допомогою звичайного методу; і г) 100 мл зразка після попереднього заморожування.
Температурні профілі: заморожування великих обсягів
Метод попереднього заморожування
Полі (2-гідроксиетилметакрилат-поліетиленгліколь), pHEMA, гель циліндричної форми (400 мл), виготовлений звичайним (ліворуч) та способом попереднього заморожування (праворуч) (a) та його перерізи (b) - звичайний, (c) - попереднє заморожування), (d) показує поперечний переріз конфокальної лазерної скануючої мікроскопії зображення звичайного гелю, тоді як (e) показує скануючу електронну мікроскопію зображень гелю, виготовленого методом попереднього заморожування, (f) показує розподіл пор за розміром у трьох частинах гелів: верхній, середній та нижній.
Подвійна пористість у гелях pHEMA, приготованих методом попереднього заморожування
СЕМ-зображення кріогелю pHEMA, виготовленого за допомогою звичайних методів та методів попереднього заморожування, та криогелю поліакриламіду (pAAm), виготовленого методом попереднього заморожування (морфологія гелю pAAm, приготованого звичайним методом, була подібною, дані не наведені).
Композити
Поліакриламідні кріогелеві композити. (a) з наночастинками α-Fe2O3 (20 нм) та (b) з гранулами з активованим вугіллям (250–500 мм), виготовленими звичайним методом (ліва пробірка) і виготовленими попереднім заморожуванням суспензії перед початком полімеризації (права пробірка). Поліакриламідний кріогелевий композит з вуглецевими нанотрубками (c) та його переріз (d). Колона α-Fe2O3-AAm, виготовлена методом попереднього заморожування (об'єм 140 мл) і звичайним способом (об'єм 1 мл) (e). Адсорбція As (III) колоною 4 та 140 мл (f). Розподіл пор за розміром (g). Див. Текст для обговорення.
Потенційне застосування для очищення води
Композитну колонку (140 мл), завантажену наночастинками заліза α-Fe2O3, готували із застосуванням методу попереднього заморожування для наскрізного нанесення (рис. 5д). Колонку тестували на адсорбцію As (III) з водного розчину і порівнювали з колоною об'ємом 4 мл, приготовленою звичайним методом. Колонку об’ємом 4 мл отримували шляхом складання разом 4 шматочків 1 мл гелю. Маленькі шматочки кріогелю (1 мл) готували для підтримки рівномірного розподілу наночастинок. Розчин 10 мг/л As (III) прокачували через колонку зі швидкістю потоку 10 мл/хв. Профіль прориву для колонки 4 мл (швидкість потоку 4 мл/хв) та колонки 140 мл (швидкість потоку 10 мл/хв) демонструє ефективне збільшення масштабу процесу адсорбції з використанням великої колони, виготовленої попередньо метод заморожування (рис. 5f).
Обговорення
Схематичне зображення процесу заморожування: охолодження починається при температурі A, а розчин переохолоджується до B. При B зародження починається, а температура піднімається до C (температура замерзання, Tf). Кристалізація і концентрація розчиненої речовини в незамерзлій рідині триває до D, - цільової температури.
Методи
Підготовка гелю
Листи желатинового гідрогелю (G-гелю) готували у скляній формі. Глютаральдегід (3% об./Мас.) Додавали до розчину желатину (6% об./Мас.). Розчин поміщали в скляну форму і заморожували в охолоджувальній камері Julabo при -12 ° C протягом 20 годин. Потім його розморозили і промили надлишком води. 2-гідроксиетилметакрилатні гелі отримували розчиненням 2-гідроксиетилметакрилату (HEMA, Acros Organic, 98%) та полі (етиленгліколь) діакрилату (PEGDA, Aldrich, Mn
258) у воді (6 мас./Об.% Розчину, молярне співвідношення HEMA: PEGDA 8: 1). Реакційну суміш дегазували при низькому тиску протягом 25 хвилин для усунення розчиненого кисню перед гелеутворенням. Звичайним способом суміш охолоджували до 0 ° C протягом 15 хв, а потім додавали N, N, N ', N'-тетраметил-етилендіамін (TEMED, Fisher Scientific, 99%) та персульфат амонію (APS, 98%) і суміші дали повністю замерзнути. У способі попереднього заморожування суміш охолоджували при постійному перемішуванні в етанольній охолоджувальній ванні при -18 ° C. Після утворення кристалів льоду суміш попередньо охолоджували до −2 ° C при постійному перемішуванні. Додавали N, N, N ′, N′-тетраметил-етилендіамін (TEMED, Fisher Scientific, 99%) та персульфат амонію (APS, 98%), і суміші дозволяли повністю заморозитися. Заморожену суміш витримували при -18 ° C протягом 20 годин, а потім розморожували при кімнатній температурі.
Композитний препарат
Гелевий аналіз
Адсорбція As (III)
Як (III) розчин готували за методикою, описаною в 21. Розчин As (III), 10 мг/л, рН 7,0, перекачували через 4 мл або 140 мл композиції AAm - α-Fe2O3. Збирали фракцію 10 мл. Концентрацію As (III) вимірювали за допомогою Perkin Elmer Optima ТМ 2100 DV ICP-OES система.
Додаткова інформація
Як цитувати цю статтю: Савіна, І. Н. та ін. Простий спосіб виробництва великих 3D макропористих гідрогелів для сучасних біотехнологічних, медичних та екологічних застосувань. Наук. Респ. 6, 21154; doi: 10.1038/srep21154 (2016).
Список літератури
Чен, Б. та співавт. Відновлення пошкодження спинного мозку імплантацією bfgf-включеного гідрогелю hema-moetacl щурам. Наук. Rep.5 (2015).
Лі, М. К., Річ, М. Х., Баек, К., Лі, Дж. І Конг, Х. Біоінспірована настройка залежності проникності-жорсткості гідрогелю для тривимірної культури клітин. Наук. Rep.5 (2015).
Ванг, З. та ін. Вивчення природного шовкового білка серицин для регенеративної медицини: ін’єкційний, фотолюмінесцентний, клейовий 3D-гідрогель. Наук. Реп.4 (2014).
Маттіассон, Б., Кумар, А. та Галеаєв, І. Ю. Макропорозні полімери: виробничі властивості та біотехнологічні/біомедичні застосування. CRC Press, 2009.
Гунько, В. М., Савіна, І. Н. та Михаловський, С. В. Кріогелі: морфологічна, структурна та адсорбційна характеристика. Адв. Збірник Інтерф. Наук. 187, 1–46 (2013).
Лозинський, В. І. та ін. Полімерні кріогелі як перспективні матеріали, що представляють біотехнологічний інтерес. ТЕНДЕНЦІЇ в біотехнології 21, 445–451 (2003).
Плієва, Ф. М., Галаєв, І. Ю. та Маттіассон, Б. Макропорозні гелі, приготовані при мінусовій температурі, як нові матеріали для хроматографії рідин, що містять тверді частинки, та застосування культурі клітин. J. Sep. Sci. 30, 1657–1671 (2007).
Савіна, І. Н. та ін. Пориста структура та стан води у зшитих полімерних та білкових кріогідрогелях. М'яка матерія. 7 (9), 4276–4283 (2011).
Gyarmati, B. et al. Надмакропористі хімічно зшиті гідрогелі полі (аспарагінової кислоти). Acta Biomaterialia (2015).
Дайняк, М. Б., Кумар, А., Галаєв, І. Ю. та Маттіассон, Б. Методи поділу клітин. У розділі клітин (за ред. Маттіассона, Б. та ін.) 1–18 (Springer, 2007)
Ertürk, G. & Mattiasson, B. Cryogels - універсальні інструменти для біосепарації J. Chromatog. 1357, 24–35 (2014).
Інгавле, Г. С. та співавт. Спорідненість зв'язування антитіл із супермакропористими адсорбентами кріогелів з іммобілізованим білком А для видалення захисного антигену сибірської виразки. Біоматеріали 50, 140–153 (2015).
Кумар, А. та Шрівастава, А. Поділ клітин за допомогою афінної хроматографії на основі кріогелю. Природні протоколи 5, 1737–1747 (2010).
Ноппе, В. та ін. Макропорозні монолітні гелі, кріогелі, з іммобілізованими фагами з бібліотеки фагових дисплеїв як нова платформа для швидкого розвитку спорідненого адсорбенту, здатного захоплювати ціль із сирих кормів. J. Біотехнол. 131, 293–299 (2007).
Bölgen, N. et al. 3D вростання суглобових хондроцитів великої рогатої худоби в біологічно розкладаються кріогелеві риштування для інженерії хрящової тканини. J. Tissue Eng. Відновити. Мед. 5, 770–779 (2011).
Inci, I., Kirsebom, H., Galaev, I. Y., Mattiasson, B. & Piskin, E. Желатинові кріогелі, зшиті окисленим декстраном і містять свіжоутворений гідроксиапатит як потенційні будівельні ліси кісткової тканини. J. Tissue Eng. Відновити. Мед. 7, 584–588 (2013).
Sharma, A., Bhat, S., Vishnoi, T., Nayak, V. & Kumar, A. Тривимірна супермакропориста матриця кріогелю з карагенан-желатину для тканинної інженерії. BioMed. Рез. Міжнародний (2013).
Бурова, Т. В. та ін. Термореактивний кополімерний кріогель, що володіє молекулярною пам’яттю: синтез, енергетика колапсу та взаємодія з лігандами. Макромол. Хім. Фіз. 212, 72–80 (2011).
Peniche, H. та співавт. Термочутливі макропористі кріогелі, функціоналізовані біоактивними наночастинками хітозану/беміпарину. Макромол. Biosci. 13, 1556–1567 (2013).
Шевченко, Р. В. та ін. в пробірці характеристика желатинової риштування, підготовлена кріогелюванням та оцінена в природних умовах як замінник шкіри при відновленні рани. Acta biomaterialia 10, 3156–3166 (2014).
Савіна, І. Н. та ін. Високоефективне видалення розчиненого As (III) з використанням макропористих полімерних композитів, що містять наночастинки заліза. Дж. Хаз. Мат. 192, 1002–1008 (2011).
Гаджизаде, С., Кірсебом, Х., Галаєв, І. Ю. та Маттіассон, Б. Оцінка селективного композиційного кріогелю для видалення броматів з питної води. J. Sep. Sci. 33, 1752–1759 (2010).
Ле Нуар, М., Плієва, Ф. М. і Маттіассон, Б. Видалення з води сполук, що руйнують ендокринну систему, за допомогою макропористих молекулярно відбитих кріогелів у реакторі з рухомим шаром. J. Sep. Sci. 32, 1471–1479 (2009).
Jain, E. & Kumar, A. Одноразова полімерна матриця біореактора кріогеля для терапевтичного виробництва білка. Природні протоколи 8, 821–835 (2013).
Bansal, V., Roychoudhury, P. K., Mattiasson, B. & Kumar, A. Відновлення урокінази з інтегрованого біореактора культури клітин ссавців та очищення ферменту за допомогою афінної хроматографії з п-амінобензамідином. J. Mol. Розпізнати. 19, 332–339 (2006).
Bölgen, N. et al. Тривимірне вростання кісткових клітин у біодеградуючі кріогелеві риштування в біореакторах при різних режимах. Тканинна інженерія, частина A 14, 1743–1750 (2008).
Гутьєррес, М. С., Феррер, М. Л. та дель Монте, Ф. Матеріали з льодовим шаблоном: Складні конструкції, що демонструють розширені функціональні можливості, отримані після однонаправленого заморожування та хімічної хімії, викликаної сегрегацією льоду. Матер. 20, 634–648 (2008).
Qian, L. & Zhang, H. Контрольоване заморожування та сублімаційне сушіння: універсальний шлях для пористих та мікро-/наноструктурованих матеріалів. J. Chem. Тех. Біотехнологія. 86, 172–184 (2011).
Önnby, L. et al. Нанокомпозитні адсорбенти на основі γ-Al2O3 для видалення миш'яку (v): Оцінка продуктивності, токсичності та витоку частинок. Наук. Загальне оточення 473, 207–214 (2014).
Сандеман, С. Р. та ін. Адсорбція аніонних та катіонних барвників активованими вугіллями, гідрогелями PVA та композитом PVA/AC. Дж. Колл. Інтерф. Наук. 358, 582–592 (2011).
Подяка
Цю роботу підтримали проекти FP7: PERG08-GA-2010-276954 (BioSmart), PEOPLE-2013-IAPP-612250 (WasClean) та PEOPLE-2011-IAPP-286089 (OncoNanoBBB). Автори вдячні Protista Biotechnology AB (www.protista.se) за доступ до матеріалів та технології монолітної пористої полімерної структури (MPPS®).
Інформація про автора
Приналежності
Школа фармації та біомолекулярних наук, Університет Брайтона, Будинок Хакслі, Льюїс-Роуд, BN2 4GJ, Брайтон, Великобританія
Ірина Н. Савіна, Ганеш Ч. Інгавле та Сергій В. Михаловський
Школа навколишнього середовища та технологій, Університет Брайтона, Коккрофт-Білдінг, Льюїс-Роуд, BN2 4GJ, Брайтон, Великобританія
Інженерна школа Назарбаєвського університету, 010000, Астана, Казахстан
Сергій Васильович Михаловський
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
І.С. та С.М. розробив оригінальне дослідження. І.С. та Г.І. здійснив синтез, характеристику, проаналізував дані та склав рукопис. І.С., Г.І., С.М. та А.К. обговорили результати та їх застосування/наслідки та прокоментували рукопис. Усі автори переглянули рукопис.
Декларації про етику
Конкуруючі інтереси
Автори заявляють про відсутність конкуруючих фінансових інтересів.
- Простий, ефективний та економічний метод отримання хитозану на основі йоду перець чилі
- Простий, але гладкий спосіб транспортування аварійного застуди та чаю від грипу; Свіжі укуси щодня
- 8 простих порад, щоб розпочати подорож для схуднення на 50 фунтів
- 3 прості вправи для гімнастичного кільця, які допоможуть будь-кому побудувати більше м’язів
- 8 простих порад щодо того, як виглядати вищим та стрункішим у своєму одязі - стиль Шеллі Голден