Простий, ефективний та економічний спосіб отримання їстівної тонкої плівки читозану на основі перцю чилі
Нунтіча Лімчоовонг
1 Науково-дослідний центр хімії матеріалів, Департамент хімії та Центр вдосконалення інновацій у хімії, Факультет природничих наук, Університет Хон Каен, 123 Mittraphab Road, M. 16, T. Ni-Muang, A. Muang, Khon Kaen, 40002 Таїланд
Фітчан Срічароен
1 Науково-дослідний центр хімії матеріалів, Департамент хімії та Центр вдосконалення інновацій у хімії, Факультет природничих наук, Університет Хон Каен, 123 Mittraphab Road, M. 16, T. Ni-Muang, A. Muang, Khon Kaen, 40002 Таїланд
Монгколь Конкаян
1 Науково-дослідний центр хімії матеріалів, Департамент хімії та Центр вдосконалення інновацій у хімії, Факультет природничих наук, Університет Хон Каен, 123 Mittraphab Road, M. 16, T. Ni-Muang, A. Muang, Khon Kaen, 40002 Таїланд
Сучіла Техавонгстієн
2 Кафедра рослинництва та сільськогосподарських ресурсів, сільськогосподарський факультет, Університет Хон Каен, Хон Каен, 40002 Таїланд
Саксіт Чантай
1 Науково-дослідний центр хімії матеріалів, Департамент хімії та Центр вдосконалення інновацій у хімії, Факультет природничих наук, Університет Хон Каен, 123 Mittraphab Road, M. 16, T. Ni-Muang, A. Muang, Khon Kaen, 40002 Таїланд
Анотація
Дане дослідження було спрямоване на розробку йодної добавки у вигляді їстівної плівки з покритого йодатом хітозану (CS-IO3). Включення отриманих таким чином плівок у дієту може допомогти у запобіганні раку щитовидної залози, що призведе до поліпшення здоров'я населення. Перець чилі покривали йодатною тонкою плівкою (1,5 мкм). Плівка, багата йодатом, готова до вживання, подаючи цінні поживні речовини. Дослідження стабільності плівки CS-IO3 з використанням занурення у воду показали, що не відбулося вимивання йодат-іону через сильну взаємодію між катіонною аміногрупою хітозану та йодат-іоном. Фільм не показав змін в його антиоксидантній активності. Концентрацію йодату в плівці визначали селективно при 620 нм, виходячи з економічного методу знебарвлення малахітового зеленого. Вміст йодату в плодах, покритих 1,5% (мас./Об.) CS-IO3, становило 11,5 мг г -1 зразка сухої плівки. Зразки, багаті йодатом, можна зберігати без особливого впливу на його свіжість, що свідчить про хороший термін зберігання.
Вступ
Йод є важливим мікроелементом мікроелементом, вирішальним для правильного функціонування щитовидної залози і необхідним для синтезу гормонів щитовидної залози (тироксину та трийодтироніну) (Judprasong et al. 2016). У разі дефіциту йоду щитовидна залоза не здатна синтезувати ці гормони в достатній кількості. Таким чином, відсутність достатньої кількості йоду може призвести до розладів йододефіциту (ІДЗ) (Ajith et al. 2015). Найвідоміший з ІДЗ - це «зоб», який передбачає збільшення щитовидної залози. Іншим важливим ІРС, хоча і рідкісним явищем, є рак щитовидної залози (Leufroy et al. 2015). Це спричиняє серйозну загрозу здоров’ю населення, яка зачіпає понад 260 мільйонів людей у всьому світі (Yang et al. 2007). Тому необхідно отримувати достатню кількість йоду з різної їжі.
У цьому контексті їстівні покриття традиційно використовуються для модифікації харчових продуктів. Такі їстівні покриття допомагають зберегти якість, а також вони вважаються екологічно чистими. Як вже повідомлялося, плівки з рослинних матеріалів мають потенційне застосування. Сінгх та ін. (2009a) вивчали вплив йоду на властивості плівок і преципітатів зеїну з метою оцінки системи як можливої протимікробної пов'язки на рани. Вони також оцінили вплив йоду на структурні характеристики (за допомогою інфрачервоної спектроскопії та рентгенівського випромінювання) плівок, виготовлених із крохмалю квасолі (Singh et al. 2009b).
Наскільки нам відомо, немає звітів про використання хітозану, функціоналізованого з йодатним покриттям, як харчової добавки для плодів перцю чилі. Здається, попит зростає з кожним днем як на місцевих, так і на міжнародних ринках. У той же час дослідження ринків та споживчих звичок показує, що зростає попит на готові до вживання харчові продукти з додатковими поживними речовинами через їх привабливі особливості, такі як зручність та харчова цінність. У цьому документі ми повідомляємо про оцінку їстівної тонкої плівки на основі CS-IO3 як нового альтернативного покриття для харчових продуктів. Для попередньої обробки зразків використовували ультразвукову екстракцію, а вміст йодату в плівці CS-IO3 визначали за допомогою абсорбційної спектрофотометрії на основі малахітового зеленого.
Матеріали і методи
Хімічні речовини та реактиви
Всі використовувані хімічні речовини та розчинники мали аналітичний реагент, і всі розчини готували в деіонізованій воді (Milli Q Millipore 18,2 МОм см-1 питомого опору) від Millipore Corporation (США). Хитозан шкаралупи креветок (> 75% ступінь деацетилювання) 2,2-дифеніл-1-пікрилгідразил (DPPH), катехін та малахітовий зелений (MG) придбані у Sigma-Aldrich (Японія). Льодова оцтова кислота, сірчана кислота, йодид калію, ацетат натрію, карбонат натрію та йодат калію були придбані у компанії QRec ™ (Нова Зеландія). Реагент Folin – Ciocalteu був отриманий компанією Merck (США). Розчин MG готували в деіонізованій воді в концентрації 36,5 мг L -1 і розбавляли до позначки в мірній колбі об'ємом 50 мл з деіонізованою водою.
Фруктовий матеріал
Перець чилі (рід Capsicum) був придбаний на місцевому ринку свіжих продуктів у місті Хон Каен, Таїланд. Всього було відібрано 105 перців чилі на основі певних критеріїв, таких як однорідність розміру (2,48 ± 0,32 г на плід), наявність червоного оцвітини, відсутність фізичних пошкоджень та грибкової інфекції. Вони були розділені на дві групи; один покритий чистим хітозаном, а інший CS-IO3. Ефекти лікування перевіряли раз на тиждень. Вплив оцінювали шляхом оцінки зразків за такими параметрами: втрата ваги, консистенція плодів, антиоксидантна активність та загальна кількість фенольних сполук.
Рецептура їстівної плівки
Розчин хітозану готували розчиненням 0,5 або 1,5 г порошку хітозану в 100 мл 1% (об./Об.) Оцтової кислоти з подальшою гомогенізацією на магнітній мішалці протягом 30 хв. Суміші обробляли протягом ночі при кімнатній температурі для видалення бульбашок повітря. Отриманий розчин хітозану фільтрували для видалення нерозчинених частинок. Після фільтрування плівку відливали, виливаючи розчин на чашки Петрі і сушивши його в умовах навколишнього середовища, поки не утворюється тонка плівка. Плівки відклеювали від посуду для аналізу. Всі експерименти проводились у трьох примірниках.
Розчин хітозан-йодат готували шляхом розчинення порошку хітозану в 100 мл 1% (об./Об.) Оцтової кислоти при безперервному перемішуванні. Згодом додавали йодат калію (KIO3) (100 мг L -1) при безперервному перемішуванні. Отриманий розчин декантували в чашку Петрі і залишали сушитися в умовах навколишнього середовища, отримуючи покриту йодатом плівку хітозану (CS-IO3).
Багате йодатом перець чилі на основі перцю чилі
Плоди перцю чилі були випадковим чином розподілені на п'ять груп. Чотири групи використовувались для обробки CS-йодатом та розчином CS для вивчення плівкового покриття, тоді як решта повинна була бути необробленою як контрольна група. Кожна з процедур включала занурення плодів у розчини різної концентрації (приблизно 1 хв) наступним чином: (a) 0,5% CS; (b) 0,5% CS-IO3; (c) 1,5% CS; і (d) 1,5% CS-IO3. Після повторного занурення в кожен з розчинів плодам давали висохнути на повітрі і поміщали на піддон при температурі навколишнього середовища. Для аналізу використовували по 75 плодів з кожної групи, а експеримент проводили у трьох примірниках. Дані послідовно реєстрували протягом наступних 4 тижнів.
Екстракція за допомогою ультразвуку
Відомо, що ультразвукова екстракція (ОАЕ) дозволяє виділити цільові аналіти за короткий проміжок часу через умови роботи, що включають атмосферний тиск і кімнатну температуру (Sricharoen et al. 2017a). Таким чином, ОАЕ було обрано для вилучення йодатів. Спочатку йодат-хітозановий композит (0,3 мл розчину та 0,0050 г плівки) точно зважували та екстрагували деіонізованою водою ультразвуком протягом 5 хв при 35 кГц (Sonorex Digitec DT 510 H, Банделін, Німеччина) для вилучення цільовий аналіт (Limchoowong et al. 2017). Після обробки ультразвуком отриманий екстракт відокремлювали від решти твердих матеріалів за допомогою центрифугування при 5000 об/хв протягом 5 хв. Для повторного аналізу аналітичних параметрів методу екстракції використовували три повторення кожного альтернативного зразка та заготівлі.
Аналітичні процедури
Концентрацію йодату визначали спектрофотометричним методом, заснованим на знебарвленні розчину малахітового зеленого (MG) (Konkayan et al. 2016). 1 мл стандартного розчину або екстракту зразка змішували з 40 мг L-1 розчину йодиду та 1 мл 2 моль L -1 сульфатної кислоти, а потім реакційну суміш обережно струшували до появи жовтого кольору. Потім додавали 1,4 мл 36,5 мг L -1 малахітового зеленого, потім додавали 2 мл 2 моль L -1 ацетату натрію і розводили до 10 мл деіонізованою водою. Приблизно через 5 хв поглинання реакційного розчину реєстрували при 620 нм.
Фізичні властивості плівки хітозану з йодатним покриттям
Розчинність зразка плівки у воді
Розчини йодату (100 мг L -1) та хітозану в слабокислому середовищі змішували разом із перемішуванням протягом 30 хв і витримували при температурі навколишнього середовища протягом 24 год для видалення бульбашок повітря. Потім його рівномірно виливали на пластиковий лист. Суміш сушили при кімнатній температурі до утворення плівки, а потім отриману плівку відшаровували для аналізу. Висушені плівки з йодатним покриттям (0,3 мл) занурювали у 5 мл дистильованої води при 25 ° С на 0,5, 1, 5, 10 та 30 хв відповідно. Потім вміст йодату у цьому водному екстракті визначали спектрофотометрично при 620 нм, як зазначено вище. Після ретельного розділення нерозчинної плівки зразки відокремленої плівки сушили при кімнатній температурі. Екстракцію йодату висушеної плівки з йодатним покриттям також проводили в 5 мл деіонізованої води з ОАЕ протягом 5 хв. Також визначали йодатний екстракт. Всі експерименти проводились у трьох примірниках.
Визначення втрати ваги перцю чилі
Усі зразки перцю чилі, отримані під час кожної обробки, були точно зважені за допомогою аналітичних ваг (Сарторіус, Німеччина) на початку експерименту, відразу після нанесення покриття та сушіння на повітрі. Ці зразки зберігали при кімнатній температурі протягом 4 тижнів і виймали для зважування щотижня. Результат розраховували і виражали у відсотках втрати ваги згідно з наступним рівнянням. (1):
де WL% - відсоток втрати ваги, Wi - початкова вага зразка в грамах, а Wf - кінцева вага зразка в грамах на зазначений час.
Стійкість розчину йодат-хітозану та тонкої плівки
Дослідження стійкості також проводили на йодатів, що містять плівки хітозану. Необхідна для цього хітозанова плівка готувалася наступним чином. Порошок хітозану (0,5 або 1,5 г) розчиняли у 100 мл оцтової кислоти при перемішуванні при кімнатній температурі. Потім додавали йодат калію (100 мг L -1) і перемішували гомогенно. Для отримання плівки гомогенний розчин хітозану виливали в чашку Петрі і залишали сушитися. Потім розчин легованого йодатом хітозану та його плівку оцінювали на основі поглинання знебарвлення MG при 620 нм. Результати збирали протягом 4 тижнів при температурі навколишнього середовища.
Антиоксидантна активність за допомогою аналізу DPPH · вилучення радикалів та визначення загальних фенольних сполук
Активність поглинання вільних радикалів перцю чилі оцінювали на основі його активності під впливом стабільного вільного радикала 2,2-дифеніл-1-пікрилгідразилу (DPPH ·). Антиоксидантну активність екстракту оцінювали за допомогою радикального аналізу DPPH (Sricharoen et al. 2017b). Аліквоту 100 мкл стандартного розчину або центрифугованого екстракту змішували з 900 мкл 0,1 мМ DPPH в етанолі. Поки етанол використовували як контроль, розчин DPPH використовували як заготовку. Суміш енергійно струшували, гомогенізували і витримували протягом 30 хв у темряві. Всі вимірювання проводились при слабкому світлі. Поглинання вимірювали при 517 нм. Для кожної проби було проведено три незалежних вимірювання. Нижчий рівень поглинання реакційної суміші вказував на вищу активність знешкодження вільних радикалів. Активність очищення DPPH · розраховували, використовуючи наступне рівняння. (2):
де, Acontrol - поглинання контрольної реакції, яка містить усі інші реагенти, за винятком стандарту або зразка, а Asample - поглинання в присутності стандарту або зразка.
Загальний вміст фенолу як у екстракті, так і в антиоксидантному рівні визначали за допомогою аналізу Фоліна – Чіокальтеу з використанням (+) - катехіну як стандартного еталону (Sricharoen et al. 2015). Аліквоту 100 мкл екстракту зразка або стандартний розчин (+) - катехіну (20–50 мг L -1) змішували з 500 мкл 10% реагенту Фолін – Ціокальтеу. Через 3 хв додавали 400 мкл Na2CO3 (7,5% мас./Об.) І суміш інкубували в темряві при кімнатній температурі протягом 30 хв. Поглинання проти заготовки реагенту вимірювали спектрофотометрично при 765 нм. Загальний вміст поліфенолу виражали у міліграмах (+) - еквіваленту катехіну на грам сухої ваги (мг КТР/г СН).
Результати і обговорення
Морфологія та товщина плівки хітозану
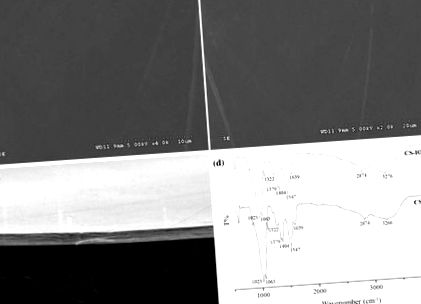
Морфологію та товщину плівок хітозану спостерігали під скануючим електронним мікроскопом (SEM) (Hitachi S-3000 N, Японія). На рис. 1a, b представлена морфологія поверхні плівок хітозану з йодатом калію та без нього. Всі плівки хітозану були прозорими і мали гладку поверхню без будь-яких домішок твердої фази. Це підтверджує, що йодат був однорідно розподілений по плівках хітозану. Також виявлено, що поверхня покритої йодатом плівки хітозану є відносно гладкою без будь-якого бар’єру. Таким чином, його можна використовувати для покриття поверхні зразка без будь-яких візуально помітних нерівностей. Дослідження вимірювання товщини плівки (мікрометри) проводили на шести плівках на обробку співвідношення, і середнє вимірювання в п'яти різних точках для кожної плівки реєстрували за допомогою візуалізації SEM, як показано на рис. Середня товщина плівок становила близько 1,5 мкм. Дослідження товщини проводили як на чистих плівках CS, так і на плівках CS, що містять йодат.
Характеристика тонкої плівки. a SEM-зображення фільмів, підготовлених із 1,5% CS, b 1,5% CS-IO3, c товщина тонкої плівки і d Спектри FTIR тонкої плівки CS та CS-IO3
Спектроскопія FTIR
Властивість їстівної плівки
Таблиця 1 містить дані, отримані під час експериментів, проведених для вивчення ступеня втрати йодату з їстівних плівок. Видно, що в розчині за вказані інтервали часу не виявлено йодату. Таким чином, очевидно, що в цих їстівних тонких плівках існує сильна взаємодія між полімером хітозану та йодатом. Цей висновок додатково підтверджується тим фактом, що вміст йодату в тонкій плівці через 5 хв екстракції виявилося в діапазоні 96,2 ± 1,3–104,0 ± 1,6 мг L -1 .
Таблиця 1
Вплив часу занурення багатих йодатом їстівних тонких плівок на концентрацію IO3 після екстракції (n = 3)
- Простий, але гладкий спосіб транспортування аварійного застуди та чаю від грипу; Свіжі укуси щодня
- Простий спосіб виробництва великих 3D макропористих гідрогелів для вдосконалених технологій
- Бенджаміні, Гаврилов Проста процедура відбору вперед, заснована на контролі швидкості помилкових відкриттів
- 8 простих порад, щоб розпочати подорож для схуднення на 50 фунтів
- 3 прості вправи для гімнастичного кільця, які допоможуть будь-кому побудувати більше м’язів