Потенційна роль втручання системи сигналізації про меланокортин у надмірному збільшенні ваги, пов’язаному з деякими антиретровірусними препаратами у людей, які живуть з ВІЛ
Предмети
Анотація
Вплив деяких антиретровірусних препаратів, особливо комбінованої антиретровірусної терапії на основі інгібіторів перенесення ланцюгів інтегрази (INsTI), пов’язаний із збільшенням ваги у людей, які живуть з ВІЛ (ЛЖВ), що перевищує те, що було б явищем „повернення до здоров’я”. Незважаючи на той факт, що збільшення ваги та ожиріння є багатофакторними, загальним епідеміологічним зв'язком ЛЖВ є ІНТІ на основі КАРТИ. Тут ми постулюємо, що втручання в роботу меланокортинової системи (MCS), що функціонує INsTI, відіграє важливу роль у надлишку ваги та ожирінні ЛЖВ, подібно до порушень, спричинених мутаціями рецепторів меланокортину (MCR) у загальній популяції, та антипсихотичної терапії в психіатричній галузі. пацієнтів.
Антиретровірусні схеми, засновані на INsTI, є найбільш використовуваними в країнах з високим рівнем доходу [1]. DTG буде або вже включений до національних рекомендацій щодо лікування майже 60 країн із низьким та середнім рівнем доходу, і PEPFAR рекомендував ввести TDF/3TC/DTG у своїх головних країнах, що в 2021 році буде прийнято
15 мільйонів ЛЖВ [2]. Останнім часом застосування INsTI асоціюється із збільшенням ваги та клінічним ожирінням. ВООЗ визначає ожиріння як ненормальне або надмірне накопичення жиру, яке представляє ризик для здоров'я і в даний час являє собою епідемію, пов'язану зі зменшенням тривалості життя [3]. Широке використання режимів, заснованих на INsTI, може спричинити епідемію збільшення ваги та ожиріння при ЛЖВ, що призведе до перетину тяжкості ожиріння та ВІЛ.
Збільшення ваги, пов'язане з інгібітором перенесення ланцюга інтегрази
Ініціювання КАРТ зазвичай асоціюється із збільшенням ваги, яке приписується події “повернення до здоров’я”. Початок кошику до ери INsTI призвів до збільшення ваги в межах від 1,8 до 2,7 кг за один рік та 4,8 кг за 144 тижні [4]. Загалом, збільшення ваги, пов’язане з нижчою смертністю у пацієнтів із вагою або нормальною вагою, без користі для пацієнтів із надмірною вагою та ожирінням через збільшення частоти діабету та серцево-судинних захворювань [5]. Ключові клінічні випробування INsTI не повідомляли про зміни ваги, однак жирові субстанції ACTG 5247 та NEAT 01 вказували на більший приріст ваги, переважно у вісцеральній жировій тканині, у групах RAL [6]. У двох нещодавно відкритих, РКД в Африці, режими, засновані на DTG, асоціювались із значно вищим збільшенням ваги та клінічним ожирінням у порівнянні з режимом на основі ефавіренцу [7, 8]. Нещодавній зведений аналіз восьми РКД, спонсорованих Gilead, підтвердив зв'язок INsTI з вищим приростом ваги, ніж PI або NNRTI [9]. Перехід від режиму на основі ІП на режим ДТГ був пов’язаний із значно вищим збільшенням ваги через 48 тижнів [9].
Докази спостережних та когортних досліджень накопичуються з 2017 року, вказуючи на вплив INsTI як загальну ознаку [10]. В останньому CROI (Сіетл, березень 2019 р.), Тематична дискусійна сесія повідомила про докази надмірного збільшення ваги ЛЖВ, як починаючи, так і переходячи на ІНТТІ-засновану тележку [10]. Запропонована ієрархія набору ваги, пов’язана з INsTI, із застосуванням DTG та біктегравіру (BIC), пов’язаного з найбільшим збільшенням [9, 10]. Факторами, пов'язаними зі збільшенням ваги, були основи NRTI, головним чином, включаючи TAF, стать (більший приріст жінок), етнічну приналежність (вищий приріст чорношкірих), а також кількість вихідних CD4 та вірусне навантаження [9, 10]. Крім того, вплив TAF у наївних та пацієнтів, які переходять з TDF або на абакавір у пацієнтів, які переходять зі старого NRTI або TDF, пов’язаний із збільшенням ваги [9, 10].
Функція системи меланокортину: роль у збільшенні ваги та ожирінні
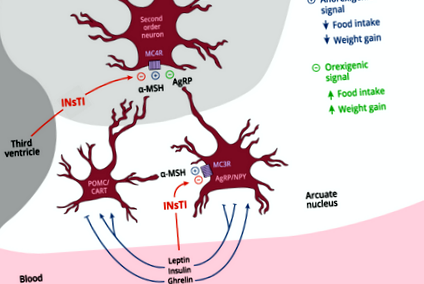
Система POMC/MC4R є найпотужнішим фізіологічним механізмом контролю поведінки споживання їжі та метаболічного енергетичного балансу у ссавців. Відомо, що зміни у функціонуванні цієї системи викликають ожиріння. ARC в гіпоталамусі містить нейрони POMC/CART, які експресують ген POMC і продукують α-MSH, який локально націлений на MC4R і MC3R і викликає стійку анорексигенну реакцію через інгібуючу дію на нейрони NPY, також в ARC, які є орексигенними, а також через дії на нейрони другого порядку (рис. 1). Природне інгібування MC4R через AgRP збільшує споживання їжі та сприяє відкладенню жиру. І навпаки, стимуляція MC4R α-MSH зменшує споживання їжі та сприяє периферичним витратам енергії, разом сприяючи загальному негативному енергетичному балансу [11]. Зовнішні сигнали, лептин та інсулін пригнічують споживання їжі та активізують синтез α-MSH для цільового MC4R, тоді як голодування призводить до гальмування сигналів α-MSH/MC4R, викликаючи почуття голоду (рис. 1).
Альфа-MSH, що виділяється нейронами гіпоталамусу POMC/CART, націлені на рецептори MC4R на нейронах другого порядку, викликаючи таким чином анорексигенну відповідь. α-MSH також діє на рецептори MC3R на нейронах AgRP/NPY гіпоталамусу. Це призводить до гальмування вивільнення орексигенних нейропептидів NPY та AgRP, цього останнього, здатного викликати орексигенез через перешкоджання сигналізації MC4R на нейронах другого порядку. Інсулін та лептин інгібують нейрони AgRP/NPY та активують нейрони POMC/CART, тоді як грелін робить зворотні ефекти. INsTI може потенційно впливати на дію α-MSH через MC4R і MC3R і тим самим спричиняти аномальний орексигенез та збільшення ваги. Інгібітор переносу ланцюга INsTI інтегрази, POMC/CART Проопіомеланокортин/кокаїн та амфетамін-регульований транскрипт, AgRP/NPY Агуті-пов’язаний білок/нейропептид Y, стимулюючий альфа-меланоцитарний гормон α-MSH, рецептор меланокортину-3, рецептор MC4R-меланокортин, MC4R-меланокортин.
Мутації MC4R спричиняють моногенне ожиріння, а діти, гетерозиготні чи гомозиготні щодо втрати функції мутантних алелів гена MC4R, розвивають ожиріння, що починається рано [12]. Виразний широкомасштабний аналіз досліджень асоціацій у цілому геному показав варіанти поліморфних генів MC4R, пов’язані із збільшенням ваги [12]. Фармакологічні активатори MC4R використовуються для лікування пацієнтів із ожирінням з генетичними дефектами MC4R, а нещодавно затверджені препарати від ожиріння (бупропіон та налтрексон) активують систему POMC [13]. І навпаки, антагоністи MC4R або зворотні агоністи для лікування анорексії спричиняють збільшення споживання їжі на моделях тварин [13].
Також може бути виявлено несправність MCS. Антипсихотичні засоби асоціюються із збільшенням ваги [14]. Оланзапін збільшував споживання їжі та масу тіла у самок щурів разом із збільшенням NPY та AgRP (орексигенних) та зниженням рівня мРНК POMC (анорексигенних) у ARC [14]. Грелін, орексигенний гормон, що виділяється із шлунку, сильно регулюється у самки щурів, які отримували лікування оланзапіном, що призводить до гіперфагії та збільшення ваги [14].
Дефіцитні дослідження досліджували функцію MCS у ЛЖВ. Рівень α-MSH у плазмі крові підвищений при ЛЖВ, особливо при запущеній інфекції [15]. NPY має вищу імунореактивність у лікворі та плазмі ЛЖВ порівняно з неінфікованими контролями [15]. Примітно, що in vitro DTG спричиняв пригнічення зв’язування α-MSH з MC4R на 64%. Примітно, що INsTI досягають терапевтичних концентрацій ліквору, а в області ARC відсутній гематоенцефалічний бар'єр [10].
Гіпотеза
Оскільки нинішня КАРТ часто включає комбінацію INsTI з двома NRTI, і оскільки надлишок ваги описаний переважно у пацієнтів, які зазнали INsTI, ми припускаємо, що INsTI відіграє вирішальну роль у патогенезі надмірної ваги або клінічного ожиріння у ЛЖВ, які зазнали дії цих препаратів . Ми припускаємо, що втручання INsTI в функцію MCS, що призводить до орексигенної відповіді, є відповідальним механізмом (рис. 1), викликаючи подібні порушення, що спостерігаються при мутаціях MC4R або антипсихотичній терапії [12, 14].
Принаймні чотири потенційні механізми можуть спричинити таку індукцію орексигенної відповіді за допомогою INsTI. Першим буде блокування MC4R (рис. 1). DTG, ст C.максимальна концентрація, інгібує зв'язування радіоактивно міченого α-MSH з MC4R на 64% [10]. Цей механізм інактивував би анорексигенний відділ системи меланокортину, викликаючи орексигенну відповідь. Прогнозування зв'язування INsTI з MC4R (структурна суперпозиція) походить від присутності галогензаміщеного кільця в селективних агоністах MC4R, що є спільною рисою DTG та біктегравіру (Gelpi JL, власні дані).
Другим механізмом було б регулювання регуляції секреції NPY, рецепторів NPY або обох, що призвело б до гіперактивації орексигенного плеча системи (рис. 1). Рівні NPY у плазмі та лікворі в ЛЖВ були підвищені щодо рівня неінфікованого контролю [15].
Третім механізмом може бути інгібування зв'язування α-MSH з MC3R нейронів NPY/AgRP, уникнення репресії NPY, спричинене α-MSH, і, таким чином, індукування поведінки годування [16].
Потенційним четвертим механізмом може бути периферична передача сигналів до нейронів POMC/CART та NPY за допомогою греліну або лептину або його рецепторів. Однак не існує жодних доказів відмінностей у рівнях цих сигналів у плазмі крові за відсутності метаболічних або жирових порушень у ЛЖВ, оброблених КАРТ [17].
NRTI може сприяти цьому процесу за допомогою додатково розкритих механізмів [9, 10]. Однак використання INsTI, мабуть, є суттєвим фактором, оскільки інші режими CART не були постійно пов'язані з надлишковою вагою. Надмірна вага та ожиріння при ЛЖВ є, як і серед населення, багатофакторним процесом, в якому INsTI та, можливо, NRTI відіграють шкідливу роль.
Перевірка гіпотези
Різні типи досліджень доповнюють цю гіпотезу. По-перше, перспективні клінічні дослідження повинні визначити та підтвердити клінічно значущий поріг того, наскільки значним є збільшення ваги у ЛЖВ, які отримують КАРТ. Потім цей поріг слід застосовувати до РКД та спостережних досліджень. Що стосується терапії з регулюванням ваги, FDA США вважає зниження ваги на 5% клінічно значущим [18]. І навпаки, якщо лікування збільшує вагу на 5% і більше, це теж може бути клінічно значущим. Внесок антиретровірусних препаратів, зокрема INsTI, у надлишкову надбавку ваги, подвійну сліпу РКД слід уточнити шляхом прямого порівняння препарату, пов'язаного із збільшенням ваги, та іншого з відомими нейтральними ефектами. Потенційний внесок NRTI можна побачити у факторних проектах. Зміна РКТ може відображати не тільки відповідальність препарату, але й оборотність отриманого ожиріння. Ці дослідження повинні включати досліджувані за складом тіла, щоб визначити, чи узагальнене відкладення жиру, чи перевагу надає певному депо.
Піддослідження про функцію MCS в РКД, розглядаючи біомаркери плазми та ліквору, можуть бути яскравими. Необхідно вивчити внесок генетики, отримавши розуміння поліморфізмів MCR, пов’язаних із ожирінням [12]. На периферійному рівні слід визначати вплив INsTI на різні жирові депо. Специфічна тканинна фармакодинаміка кожного INsTI, швидше за все, буде різною, і, отже, може спричинити різні ефекти, якщо такі є, на різні типи клітин депо. Інвазивні процедури, такі як біопсія жирової тканини, мали б важливе значення для цієї мети [19].
По-друге, дослідження in vitro з використанням клітин мозку, що експресують MC4R та MC3R, оцінюватимуть автономно для клітин потенційне втручання INsTI та інших антиретровірусних препаратів на дії, опосередковані α-MSH. Дослідження людських адипоцитів in vitro доповнювали б зразки ex vivo та досліджували будь-які потенційні периферичні ефекти INsTI та інших антиретровірусних препаратів на диференціацію, метаболічні та секреторні функції людських адипоцитів у суворо контрольованому середовищі [20].
По-третє, дослідження на тваринах виграють від можливості проведення більш інвазивних досліджень, що стосуються досліджень на людях. Дослідження повинні визначити ефекти мишей, які отримували різні ІНТС. Можуть застосовуватися різні моделі мишей, починаючи від моделей посиленого ожиріння шляхом впливу обезогенних дієт до трансгенних мишей, що виражають частину геному ВІЛ, що має ознаки середовища, асоційованого з ВІЛ, in vivo [21]. Вживання їжі, вага тіла, придбання ожиріння та схема витрат енергії на моделях тварин у відповідь на INsTI можуть бути здійснені за допомогою комплексної системи клітин моніторингу. Моделі тварин будуть висвітлювальними завдяки необмеженому доступу до крові, жирових депо, мозку та гіпоталамусу для з'ясування функціонального стану MCS.
Список літератури
Панель з антиретровірусних рекомендацій для дорослих та підлітків. Вказівки щодо використання антиретровірусних засобів у дорослих та підлітків з ВІЛ. Департамент охорони здоров'я та соціальних служб. http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf. Доступ 8 травня 2019 р.
Vitoria M, Hill A, Ford N, Doherty M, Clayden P, Venter F, et al. Перехід на долютегравір та інші нові антиретровірусні препарати в країнах з низьким та середнім рівнем доходу: які проблеми? СНІД. 2018; 32: 1551–61.
Блюхер Т. Ожиріння: глобальна епідеміологія та патогенез. Nat Rev Ендокринол. 2019; 15: 288–98.
Erlandson KM, Taejaroenkul S, Smeaton L, Gupta A, Singini IL, Lama JR та ін. Рандомізоване порівняння антропоморфних змін із переважними та альтернативними антиретровірусними схемами на основі ефавіренцу в різних багатонаціональних умовах. Відкрити форум Infect Dis. 2015; 2: ofv095.
Achhra AC, Mocroft A, Reiss P, Sabin C, Ryom L, de Wit S та ін. Короткочасний набір ваги після початку антиретровірусної терапії та подальший ризик серцево-судинних захворювань та діабету: дослідження D: A: D. ВІЛ Мед. 2016; 17: 255–68.
Bernardino I, Mocroft A, Wallet C, de Wit S, Katlama C, Reiss P, et al. Склад тіла та адипокіни змінюються після початкового лікування дарунавіром-ритонавіром плюс ралтегравір або тенофовір дизопроксил фумарат-емтрицитабін: піддослідження рандомізованого дослідження NEAT001/ANRS 143. PLOS ONE. 2019; 14: e0209911.
Дослідницька група NAMSAL ANRS 12313, Kouanfack C, Mpoudi-Etame M, Omgba Bassega P, Eymard-Duvernay S, Leroy S, et al. Схема для лікування ВІЛ-1 на основі долютегравіру або низьких доз ефавіренцу. N Engl J Med. 2019; 381: 816–26.
Venter WDF, Moorhouse M, Sokhela S, Fairlie L, Mashabane N, Masenya M, et al. Долутегравір плюс два різні проліки тенофовіру для лікування ВІЛ. N Engl J Med. 2019; 381: 803–15.
Sax PE, Erlandson KM, Lake JE, McComsey GA, Orkin C, Esser S, et al. Збільшення ваги після початку антиретровірусної терапії: фактори ризику в рандомізованих порівняльних клінічних дослідженнях. Clin Infect Dis. 2019 пій: ciz999. https://doi.org/10.1093/cid/ciz999.
Hill A, Waters L, Pozniak A. Чи збільшують нові антиретровірусні методи лікування ризики клінічного ожиріння? J Вірус Ерад. 2019; 5: 41–3.
Voss-Andreae A, Murphy JG, Ellacott KT, Stuart RC, Nillni EA, Cone RD, et al. Роль центральної схеми меланокортину в адаптивному термогенезі бурої жирової тканини. Ендокринологія. 2007; 148: 1550–60.
Loos RJ, Lindgren CM, Li S, Wheeler E, Zhao JH, Prokopenko I, et al. Поширені варіанти поблизу MC4R пов'язані з масою жиру, вагою та ризиком ожиріння. Nat Genet. 2008; 40: 768–75.
Флемінг К.А., Еріксон М.Д., Фрімен К.Т., Аданк Д.Н., Лунцер М.М., Вільбер С.Л. та ін. Дослідження взаємозв’язків між структурою та активністю макроциклічного AGRP-міметичного помосту c [Pro-Arg-Phe-Phe-Asn-Ala-Phe-DPro] дають потужні та селективні антагоністи рецепторів меланокортину-4 та зворотні агоністи рецепторів меланокортину-5, що збільшують споживання їжі у мишей. ACS Chem Neurosci. 2018; 9: 1141–51.
Dent R, Blackmore A, Peterson J, Habib R, Kay GP, Gervais A, et al. Зміни маси тіла та психотропних препаратів: систематичний синтез літератури. PLOS ONE. 2012; 7: e36889.
Malessa R, Heimbach M, Brockmeyer NH, Hengge U, Rascher W, Michel MC. Підвищена нейропептидна Y-подібна імунореактивність у спинномозковій рідині та плазмі пацієнтів, інфікованих вірусом імунодефіциту людини: взаємозв'язок з енцефалопатією ВІЛ. J Neurol Sci. 1996; 136: 154–8.
Girardet C, Marks DL, Butler AA. Рецептори меланокортину-3, експресовані на пов'язаних з агюті пептидними нейронами, інгібують поведінку годування у самок мишей. Ожиріння. 2018; 26: 1849–55.
McFarlane SI, Mielke MM, Uglialoro A, Keating SM, Holman S, Minkoff H, et al. Грелін, амілін, шлунковий інгібуючий пептид та когніція у ВІЛ-інфікованих та неінфікованих жінок середнього віку: міжвідомче дослідження жінок щодо ВІЛ. J Нейрол Нейрофізіол. 2017; 8: 413.
Управління з контролю за продуктами та ліками (США). Керівництво для промисловості. Розробка продуктів для управління вагою. 2007. www.fda.gov/downloads/Drugs/Guidances/ucm071612.pdf. Доступ у квітні 2019 року.
Domingo P, Gutierrez M del M, Gallego-Escuredo JM, Torres F, Mateo MG, Villarroya J, et al. Проведено 48-тижневе дослідження молекулярних змін жиру у пацієнтів, які не отримували ВІЛ, починаючи тенофовір/емтрицитабін з лопінавіром/ритонавіром або ефавіренцом. J Acquir Імунодефіцитний синдром. 2014; 66: 457–65.
Moure R, Domingo P, Gallego-Escuredo JM, Villarroya J, Gutierrez M del M, Mateo MG, et al. Вплив ельвітегравіру на адипоцити людини: зміни в диференціації, експресії генів та вивільненні адипокінів та цитокінів. Антивірусна Рез. 2016; 132: 59–65.
Вільярроя Дж., Діас-Дельфін Дж., Хійнк Д, Домінго Р, Гіральт М, Клотман ПЕ та ін. Експресія трансгену ВІЛ-1 у мишей змінює рівень жирової тканини та адипокіну: назустріч моделі грипозної ліподистрофії ВІЛ-1 на гризунах. Противірусна термо. 2010; 15: 1021–8.
Фінансування
Ця робота частково фінансується Фондом розслідування санаторіїв (FIS PI13/0796, PI14/0700, PI14/0063, PI016/0503, PI17/0420 та PI17/0498), Ministerio de Sanidad, Politica Social e Igualdad (EC11-293 ), та Програма підтримання груп обговорення AGAUR (2014 SGR 250, 2017 SGR 948).
Інформація про автора
Приналежності
Департамент інфекційних хвороб, лікарня Санта-Кре-і-Сан-Пау, Інститут лікарні Санта-Кре-і-Сан-Пау, Барселона, Іспанія
Департамент біохіміки і біомедицини і молекулярний інститут (IBUB), Університет Барселони, CIBER Fisiopatología de la Obesidad y Nutrición, Барселона, Іспанія
Франческо Вільярроя, Марта Жиральт та Джоан Карлес Домінго
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
Усі автори беруть участь у розробці гіпотези. Усі автори координували та контролювали розробку та перевірку гіпотези. Усі автори брали участь в інтерпретації даних. Статтю склали всі автори. Усі автори надали інформацію до звіту та затвердили остаточну версію статті.
Відповідний автор
Декларації про етику
Конфлікт інтересів
Автори заявляють, що у них немає конфлікту інтересів.
Додаткова інформація
Примітка видавця Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Огляд Запобігання надлишкової ваги Керівництво NICE
- Ожиріння та надмірна вага мозку можуть пришвидшити старіння мозку; Поради щодо запобігання ожиріння
- Нове дослідження показує, що вживання органічної їжі насправді може запобігти збільшенню ваги Інституту відповідальності
- Споживання оливкової олії та збільшення ваги - ScienceDirect
- Медичні та пов’язані зі здоров’ям причини незрозумілої форми збільшення ваги