Поняття про травлення та засвоєння основних поживних речовин у людини
Відділ основних біомедичних наук, медичний факультет Санфорда, Університет Південної Дакоти, Вермільон, Південна Дакота
Адреса для запитів на передрук та іншої кореспонденції: Барбара Е. Гудман, Санфордська медична школа, Університет. Південної Дакоти, вул. Е. Кларка, 414, Вермільон, SD 57069 (електронна пошта: [електронна пошта захищена]).
Анотація
викладачі курсів фізіології перед студентами можуть регулярно призначати студентам таке запитання: «Умійте детально описувати етапи у всьому шлунково-кишковому тракті ссавців (ШКТ) для перетравлення та всмоктування ОДНОЇ з трьох поживних груп». Іншими словами, розкажіть, як розщеплюються вуглеводи, білки АБО жири (в яких органах і якими ферментами), а потім опишіть, як всмоктуються кінцеві продукти розпаду (як вони потрапляють в клітини епітелію кишечника, перетинають клітину і як вони виходять) клітини, включаючи те, чи потрапляють вони в кров або лімфатичну систему). Інформація, представлена в класі, зазвичай має 10 основних етапів перетравлення та повного засвоєння кожної основної групи поживних речовин. Діаграми, знайдені в більшості підручників з фізіології студентів, мають на меті чітко пояснити студентам деталі цих кроків.
Викладачі з медичної біохімії для студентів першого курсу медицини можуть читати лекції на тему: “Перетравлення та всмоктування вуглеводів/білків/жирів”. У той час як підручники з фізіології для студентів, як правило, розглядають деталі перетравлення різних поживних речовин (що таке ферменти та як вони працюють), підручники з медичної біохімії схильні до деталей про транспортери, необхідні для засвоєння продуктів розпаду поживні речовини та доля поживних речовин в організмі. Крім того, з кінця 1970-х років з’ясовано багато деталей щодо травлення та транспортування. Виявлено нові транспортери (такі як транспортери Н + -олігопептиду та транспортери жирних кислот). Ця оглядова стаття має на меті висвітлити ідеї вивчення травлення, всмоктування та транспорту вуглеводів, білків та ліпідів. Описи та схеми орієнтовані на аудиторію викладачів фізіології, які хочуть зрозуміти деталі біохімії травлення та фізіології транспорту епітелію поживних компонентів. Окрім того, описано кілька клінічних наслідків дефектних процесів для надання відповідних прикладів студентам медичної кар’єри.
Перетравлення та всмоктування вуглеводів
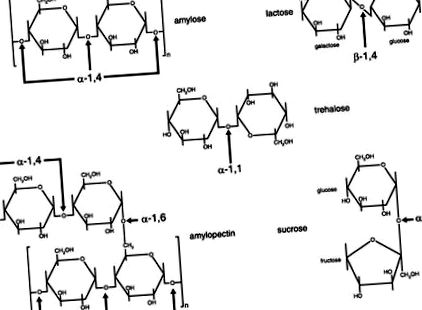
Рис. 1.Діаграми структур зв’язків між вуглеводними залишками в дієтичних дисахаридах та полісахаридах. Цукри пов'язані за допомогою глікозидних зв'язків між вуглецем одного цукру та гідроксильною групою іншого. Зв’язок може бути або α, або β, залежно від його положення над або під площиною цукру. [Змінено з посилання 6.]
Усередині тонкої кишки панкреатичний сік потрапляє в просвіт через гепатопанкреатичний сфінктер (сфінктер Одді), і його висока концентрація бікарбонату починає нейтралізувати шлункову кислоту. Одночасно α-амілаза підшлункової залози досягає просвіту і активно продовжує розщеплювати складні вуглеводи на мальтозу, мальтотріозу (ізомальтозу), трисахариди, більші олігосахариди та α-граничні декстрини (олігосахариди з точками відгалуження) (9). Оскільки ди-, три- та олігосахариди є результатом гідролізу крохмалю α-амілазою, необхідне додаткове перетравлення, перш ніж може відбутися поглинання продуктів розпаду моносахаридів крохмалю. Ці продукти гідролізу крохмалю повинні бути додатково розщеплені за допомогою дисахаридаз, що знаходяться як ферменти, що охоплюють мембрану, у плазматичних мембранах кистей кордону кишкових епітеліальних клітин (ентероцитів) (4). У таблиці 1 наведено підсумок основних вуглеводів, що містяться в їжі, з їх типовими джерелами, хімічними зв’язками, необхідними ферментами мембранної щітки та кінцевими продуктами моносахаридів.
Таблиця 1. Джерела вуглеводів, типи глікозидних зв’язків, мембранні ферменти та продукти моносахаридів
[Змінено з посилання 6.]
Іншим ферментом мембранної мембрани є трегалаза, яка гідролізує глікозидний зв’язок у трегалозі, невеликому дисахариді, незвичному в американській дієті (9). Трегалоза міститься в комах, водоростях, молодих грибах та інших грибах і може спричинити шлунково-кишковий дистрес, якщо людина споживає її без належної кількості трегалази (1). Неперетравлена трегалоза, що надходить у товсту кишку, також спричиняє осмотичний градієнт, що веде до рідкого стільця та діареї з наступним перетравленням трегалози мікрофлорою в товстій кишці, утворюючи гази (зокрема водень та метан, що з’являються у видихуваному повітрі) (1). Трегалаза коротша за інші дисахаридази і має лише одне каталітичне місце для гідролізу зв'язку α-1,1 між молекулами глюкози в трегалозі. Досі незрозуміло, наскільки мінливою може бути активність трегалази дванадцятипалої кишки у людській популяції; однак дослідження з ескімосами в Гренландії та з людьми у Фінляндії виявили як самопроголошених осіб, які не переносять грибів, так і дефіцит трегалази (1).
Α-амілаза підшлункової залози діє здебільшого в дванадцятипалій кишці незабаром після її потрапляння через гепатопанкреатичний сфінктер і утворює мальтозу, мальтотріозу та α-граничні декстрини із складних вуглеводів (6). Сукраза-ізомальтаза та β-глікозидаза мають високий розподіл та активність у проксимальній частині тонкої кишки, тоді як глюкоамілаза має найвищу активність у проксимальній частині клубової кишки (9). Таким чином, просторовий розподіл цих дисахаридаз (незначна активність у дванадцятипалій та дистальній частині клубової кишки та відсутність у товстій кишці) максимізує їх активність для координації з сегментами тонкої кишки, де переважають транспортери глюкози (4). Таким чином, ці дисахаридази сприяють явищу, відомому як перетравлення мембрани, і забезпечують моносахариди для всмоктування через епітеліальні клітини.
Як тільки моносахариди є результатом перетравлення вуглеводів α-амілазою та ферментами мембранної мембрани, моносахариди поглинаються ентероцитами через специфічні транспортні білки, що полегшують транспорт d-ізомерів (але не l-ізомерів) гексоз (4). d -Глюкоза та d -галактоза поглинаються сполученим з Na + вторинним активним транспортним симпортером, відомим як транспортер Na + -глюкози 1 (SGLT1). SGLT1 є високоафінним транспортером Na + -глюкози з 12 трансмембранними α-спіральними доменами та 662 амінокислотними залишками масою ~ 74 кДа (15). Його Кm для транспортування цукру є функцією концентрації Na +, а його стехіометрія становить 2 Na + для кожної молекули d -глюкози (15). За відсутності Na + d -глюкоза зв'язується з SGLT1 з набагато меншим спорідненістю (глюкоза Кm >> 10 мМ), але у присутності Na + конформаційна зміна дозволяє цукру зв'язуватися з високою спорідненістю (глюкоза ККонцентрація m + низька (~ 10 мМ), Na + дисоціює від місця його зв'язування, внаслідок чого спорідненість транспортера до d -глюкози зменшується, а цукор виділяється в цитоплазму клітини. Транспортер повинен завершити свій цикл, здійснивши третій, набагато повільніший перехід, щоб переорієнтувати місця зв'язування на позаклітинну поверхню (15).
Таким чином, SGLT1 використовує градієнт Na + (тобто низьку внутрішньоклітинну концентрацію Na +), який створюється базолатеральними Na +, K + -ATPases для введення гексоз в ентероцити. Оскільки SGLT1 переміщує 2 Na + з кожною d -глюкозою, він здатний генерувати градієнт концентрації глюкози в просвіті мембрани в 10 000 разів (3). Згодом d -глюкоза може залишити клітину на базолатеральній стороні клітини за допомогою полегшених дифузійних транспортерів (транспортерів глюкози (GLUT2s)) від високої концентрації всередині клітини до низької концентрації поза клітини (4). GLUT - це цілісні мембранні транспортні білки, складені в 12 трансмембранних α-спіралей, які утворюють центральний водний канал для переміщення субстрату (d -глюкози, d -галактози або фруктози) через ліпідний бішар. З п’яти оригінальних GLUT лише GLUT2 і GLUT5 здатні транспортувати фруктозу, а GLUT5 має дуже обмежену здатність транспортувати d -глюкозу (12). GLUT2 відрізняються тим, що є транспортною системою з низьким спорідненістю і великим товарообігом із системою Км в ооцитах 11 мМ. GLUT2 містяться в кишкових і ниркових базолатеральних мембранах (переважно), в печінці та в β-клітинах підшлункової залози і опосередковують поглинання та витікання глюкози, галактози або фруктози (12).
Однак фруктоза не транспортується SGLT1, а навпаки, поглинається на межі щітки ентероцитом за допомогою специфічного полегшеного дифузійного транспортера GLUT5. GLUT5 демонструють найслабшу гомологію з іншими членами сімейства GLUT усіх GLUT і служать в основному як транспортери фруктози з Км 6 мМ (12). Вони знаходяться в мембранах тканин, що метаболізують фруктозу, включаючи мембрани кишкових мембран клітин кишечника та мембран сперми. Вони, ймовірно, є основним шляхом вживання харчової фруктози в тонкому кишечнику. Внутрішньоклітинне перетворення фруктози в глюкозу та молочну кислоту підтримує низьку внутрішньоклітинну концентрацію, сприяючи її подальшому всмоктуванню завдяки полегшеній дифузії з просвіту. Оскільки кров, що прилягає до епітеліальних клітин кишечника, безперервно виводить цукри, які перетинають цілі ентероцити, глюкозу, галактозу та будь-яку інтактну фруктозу, яка легко виходить з клітин за їх градієнтами концентрації за допомогою полегшеної дифузії GLUT2 без використання клітинної енергії. На малюнку 2 представлена узагальнююча діаграма етапів, що беруть участь у перетравленні та всмоктуванні вуглеводів.
Рис.2.Короткий огляд основних етапів, пов'язаних з перетравленням та всмоктуванням вуглеводів за допомогою важливих ферментів та транспортерів. Етапи детальніше пояснюються в тексті. SGLT1, транспортер Na + -глюкози 1; КЛЮК, транспортер глюкози. [Змінено з посилання 13.]
Клінічний приклад.
Глюкозо-галактозна мальабсорбція є рідкісним генетичним захворюванням, при якому пацієнт має дефектну кишкову d -глюкозу та d -галактозу (15). Це проявляється як початок важкої водянистої діареї у новонароджених, яка може призвести до смерті, якщо не відновити водно-електролітний баланс. Повне видалення глюкози, галактози та лактози з раціону зупиняє діарею протягом 1 години. Молекулярні дослідження показали, що множинні мутації SGLT1 призводять до мальабсорбції глюкози-галактози в тонкому кишечнику; однак у тих пацієнтів з низькою здатністю засвоювати глюкозу відсутня глікозурія (глюкоза в сечі), оскільки епітеліальні клітини проксимальних канальців нирки (на відміну від ентероцитів із лише SGLT1 у здорових осіб) використовують як SGLT1, так і SGLT2 для поглинання глюкози у фільтраті. (4) і SGLT2 не мутується одночасно.
Перетравлення та всмоктування білків
Загальне добове навантаження білками становить ~ 70–100 г дієтичного білка та 35–200 г ендогенних білків, включаючи травні ферменти та мертві клітини (6). Для розщеплення харчових білків на амінокислоти та дрібні пептиди необхідні різноманітні протеолітичні ферменти, оскільки кожен фермент має специфічність для різних типів пептидних зв’язків. Ендопептидази атакують певні внутрішні зв’язки і призводять до великих поліпептидів, тоді як екзопептидази відщеплюють по одній амінокислоті від карбоксильного або амінокінцевого кінця поліпептиду або білка.
Споживані білки або поліпептиди починають розщеплюватися в шлунку під дією протеази пепсину (4). Пепсин секретується головними клітинами слизової шлунка як пепсиноген, більша неактивна форма ферменту, також відома як зимоген. Шлункова кислота (HCl, що виділяється пристінковими клітинами) змінює конформацію пепсиногену, щоб вона могла розщепитися і стати активним пепсином у шлунку. Шлункова кислота також денатурує білки, що частково розгортає їх, завдяки чому протеази мають кращий доступ до своїх пептидних зв’язків. Пепсин (ендопептидаза) у шлунку починає гідролізувати білки в різних точках розщеплення до менших поліпептидів (6). Пепсин має вищу специфічність для розщеплення пептидних зв’язків, в яких карбоксильна група забезпечується ароматичними амінокислотами, такими як тирозин, фенілаланін, триптофан та лейцин (6). Хоча пепсин може частково перетравлювати 10–15% харчового білка в шлунку, гідроліз пепсину не є необхідним для виживання (пацієнти живуть із повною гастректомією) (4).
Коли хімус (частково перетравлена їжа) потрапляє в тонкий кишечник, ферменти протеази підшлункової залози виводяться через гепатопанкреатичний сфінктер разом з бікарбонатом підшлункової залози. Бікарбонат починає нейтралізувати шлункову кислоту і підвищує рН до більш оптимального рівня для активності протеаз підшлункової залози. Усі протеази підшлункової залози виділяються як зимогени, щоб не активізуватися, перебуваючи всередині підшлункової залози, і, таким чином, викликати панкреатит. Трипсиноген зимогену розщеплюється з утворенням трипсину за допомогою ентеропептидази (раніше відомої як ентерокіназа), ферменту порожнини кишечника, який вивільняється під дією жовчних солей (9). Потім трипсин каталізує розщеплення інших зимогенів до їх активних форм. Протеази підшлункової залози (трипсин, хімотрипсин, еластаза та карбоксипептидази) розщеплюють поліпептиди до олігопептидів та амінокислот (табл. 2). Трипсин, хімотрипсин та еластаза є сериновими протеазами та діють як ендопептидази (9). Трипсин є найбільш специфічним і розщеплює пептидні зв’язки поруч з лізином або аргініном. Хімотрипсин менш специфічний і розщеплює пептидні зв’язки, прилеглі до гідрофобних амінокислот. Еластаза розщеплює еластин і пептидні зв’язки, суміжні з аланіном, гліцином та серином.
Таблиця 2. Характеристика шлункової, інстистінальної та підшлункової пептидаз
- Як перейти до малюків; Дошкільнята до палео дієти; Походження Освіта
- Освіта в галузі охорони здоров’я - ядро 6 класу
- Освіта в галузі охорони здоров’я - ядро 3-го класу
- Медичне виховання Техаське освітнє агентство
- Освіта в галузі охорони здоров’я - Ядро 5 класу