Підхід до біодеградації поліетилену низької щільності методом Bacillus amyloliquefaciens
Анотація
Поліетилен низької щільності (ПВД) є основною причиною стійкого та довгострокового забруднення навколишнього середовища. У цій роботі два бактеріальних ізоляти Bacillus amyloliquefaciens (BSM-1) та Bacillus amyloliquefaciens (BSM-2) були виділені з твердого муніципального ґрунту та використані для досліджень деградації полімерів. Мікробна деградація LDPE була проаналізована шляхом сухого зменшення ваги плівки LDPE, зміни рН культурального середовища, оцінки CO2, скануючої електронної мікроскопії (SEM) та інфрачервоної FTIR-спектроскопії поверхні плівки з перетворенням Фур'є. SEM-аналіз показав, що обидва штами демонстрували прихильність та ріст за допомогою ПВД, який використовувався як єдине джерело вуглецю, тоді як зображення FTIR показували різні хімічні зміни поверхні після 60 днів інкубації. Бактеріальні ізоляти показали деполімеризацію продуктів біологічного розкладу у позаклітинних середовищах, що вказує на процес біологічного розкладання. BSM-2 демонстрував кращу деградацію, ніж BSM-1, що доводить потенціал цих штамів деградувати плівки LDPE за короткий проміжок часу.
Вступ
Поліетилен низької щільності (ПВД) - широко застосовуваний не біологічно розкладається термопластик. Для вирішення цієї екологічної проблеми, пов’язаної з небіодеградуючими термопластиками, великий інтерес представляють дослідження модифікації небіодеградуючих термопластів на біологічно розкладаються матеріали (Zheng et al. 2005). Крім того, ці синтетичні полімери зазвичай не піддаються біологічному розкладанню, поки вони не розкладаються на фрагменти з низькою молекулярною масою, які можуть засвоюватися мікроорганізмами (Френсіс та ін., 2010).
Матеріали і методи
Попередня обробка та приготування порошку з ПВД
Поліетилен низької щільності (LDPE) був отриманий від B.N. Полімери, Бангалор, Індія. Плівки ПВД розрізали на дрібні шматочки, занурили в ксилол і кип'ятили протягом 15 хв з подальшим подрібненням блендером при 3000 об/хв. Як отриманий порошок ПЕНЩ додатково промивали етанолом, сушили протягом ночі в духовій шафі з гарячим повітрям при 60 ° C і зберігали при кімнатній температурі для подальшого використання.
Поліетилен, що руйнує бактерії та умови культивування
Бактерії, використані в цьому дослідженні, B. amyloliquefaciens (BSM-1) (номер приєднання GenBank № KC924446) та B. amyloliquefaciens (BSM-2) (номер приєднання GenBank № KC924447) (Das and Kumar 2013), були виділені із зони звалища твердих побутових відходів, Паллікаранаі (12.9377N/80.2153E, 7 м над рівнем моря), Ченнаї, Індія та підтримуються на поживний агар при 4 ° С. Бактерії, що руйнують полімер, були ідентифіковані за допомогою синтетичних середовищ, доповнених 0,3% порошком ПВД. Склад синтетичного середовища був таким: (г/л: K2HPO4, 1; KH2PO4, 0,2; (NH4) 2SO4, 1; MgSO4 · 7H2O, 0,5; NaCl, 1; FeSO4 · 7H2O, 0,01; CaCl2 · 2H2O, 0,002; MnSO4 · H2O, 0,001; CuSO4 · 5H2O, 0,001; ZnSO4 · 7H2O, 0,001; агар 15; pH 7,0).
Дослідження біодеградації
Тести на біологічне розкладання проводили з 3 г зразків плівок ПВД (1,5 × 1,5 см), які сушили протягом ночі при 60 ° C, зважували, знезаражували (30 хв у 70% етанолі), сушили на повітрі протягом 15 хв у камері повітряного потоку Laminar і додавали в колби Ерленмейера, що містять 300 мл синтетичного середовища. Дослідження деградації LDPE проводили з використанням обох штамів бактерій окремо. Кожну колбу, інокульовану 3 мл 24 год старої культури (BSM-1 та BSM-2), вирощеної на середовищі, доповненому LDPE, використовували як інокуляти, щоб уникнути будь-якої пов'язаної фази тривалого відставання. Потім культури інкубували на роторному шейкері (Neolab Instruments) при 33,3 ° C і 130 об/хв протягом 60 днів. Кожен тест складався з трьох повторень.
Вимірювання біодеградації
Визначення зміни рН
Дослідження зміни рН було прийнято, щоб переконатись у будь-якій метаболічній активності штаму мікробів у середовищі, що містить добавки, оскільки метаболізм, показаний мікробними клітинами, може значною мірою підтвердити докази деградації. Під час дослідження рН кожної бактеріальної суспензії вимірювали з інтервалом у 10 днів. Зонд рН вводили в бульйон для вимірювання рН. Вихідне значення середовища було забезпечено 7 ± 0,3 для обох штамів з використанням фосфатного буфера.
Визначення сухої маси залишкового полімеру
Для полегшення точного вимірювання ваги залишкового поліетилену листки поліетилену відновлювали через 60 днів інкубації і змивали бактеріальну біоплівку з поверхні полімеру 2% -ним (об/об) водним розчином додецилсульфату натрію протягом 4 год. (за допомогою шейкера), потім дистильованою водою і, нарешті, 70% етанолом, щоб забезпечити максимально можливе видалення клітин та сміття. Вимиті шматки полімеру поміщали на фільтрувальний папір і сушили протягом ночі при кімнатній температурі перед зважуванням.
Тест на виділення СО2
Був розроблений самомодифікований простий апарат, який складається з контрольних і випробувальних посудин, а в систему для аерації подавали стерильне повітря. Тут полімер, інкубований з мікробами, служив тестом, а полімер без мікробів - контролем. Після інкубації як метаболічний, так і атмосферний СО2 із досліджуваної посудини та атмосферний СО2 із контрольної посудини потрапляли в пастку та оцінювали, використовуючи “тест Штурма” (Sturm 1973) для кожного ізоляту.
Скануюча електронна мікроскопія (SEM)
Неочищені та оброблені зразки через 60 днів тривали СЕМ-аналіз (після промивання 2% (об./Об.) Водним SDS та дистильованою водою багаторазово шляхом легкого струшування протягом декількох хвилин і додатково промивали 70% етанолом з метою видалення клітин, щоб отримати максимальну поверхню, яку можна виставити для візуалізації. Зразки наклеювали на SEM Sample Stub за допомогою вуглецевої стрічки, а зразок покривали золотом протягом 40 с і аналізували під скануючим електронним мікроскопом з високою роздільною здатністю (JEOL, Model JSM -6390LV).
Аналіз FTIR
Інфрачервоні спектроскопічні дослідження з перетворенням Фур'є були проведені для контрольних та оброблених бактеріями плівок ПВД. Аналіз проводили за допомогою FTIR-спектроскопії Perkin-Elmer Spectrum-One в горизонтальному режимі з дисками броміду талію.
Результати і обговорення
Біорозкладаний пластик є сприятливим рішенням проблеми утилізації або накопичення пластику в природі. Оскільки побутові та промислові відходи містять величезну кількість поліетилену низької щільності, у цій роботі був зібраний зразок твердих побутових відходів для виділення мікроорганізмів, які виявили потужну біологічну деградацію. Бактеріальні ізоляти можуть рости в синтетичному середовищі, що доповнює LDPE, використовуючи LDPE як єдине джерело вуглецю та енергії. Ці спостереження свідчать про утворення та прикріплення біоплівки на плівці ПВД. Мікробна колонізація на поверхні полімеру є першою вимогою до його біодеградації (Yabannavar and Bartha 1993).
Дослідження біодеградації
Після інкубаційного періоду 60 днів погіршує здатність штамів Bacillus amyloliquefaciens (BSM-1) та Bacillus amyloliquefaciens (BSM-2) аналізували та інтерпретували з використанням різних параметрів.
Зміна рН
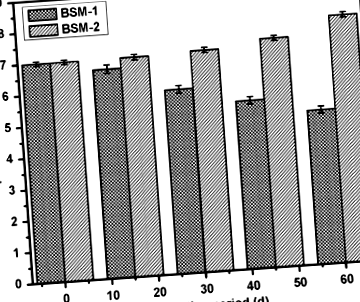
На малюнку 1 показано коливання рН обох суспензій бактерій під час та після біодеградації. Мікроорганізми виділяють у ґрунтову воду різноманітні ферменти, які починають розщеплення полімерів. У процесі беруть участь два типи ферментів, а саме внутрішньоклітинні та позаклітинні деполімерази. Екзоферменти з мікроорганізмів спочатку розщеплюють складні полімери, утворюючи короткі ланцюги або мономери, які є досить малими, щоб проникати крізь клітинні стінки, щоб використовуватись як джерела вуглецю та енергії в процесі деполімеризації (Dey et al. 2012). Ізоляти бактерій, BSM-1 та BSM-2 показали продукцію деяких ферментів та метаболітів із зазначенням зміни рН, що підтримує метаболічну активність штамів на субстраті ПВД, а також його деградацію.
Зміни рівня рН під час біодеградації внаслідок мікробної активності
Зниження ваги
Простий і швидкий спосіб виміряти біологічний розпад полімерів - це визначення втрати ваги. Мікроорганізми, що ростуть у полімері, призводять до збільшення ваги за рахунок накопичення, тоді як втрата цілісності полімеру веде до втрати ваги. Втрата ваги пропорційна площі поверхні, оскільки біодеградація зазвичай ініціюється на поверхні полімеру. Після періоду деградації плівки LDPE обробляли SDS як поверхнево-активна речовина, яка денатурировала клітини і повністю змивалась з поверхні. Зменшення ваги спостерігалося після біологічного розкладання ПЕНЩ (рис. 2).
Розкладання плівок LDPE (початкова вага: 30 мг з 1,5 × 1,5 см) на синтетичному середовищі, інокульованому штамом BSM-1 та BSM-2, інкубованому при 33,3 ° C протягом 60 днів
Оцінка рівня мінералізації
Тест Штурма - це метод, де деградація пояснюється кількістю метаболічного вуглекислого газу, що виділяється протягом періоду росту. Полімери складаються з вуглецевого ланцюга, і коли він розкладається через мікроби CO2 і H2O отримують як побічні продукти, процес називається мінералізацією, при якій полімер спочатку перетворюється в мономери, розриваючи ланки, а потім у більш прості сполуки, які асимілюються в живі клітини. Рівень СО2 розраховували за контролем (атмосферний СО2) та реакційній камері (атмосферний та метаболічний СО2) через 60 днів дослідження біодеградації. Теоретичне виділення вуглекислого газу для 3% ПНД було оцінено в 11 г/л для повного біологічного розкладання. Тут відсоток рівня біомінералізації ПЕНЩ через виділений вуглекислий газ з реакційних камер розраховували для штамів BSM-1 та BSM-2 шляхом порівняння з відповідними значеннями контрольних камер (табл. 1). Результат показує потенціал Bacillus amyloliquefaciens і підтверджує факт біологічного розкладу та біомінералізації цього небезпечного полімеру.
SEM-аналіз плівки LDPE
Хоча зміна рН, зниження ваги, рівень мінералізації та спектри поглинання дають вагомі докази біологічного розкладу полімерів, зміни поверхні плівок ПЕНШ були розкриті за допомогою SEM. Контрольний зразок має вигляд гладкої поверхні, що не має ямок, тріщин або будь-яких частинок, прикріплених на поверхні (рис. 3а). У разі плівки ПВД, обробленої бактеріальним ізолятом BSM-1, було встановлено, що кілька тріщин на поверхні розвинулися через 60 днів обробки. Одночасно на поверхні плівки також були помічені мікроби, що вказує на її сильну адгезійну здатність, а також здатність утилізації ПВД (рис. 3б). Плівка, оброблена бактеріальним ізолятом BSM-2, виявила, що бактеріальне прикріплення має більшу швидкість порівняно з BSM-1. Чіткі сліди деградації можна помітити в місцях, де спочатку мікроби були прикріплені разом з кишенями та ямками навколо (рис. 3в). Для обох штамів у різних місцях на поверхні можна спостерігати кілька колоній, що утворюють біоплівку.
SEM мікрофотографія плівки LDPE перед обробкою як контроль (a), Плівка LDPE після обробки BSM-1 (b), і плівка ПВД після обробки BSM-2 (c)
Аналіз FTIR
Спектри FTIR контролю (a), оброблений BSM-1 (b), і оброблений BSM-2 (c)
Висновок
Проблема забруднення пластиком нині є справді безладом для людства. Немає жодної частини світу, яка б не торкнулася його впливу. У сучасну епоху глобалізації необхідно зробити певний стрес для планування безпечного захоронення продуктів перед тим, як зробити його комерційним. Прискорення науки та забування іншого боку медалі призводять до таких умов. У цьому дослідженні два ізольованих штами Bacillus amyloliquefaciens було виявлено корисним для біодеградації, про яку вперше повідомляється з відповідними доказами. Цей підхід до біодеградації є безпечним та екологічно чистим. Результати показали багатообіцяючу надію на деградацію ПВД швидше, ніж на природну деградацію.
Список літератури
Albertsson AC, Andersson SO, Karlsson S (1987) Механізм біологічного розкладу поліетилену. Polym Degrad Stab 18: 73–87
Андради А.Л. (2011) Мікропластика в морському середовищі. Mar Pollut Bull 62: 1596–1605
Arboleda CE, Mejía AIG, López BLO (2004) Біодеградація полі (вінілалкоголу та коетилену) при напівтвердому бродінні шляхом Фанерохети хризоспоріум. Acta Farm Bonaer 23: 123–128
Das MP, Kumar S (2013) Вплив гідрофобності поверхні клітин у колонізації та утворенні біоплівки на біодеградацію ПВД. Int J Pharm Pharm Sci 5: 690–694
Dey U, Mondal NK, Das K, Dutta S (2012) Підхід до деградації полімерів через мікроби. IOSRPHR 2: 385–388
Drímal P, Hoffmann J, Družbík M (2007) Оцінка аеробного біологічного розкладу пластмас у ґрунтовому середовищі за допомогою ГХ та ІЧ-аналізу газової фази. Тест Polym 26: 729–741
Френсіс V, Рагул С.С., Саріта Г.Б., Ебі ТТ (2010) Дослідження мікробної деградації лінійних сумішей полі (етилен) -поліполіоліту (вінілового спирту) низької щільності із використанням Вібріон sp. Міжнародна конференція з досягнень полімерних технологій, с. 26–27
Gu JD, Ford TE, Mitton DB, Mitchell R (2000) Мікробна корозія металів. В: Revie W (ed) The Uhlig Corrosion Handbook, 2nd edn. Уайлі, Нью-Йорк, с. 915–927
Kiatkamjornwong S, Sonsuk M, Wittayapichet S, Prasassarakich P, Vejjanukroh PC (1999) Деградація стирол-g-маніокової крохмалю, заповненої полістироловими пластиками. Polym Degrad Stab 66: 323–335
Klrbas Z, Keskin N, Güner A (1999) Біодеградація полівінілхлориду (ПВХ) грибами білої гнилі. Bull Environ Contam Toxicol 63: 335–342
Sadocco P, Nocerino S, Dubini-Paglia E, Seves A, Elegir G (1997) Характеристика полі (3-гідроксибутират) деполімерази з Aureobacterium saperdae: активний центр та кінетика досліджень гідролізу. J Environment Polym Degrad 5: 57–65
Шах А.А., Хасан Ф., Хамід А, Ахмед С. (2008) Біологічна деградація пластмас: всебічний огляд. Біотех Adv 26: 246–265
Starnecker A, Menner M (1996) Оцінка біологічного розкладу пластмас в умовах стимульованого компостування в лабораторній випробувальній системі. Int Biodeter Biodegr 37: 85–92
Sturm RN (1973) Біорозкладність неіоногенних ПАР: скринінговий тест для прогнозування швидкості та кінцевої біодеградації. J Oil Chem Soc 50: 159–167
Swift G (1997) Немедичні біологічно розкладаються полімери: екологічно розкладаються полімери. В: Довідник біорозкладаних полімерів. Hardwood Academic, Амстердам, с. 473–511
Tokiwa Y, Calabia BP, Ugwu CU, Aiba S (2009) Біорозкладність пластмас. Int J Mol Sci 10: 3722–3742
Ябаннавар А, Барта Р (1993) Біорозкладність деяких харчових пакувальних матеріалів у ґрунті. Ilрунт Біол Біохім 25: 1469–1475
Zheng Y, Yanful EK, Bassi AS (2005) Огляд біодеградації пластикових відходів. Crit Rev Biotechnol 25: 243–250
Подяка
Автори висловлюють подяку Департаменту промислових біотехнологій Університету Бхарат, Ченнаї, за надання лабораторних приміщень.
Конфлікт інтересів
Автори цієї статті заявляють, що у них немає конфлікту інтересів.
Інформація про автора
Приналежності
Департамент промислових біотехнологій, Університет Бхарат, Ченнаї, 600073, Тамілнад, Індія
Меріна Пол Дас і Сантош Кумар
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Права та дозволи
Ця стаття опублікована за ліцензією BioMed Central Ltd.Відкритий доступ Ця стаття розповсюджується на умовах ліцензії Creative Commons Attribution, яка дозволяє будь-яке використання, розповсюдження та відтворення на будь-якому носії, за умови зарахування оригінальних авторів та джерела.
- Збалансований підхід до ін'єкцій епідуральних стероїдів
- Цілісний підхід до схуднення; доктор
- Аналіз рекомбінації на дріжджових теломерах SpringerLink
- Практичний підхід до здорової втрати жиру
- Підхід до вправ Boca Raton для схуднення HFWL