Підготовка обличчя до кровоносних судин миші
Kyung Ae Ko
1 Кафедра кардіології відділення внутрішньої медицини Техаського університету, Центр раку імені Андерсона
Кейгі Фудзівара
1 Кафедра кардіології відділення внутрішньої медицини Техаського університету, Центр раку імені Андерсона
Суніл Кришнан
2 Кафедра радіаційної онкології, Техаський університет, Центр раку імені М. Андерсона
Джун-ічі Абе
1 Кафедра кардіології відділення внутрішньої медицини Техаського університету, Центр раку імені Андерсона
Анотація
Зрізи вкладених у парафін тканин зазвичай використовуються для вивчення гістології тканин та гістопатології. Однак важко визначити, що таке тривимірна морфологія тканини за такими зрізами. Крім того, зрізи тканин, що досліджуються, можуть не містити області всередині тканини, необхідної для цілей поточного дослідження. Це останнє обмеження заважає гістопатологічним дослідженням судин, оскільки судинні ураження розвиваються фокалізовано. Для цього потрібен метод, який дозволяє нам оглянути широку ділянку стінки кровоносної судини, від її поверхні до глибших областей. Ця вимога виконує підготовку судин до судин. У цій статті ми продемонструємо, як виготовляти препарати для обличчя аорти та сонної артерії миші та імунофлуоресцентно фарбувати їх для конфокальної мікроскопії та інших типів візуалізації на основі флуоресценції.
Вступ
Препарати для цілого горіння (вимовляється як än ˈfäs) дозволяють нам оглянути широку ділянку поверхні кровоносних судин, таку як вся аорта, від кореня аорти аж до загальних клубових артерій. Використовуючи такий зразок, забарвлений специфічними антитілами та іншими специфічними зондами, можна точно визначити місце ураження, а також місце, де відбуваються різні молекулярні події в ендотеліальних клітинах у поєднанні з атерогенезом, такими як зміни експресії, локалізації та посттрансляційних модифікацій білків. На додаток до вивчення атерогенезу, форма ендотеліальних клітин, яка спостерігається в препаратах для обличчя, використовується як показник регіональної моделі середнього кровотоку, усередненої за часом. Такі дані важливі для вивчення механосигналізації ендотеліальних клітин in situ. Для цього рутинні гістологічні перерізи судин не є корисними. Таким чином, для судинної медицини та біології особливо важливо придбати техніку виготовлення препаратів для боротьби з кровоносними судинами, що дозволяє спостерігати як широку поверхню судини, так і глибші підводні ділянки судини.
У цій статті ми проілюструємо спосіб приготування препаратів для обличчя аорти миші та сонної артерії для імунофлуоресцентного фарбування. Підготовку до обличчя можна проводити навіть після експериментальних маніпуляцій з цими судинами. Наприклад, сонна артерія може бути частково перев’язана, а потім проведена підготовка до обличчя після такої операції. З цієї причини в цій статті ми також опишемо, як ми робимо часткове перев’язування сонної артерії. Порівняно із виготовленням подібних препаратів із більших тварин, таких як щури, кролики та людина, мишачі судини мають невеликі розміри та більш крихкі, що вимагає додаткової обережності при поводженні під час хірургічної ізоляції судин та підготовці їх до фарбування антитіл та мікроскопії. Оскільки найбільш часто використовуваною твариною моделлю для генетичної модифікації є миша, для багатьох дослідників стає критично важливо обробляти судини миші, не пошкоджуючи їх. У цьому рукописі ми опишемо, як обробляти кровоносні судини миші під час підготовки препаратів аорти та сонної артерії миші. З метою демонстрації ми будемо використовувати мишей дикого типу C57/b6.
Протокол
Протоколи часткової перев'язки сонної артерії миші та ізоляції аорти та сонної артерії миші для імунозабарвлення обличчя затверджені Інституційним комітетом з догляду та використання тварин (IBT 2014-9231).
1. Часткове лігування сонної артерії ліворуч
Підготуйте хірургічний простір, поклавши на стіл нагрівальну прокладку розміром 12 дюймів x 14 дюймів і накрийте подушку та стільницю великою чистою хірургічною драпіровкою. Відрегулюйте плече підставки стріли так, щоб поле зору стереомікроскопа було в центральній області нагрівальної площадки.
Увімкніть грільну панель на столі і встановіть регулятор з 3 налаштуваннями на середній рівень нагрівання. При такому встановленні температури поверхня хірургічної дошки (див. 1.6.1) становитиме 38-40 ° C.
Помістіть чисту клітку на іншу грілку. Увімкніть грілку, як зазначено вище. Ця клітка буде використовуватися для відновлення після операції (див. 1.16), а також житла.
На хірургічний стіл покладіть автоклавну стерилізаційну сумку, що містить ножиці райдужки (1 пара), щипці для тканини (1 пара), щипці для суперхватки (2 пари), пружинні ножиці (1 пара), тупий втягувач (1 пара; ширина 2,5 мм), голкотримач з круглою ручкою (1), стерилізований шовковий шов 6-0, аплікатори з бавовняними наконечниками, міні-бавовняні аплікатори, хірургічні портьєри та марлеві губки розміром 2 х 2 дюйма. Також поставте на хірургічний стіл пляшку для віджиму, що містить 70% етанолу, та іншу, що містить хлоргексидинову хірургічну скрубону.
Зважте мишку. Вага тіла необхідна для визначення відповідної кількості знеболення, яке буде введено безпосередньо перед операцією.
Помістіть мишку в індукційну камеру.
Увімкніть кисневий бак і випарник анестетика, щоб знеболити мишу в індукційній камері. Підтримуйте рівень ізофлурану на рівні 2%. Миша займає 3-5 хв.
Поки мишку знеболюють, підкладіть під стереомікроскоп менший шматок стерильної хірургічної драпіровки (24 дюйма х 24 дюйма), щоб створити хірургічну поверхню. Потім покладіть на драпіровану поверхню акрилову хірургічну дошку (яка була очищена 70% спиртом). Отже, хірургічна дошка повинна знаходитися на грільній панелі, але розділена двома шарами хірургічних портьєр.
Коли миша перестане рухатися в індукційній камері, переведіть мишу в зону дохірургічної підготовки та вставте ніс у конус носа, підключений до випарника (2% ізофлуран). Видаліть волосся навколо шийки матки за допомогою електричного тримера або лосьйону для видалення волосся. Ми рекомендуємо лосьйон для видалення волосся, оскільки цей метод не дасть розпущених шматочків волосся, які важко повністю видалити з хірургічної зони.
Помістивши конус носа на місце, перемістіть мишу до хірургічної дошки.
Закріпіть скотчем праву та ліву передні лапи до хірургічної дошки. Закріпіть скотчем обидві задні лапи з правого боку миші. Це спричиняє невелике обертання тіла миші, так що ліва сторона області шиї миші стає краще розташованою для операції.
Продезінфікуйте область розрізу 70% спиртом, хірургічним скрабом хлоргексидину і знову 70% спиртом. Накрийте мишу стерилізованою хірургічною драпіровкою, за винятком області розрізу шийки матки.
Підтвердіть пальцем ніг, що миша повністю знеболена, і дайте знеболення (капрофен 3-5 мг/кг) за допомогою внутрішньочеревної або підшкірної ін’єкції.
Під розсікаючим мікроскопом зробіть вентральний розріз середньої лінії навколо шийки матки за допомогою скальпеля або ножиць райдужки. ПРИМІТКА: Ми використовуємо ножиці, оскільки робоча відстань стереомікроскопа обмежена, що ускладнює використання скальпеля.
Оголіть ліву загальну сонну артерію (LCCA), відсунувши в бік і змінивши положення слинних залоз, які покривають кровоносні судини з лівого боку тварини.
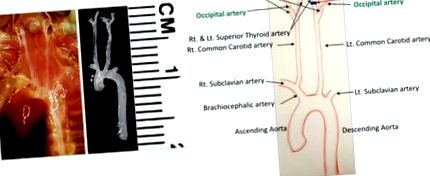
Визначте всі кровоносні судини в хірургічному полі (Фігура 1). LCCA роздвоюється у лівій внутрішній сонній артерії (ICA) та лівій зовнішній сонній артерії (ECA). Поверхнева тиреоїдна артерія (STA) виникає із ЕКА на медіальній стороні. Потилична артерія (ОА) зазвичай виникає з ЕКА, але у деяких мишей вона виникає з ВСА.
Лігуйте всі гілки артерій, крім ОА, за допомогою стерилізованого шовного шовного шва 6-0. Щоб досягти цього, зробіть наступні дві перев'язки.
Акуратно видаліть сполучну тканину навколо та під лівою внутрішньою сонною артерією (ВСА). Візьміть шматок нарізаного шовного шовного шва 6-0 (
2,5 см) за допомогою щипців і пропустити його під артерією. За допомогою іншої пари щипців витягніть шов приблизно на 1/3 його довжини і перев’яжіть артерію.
Видаліть сполучну тканину навколо лівої зовнішньої сонної артерії (ECA) таким же способом, як описано вище, і зробіть перев'язку проксимальніше лівої верхньої щитовидної артерії (STA) (Фігура 1). Будьте обережні, щоб не пошкодити нервові волокна, які проходять в межах хірургічного поля.
Коли ці перев’язки зроблені, поверніть слинні залози у вихідне положення та зволожите хірургічне поле, помістивши 2-3 краплі стерильного фізіологічного розчину. Закрийте шкіру, використовуючи 6-0 вікрилові шви.
Після операції помістіть мишу в попередньо розігріту клітку (див. 1.2.1). Миша повинна прокинутися протягом 5 хв і почати ходити. Після підтвердження того, що миша поводиться нормально, принесіть клітку до кімнати для тварин.
Спостерігайте за мишею щодня протягом перших 3 днів одужання. Мишу можна утримувати стільки, скільки вимагає експеримент, за різних умов, до яких вимагає експериментальний протокол. Підготовку до обличчя можна робити в будь-який час після операції.
2. En Immunostaining
Евтаназію миші CO2 шляхом передозування вдиханням.
Закріпіть стрічку миші в положенні лежачи (животом догори) на дошці для розсічення.
Оголіть черевну порожнину, зробивши серединний розріз ножицями райдужки.
Оголіть грудну порожнину, перерізавши ребра з боку до грудини.
Зробіть зазубрину в порожнистій вені або переріжте одну із стегнових артерій для зливу крові.
Вставте голку 26 г, прикріплену до гравітаційної перфузійної установки (тиск води 120 см), у верхівку лівого шлуночка та просочіть кровоносну систему сольовим розчином, що містить гепарин (40 ОД/мл). Продовжуйте перфузію, поки фізіологічний розчин, що витікає з порізу, не стане прозорим.
Переключіть систему перфузії з сольового розчину на фіксуючий розчин, що містить 4% параформальдегіду в PBS (сольовий розчин, забуференний фосфатом), і продовжуйте перфузувати ще 5 хв.
Зберіть аорту та ліву та праву сонну артерії за допомогою тупих ножиць та щипців та помістіть у конічну трубку об’ємом 50 мл, що містить фіксатор, на льоду.
Перенесіть посудину в чашку Петрі, що містить PBS, під розсікаючим мікроскопом і обережно видаліть жир і сполучні тканини, прикріплені до аорти та сонних артерій. Відокремте аорту та сонну артерію поздовжньо, щоб оголити ендотелій (Малюнок 2).
Перенесіть кожну посудину окремо в лунку 12-лункової пластини, що містить 0,5 мл пермеабілізуючого розчину (0,1% Triton X-100 у PBS) на лунку. Проникніть кровоносні судини протягом 10 хв з похитуванням при кімнатній температурі (RT).
Недовго вимити PBS.
Для блокування неспецифічних місць зв’язування антитіл інкубують кровоносні судини у 10% нормальній сироватці з видів тварин, у яких утворені вторинні антитіла, в TTBS (сольовий розчин, забуференний трис (TBS) з 2,5% Tween 20), протягом 30 хв з гойдання при RT.
Інкубуйте посудини з первинними антитілами, відповідним чином розведеними в TTBS, з 10% нормальною сироваткою крові (як описано вище) протягом ночі, гойдаючи при 4 ° C. Рівень розведення повинен бути визначений для кожного антитіла.
Виконайте наступне контрольне фарбування.
Інкубуйте судини з TTBS замість первинного антитіла з наступною інкубацією з вторинним антитілом.
Інкубуйте судини з TTBS, що містять неімунну (або доімунну) сироватку або Ig тієї ж тварини (виду), в якій були утворені первинні антитіла, з подальшою інкубацією з вторинним антитілом.
Опустіть інкубацію з вторинним антитілом. З цими контрольними зразками слід поводитися однаково і одночасно, коли проводиться фарбування специфічними антитілами.
Промийте кровоносні судини 3 рази TTBS протягом 10 хв кожною, колиючи при RT.
Інкубуйте з флуоресцентно міченими вторинними антитілами, розведеними відповідним чином у TTBS з 10% нормальною сироваткою (як описано вище), протягом 1 год з похитуванням при RT. Ядерне фарбування DAPI (4 ', 6-діамідино-2-феніліндол) може бути виконано одночасно на цій стадії шляхом додавання 1/5000 об'ємного вихідного розчину DAPI, який містить 5 мг/мл DAPI у H2O.
Промити 3 рази TTBS по 10 хв кожен з хитанням при кімнатній температурі.
Коротко промити в PBS.
Помістіть одну краплю реагенту проти вицвітання на покривне скло (22 мм х 50 мм) і покладіть кров’яну судину на покривне скло ендотелієм донизу.
Помістіть предметне скло (22 мм x 75 мм) на кровоносну судину, уникаючи прихоплення бульбашок.
Покладіть предметне скло на чисту лабораторну серветку (наприклад, Kimwipe) і накрийте предметне скло двома шматками лабораторної серветки. Акуратно покладіть 3,5 кг ваги (наприклад, використовуйте пляшку води на товстій книзі.) На предметне скло максимум на 5 хв, щоб зрівняти зразок кровоносної судини на обличчі.
Зніміть вагу і витріть надлишки розчину навколо покривного шару.
Нанесіть лак для нігтів на 4 кути покривного скляного шару, помістіть предметне скло в коробку для предметних стекол стороною вгору і тримайте в темряві при кімнатній температурі (або 4 ° C) на ніч. Цей процес додатково вирівнює тканину і полегшує мікроскопію при великому збільшенні.
Повністю закрийте покривне скло за допомогою лаку для нігтів.
Виконуйте мікроскопію, як тільки лак для нігтів висохне.
Якщо потрібно, зберігайте предметні стекла при -20 ° C.
Репрезентативні результати
Фігура 1: Детальна анатомія судин у шийному відділі миші. Судинна мережа до та після розсічення зображена зліва. Всі артерії визначені на схемі, показаній праворуч. Чорні лінії позначають перев’язки. Шкала: 1 поділка = 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 2: Діаграма, що показує, як з сонних артерій та аорти виготовляються препарати для обличчя. Пунктирними лініями вздовж стінки судини вказують надрізи, які слід зробити, щоб відкрити судини. На кольорових мікрофотографіях відображаються фактичні підготовки до обличчя. Шкала: 1 поділка = 1 мм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Рисунок 3: Зображення ендотелію на обличчі, забарвлене анти-VE-кадгерином (зелений) та Anti-VCAM-1 (червоний). Показаний конфокальний єдиний оптичний зріз ендотеліальних клітин поблизу міжреберного отвору. Зверніть увагу, що експресія VCAM-1 збільшується в ендотеліальних клітинах, розташованих у точці розгалуження судини, де потік крові є неламінарним. Зображення було записано за допомогою об'єктива 60X (N.A. 1.4, масло). Шкала шкали = 20 мкм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Малюнок 4: Зображення обличчя лівої та правої сонних артерій, забарвлені анти-VE-кадгерином (зелений), Anti-VCAM-1 (червоний) та DAPI (фіолетовий). Ліва сонна артерія була частково перев’язана, а права сонна залишилася цілою. Ці підготовки до обличчя проводили через 24 години після операції. Очевидна підвищена експресія VCAM-1 на перев’язаній стороні порівняно з цілим судиною. Ці зображення були зроблені поблизу роздвоєння загальних сонних артерій за допомогою конфокального мікроскопа лазерного сканування з об'єктивом 60X (N.A. 1.4, масло). Шкала шкал = 20 мкм. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
Обговорення
При роботі з судинами миші важливо пам’ятати, що ендотелій крихкий і що будь-яка надмірна механічна сила може пошкодити ендотеліальні клітини. Наприклад, ендотеліальні клітини ламаються або відриваються від стінки судини, якщо судина перфузується занадто сильно, що може легко статися, коли судинна система перфузується за допомогою ручного шприца.
Для отримання постійного перфузійного тиску ми використовуємо гравітаційну перфузійну систему з тиском водної товщини 120 см. Повідомлялося, що середній артеріальний тиск миші, який відрізняється напругою, коливається від 130 до 170 см H2O14. Таким чином, перфузійний тиск, який ми використовуємо, трохи менший, ніж виміряний артеріальний тиск. Коли ми фіксували перфузією аорту щура, застосовували тиск у колоні H2O 90 см6.
Ендотеліальні клітини in situ також пошкоджуються, якщо посудину розтягують під час збирання, очищення, поздовжнього розщеплення, імунозабарвлення та монтажу. Насправді механічні пошкодження є однією з найпоширеніших причин втрати ендотеліальних клітин в препаратах для обличчя. Розтягування судин може відбуватися на будь-якому кроці під час процедури, але найчастіше це відбувається під час збирання судини. Також легко розтягнути посудину при видаленні жирової тканини, прикріпленої до адвентиції.
Підготовка до обличчя проводиться шляхом розрізання посудини поздовжньо по всій довжині. Робиться це зазвичай за допомогою гострих офтальмологічних ножиць. Однак кінчик ножиць може бути занадто великим, якщо внутрішній діаметр судини-мішені невеликий. У такому випадку для різання можна скористатися переломом тонкого одноразового леза для бритви. Ми використовували цю техніку для виготовлення препаратів для обличчя брижової артерії курчат15.
Після фіксації препарати для обличчя проникають. Зазвичай для цієї мети використовують PBS, що містить Triton X-100, але можна використовувати інші реагенти для проникнення, такі як Tween-20, Nonidet P-40, сапонін, дигітонін та Leucomerm. В ідеалі в кожній лабораторії слід оптимізувати умови проникнення. Для аорти та сонних артерій миші ми обробляємо їх PBS, що містить 0,1% Triton X-100 протягом 10 хв при RT, і цього лікування достатньо для проникнення всіх клітин у стінку судини. Потім пермеабілізовані зразки послідовно обробляють спочатку первинним антитілом, а потім вторинним антитілом, яке флуоресцентно мічене. Для фарбування мишачих судин критично важливо, щоб первинне антитіло не вироблялося в миші, оскільки судинна тканина миші буде містити IgG миші, який буде мічений флуоресцентно міченим вторинним антимиша IgG, що спричиняє сильне фарбування фону. Для мікроскопії зразок повинен бути максимально рівним. Ми натискаємо на предметне скло протягом 5 хв з вагою 3,5 кг. Цю питому вагу визначали емпірично.
Використання препаратів для обличчя не обмежується лише візуалізацією за допомогою флуоресцентної мікроскопії. Використовуючи стереомікроскоп, препарати на судинах для обличчя можуть бути використані для вивчення ступеня утворення атеросклеротичного нальоту після фарбування їх маслом Red Red O. Препарати для обличчя на судинах можна робити асептично. Такі препарати можна зберігати в культурі та використовувати як систему ex vivo для вивчення взаємодії лейкоцитарно-ендотеліальних клітин.
Розкриття інформації
Подяка
Дослідницька діяльність авторів підтримується грантами Національного інституту охорони здоров’я доктору Абе (HL-130193, HL-123346, HL-118462, HL-108551).
- Виведення пошкоджених клітин з організму допомагає лікувати кровоносні судини діабетиків - ScienceDaily
- Коронавірус, яка маска запобігає COVID-19 Як застосовувати глиняну маску для обличчя - лікарня парафії Джексона
- Чи викликає високий кров'яний тиск збільшення ваги
- Крафт руни крові Old School RuneScape Wiki Fandom
- Здача крові здоровою або Hype Paleo Leap