Диференціальні загальногеномні моделі метилювання ДНК при дитячому ожирінні
Анотація
Об’єктивна
Вплив стресу під час вагітності може запрограмувати сприйнятливість до розвитку ожиріння у нащадків. Нашою метою було визначити, чи пов’язаний внутрішньоутробний материнський стрес (PNMS) через стихійне лихо із ожирінням дітей, та порівняти профілі метилювання ДНК у дітей із ожирінням та не з ожирінням у віці 13½ років. Жінки та їх діти були залучені до поздовжнього дослідження стихійного лиха - проекту Ice Strom, який послужив людською моделлю для вивчення PNMS. Кров відібрано у 31 дитини (у тому числі п'яти дітей, що страждають ожирінням). Для аналізів метилювання ДНК по всьому геному проведено масів BeadChip Infinium HumanMethylation450.
Результати
Результати продемонстрували чітко визначену асоційовану з ожирінням загальногеномну модель метилювання ДНК. Було 277 CpG, що відповідало 143 генам, були диференційовано метильовані. Аналізи IPA виявили 51 канонічний шлях, а збагачення шляхів було задіяно в імунній функції. Хоча між ПНМС та дитячим ожирінням значущого зв'язку не виявлено, попередні дані дослідження виявили пов'язані з ожирінням закономірності метилювання на загальногеномному рівні у дітей.
Вступ
Ожиріння - це багатофакторний стан, спричинений складною взаємодією між генетичними та екологічними факторами. Оскільки сама генетика не може повністю пояснити стрімке глобальне зростання ожиріння, епігенетичні механізми пропонуються як такі, що відіграють певну роль у його етіології [1, 2]. Вважається, що метилювання ДНК, найкраще зрозумілий епігенетичний механізм, пов'язане з розвитком ожиріння.
Оскільки внутрішньоматковий період визнаний критичним вікном розвитку, вплив стресу протягом цього періоду може запрограмувати сприйнятливість до розвитку ожиріння. Наприклад, голландське дослідження голодомору показало, що несприятливі внутрішньоутробні умови суттєво впливають на пізніше ожиріння та стан ризику метаболізму [3]. В іншому дослідженні підвищений індекс маси тіла (ІМТ) та відсоток жиру в організмі спостерігались у молодих дорослих, матері яких переживали стресові життєві події під час вагітності [4]. Крім того, втрата матері під час вагітності передбачала збільшення рівня ожиріння у нащадків [5]. Передбачуваний механізм може полягати в тому, що внутрішньоутробний материнський стрес (PNMS) індукує надлишок кортизолу, який може рано пройти плацентарний бар'єр і може запрограмувати розвиток метаболізму у плода через вісь HPA [6].
Основний текст
Метод
Учасники
Для оцінки дітей у віці 13½ років у 2011 році 36 дітей погодились надати зразок крові. Зразки ДНК від двох дітей не використовувались для аналізу метилювання ДНК через дуже низькі концентрації Т-клітинної ДНК. Ми виявили трьох жінок, у яких розвинувся гестаційний діабет, тому їхніх дітей виключили, щоб уникнути незрозумілих наслідків гестаційного діабету у матері на метилювання ДНК [10]. Для подальшого аналізу було використано 31 дитину, включаючи 5 ожирілих (4 хлопчики та 1 дівчинка) та 26 осіб, які не страждають ожирінням (14 хлопчиків та 12 дівчаток).
Об’єктивні труднощі оцінювали за допомогою опитувальника, який раніше вже був опублікований в інших роботах [11], шляхом вимірювання тяжкості штормових подій, які зазнали вагітні жінки з чотирма категоріями впливу: загроза, втрата, масштаби та зміни. Кожен вимір оцінювали за шкалою 0–8, починаючи від відсутності експозиції до високої експозиції. Загальний бал об'єктивних труднощів (Storm32) розраховували шляхом підсумовування балів за всіма чотирма вимірами за допомогою підходу Макфарлейна [12]. Суб’єктивний дистрес оцінювали за допомогою перевіреної французької версії перегляду масштабу впливу (IES-R), яка раніше була опублікована в інших роботах [13]. Ця 22-позиційна шкала, яка широко використовується для оцінки дистрессу після травматизму, описує симптоми з трьох категорій, що мають відношення до посттравматичного стресового розладу: Нав'язливі думки, Гіперароза та Уникнення. Учасники відповіли за 5-бальною шкалою Лікерта, від "Зовсім не" до "Надзвичайно", наскільки кожна поведінка описувала їх почуття протягом попередніх 7 днів.
Виміри результатів для дитини у віці 13½ років
Під час очної оцінки вимірювали зріст, вагу та талію відповідно до стандартних рекомендацій [14], повторюючи кожну міру двічі та беручи засоби. Процентилі ІМТ, залежні від статі та віку (кг/м 2), були розраховані на основі посилань Світової організації охорони здоров’я, адаптованих для канадців (http://cpeg-gcep.net/content/who-growth-charts-canada). Дітей класифікували як людей із ожирінням, якщо вони перевищували 97-й процентиль ІМТ.
Infinium HumanMethylation450 BeadChip Array
Вилучення ДНК з Т-клітин проводили за допомогою набору Wizard-Genomic-DNA-Purification-Kit (Promega) відповідно до інструкцій виробника. Масив мікросхем BeadChip Infinium HumanMethylation450 та аналіз даних були описані раніше [15].
Аналіз шляху винахідливості (IPA)
Диференціально метильовані гени класифікували за допомогою програмного забезпечення IPA. Для підрахунку збагачення гена був використаний точний тест Фішера з правою хворобою. Біологічні функції із граничним значенням p Таблиця 1 Короткий опис описової статистики учасників дослідження характеристик зразків, що не страждають ожирінням та ожирінням
Взаємозв'язок між PNMS та ожирінням дітей
Незважаючи на те, що матері дітей, що страждають ожирінням, мали більш високі об'єктивні PNMS, ніж у дітей, які не страждають ожирінням, ці відмінності були недостатньо великими, щоб вважати їх статистично значущими. Подібним чином, не було значних відмінностей у суб'єктивних PNMS між матерями дітей, що страждають ожирінням, та матерями дітей, які не страждають ожирінням (Таблиця 1).
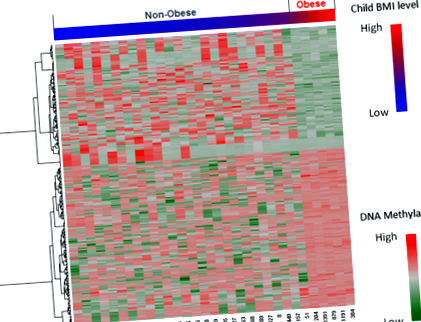
Шаблон метилювання ДНК у всьому геномі у групи із ожирінням порівняно з групою, що не страждає ожирінням
Загалом, значні групові відмінності спостерігались у 277 сайтах CpG (p Таблиця 2 10 сайтах CpG (FDR
Диференціально метильовані шляхи, пов’язані з ожирінням
На основі 143 генів, диференційовано метильованих між групами ожиріння та не ожирінням, IPA класифікував та виявив 52 канонічні шляхи (Додатковий файл 2: Таблиця S2). Біологічні функції цих шляхів переважно були задіяні в імунній системі. Шлях презентації антигену, основний шлях, включав 5 генів: NLRC5 (домен сімейної картки NLR, що містить 5), HLA-DRB1 (Основний комплекс гістосумісності, клас II, DR Beta 1), HLA-B (основний комплекс гістосумісності, клас I, B), TAP1 (транспортер 1, член підсімейства B касети, що зв'язує ATP) і HLA-DRB5 (Основний комплекс гістосумісності, клас II, DR Beta 5) які були виявлені в поточному дослідженні пов’язаними з ожирінням.
Обговорення
Вважається, що метилювання ДНК, найкраще зрозумілий епігенетичний механізм, пов'язане з розвитком ожиріння. Як розглянули Деметріу та ін. [16], дослідження ожиріння в дитячому або юнацькому віці демонструють значні зв'язки між ІМТ/ожирінням дитячого або підліткового віку та метилуванням ДНК у периферичній крові.
Наші результати продемонстрували чітко визначену асоційовану з ожирінням загальногеномну картину метилювання ДНК. Було 277 CpG, що відповідало 143 генам, які були диференційовано метильовані. Аналіз IPA виявив 51 канонічний шлях, а збагачення шляхів було задіяно в імунній функції.
Верхній CpG cg16507569 з FDR DBH) відображає ожиріння та порушення метаболізму глюкози [23,24,25].
Серед 143 диференційовано метильованих генів у цьому дослідженні, HLA набір представляє особливий інтерес. Зростають докази того, що HLA набір асоціюється з ожирінням. Наприклад, HLA-DQ Повідомлялося, що генотип збільшує ризик ожиріння серед 2–4-річних дітей із генетичним ризиком діабету 1 типу [26]. Подібним чином HLA-DQ Встановлено, що генотип асоціюється із збільшенням ІМТ у дітей із діабетом 1 типу [27]. Крім того, HLA спостерігали взаємодію генотипу зі статусом ІМТ щодо ризику розвитку розсіяного склерозу [28].
Більше того, ми виявили 52 канонічні шляхи, пов’язані з ожирінням, із 143 генів, які були диференційовано метильовані між групами ожиріння та не ожирінням. Верхній шлях був шлях до презентації антигену. Добре відомо, що основний шлях презентації антигену класу гістосумісності (MHC) класу I відіграє важливу роль у зміні імунної системи у відповідь на заражені вірусом клітини. Крім того, повідомляється, що цей шлях відіграє важливу роль у спричиненому ожирінням жировому запаленні [29]. Подібним чином цей шлях спостерігався у вісцеральній жировій тканині у чоловіків із ожирінням, що не відповідає метаболічним порушенням [30]. Цікаво, що, порівнявши нашу знахідку з останнім дослідженням, ми спостерігали 7 загальних шляхів, включаючи шлях презентації антигену, сигналізацію хвороби трансплантат проти господаря, аутоімунну сигналізацію хвороби щитовидної залози, сигналізацію Cdc42, дозрівання дендритних клітин, індуковану кальцієм апоптоз лімфоцитів Т та сигналізацію від сімейства Rho GTPases. Значне перекриття на рівні шляху між нашими висновками з Т-клітин та з жировою тканиною свідчить про те, що тканина периферичної крові має великі перспективи для подальшого застосування підписів метилювання ДНК психосоціальних впливів для визначення біомаркерів статусу метилювання.
Важливо відзначити, що шляхи, задіяні в імунній системі в цьому дослідженні, є важливими. Порушення імунних функцій описано як у людей, так і у генетично ожирених гризунів. Ожиріння асоціюється із запаленням, і адипокіни модулюють імунну функцію [31]. Отже, наш висновок про те, що імунні функції були залучені до пов’язаних із ожирінням шляхів, відповідає даним, про які повідомлялося в нашому недавньому дослідженні імунітету, в якому ми показали, що об’єктивна PNMS суттєво передбачала скорочення CD4 + лімфоцитів і збільшення TNF-α, IL-1β, та рівні IL-6, а також посилення цитокінів Th2 IL-4 та IL-13 у когорті проекту "Крижана буря" [32] з використанням тих самих відборів крові, що і для епігенетичного дослідження. Таким чином, наш висновок представляє докази, що підтверджують вирішальну і широко роль імунної системи у ожирінні.
Обмеження
(1) Невеликий обсяг вибірки лише 5 дітей із ожирінням є основною проблемою, яка обмежує значущість висновків; крім того, статеву специфічність метилювання ДНК не можна перевірити на основі такої когорти; (2) Ми не маємо доступу виявити експресію генів відповідних генів через відсутність зразків РНК; (3) Незважаючи на те, що поточне дослідження виявило пов'язані з ожирінням відмінності метилювання на загальногеномному рівні, ми не можемо зробити жодних висновків щодо того, чи є відмінності в метилюванні причиною або наслідком ожиріння; (4) Оскільки ДНК, яку аналізували, була отримана від дітей у віці 13 років, ми не можемо виключити можливість того, що незрозумілі фактори, такі як внутрішньоутробне занепокоєння матері, яке суттєво відрізнялося між групами, можуть бути відповідальними за наші результати як за показниками ожиріння, так і за ДНК рівні метилювання. Підводячи підсумок, майбутні дослідження з більшими обсягами зразків вирішують ці проблеми, і необхідне подальше дослідження, щоб краще перевірити причинно-наслідковий зв'язок між метилюванням ДНК та ожирінням.
- Хронічна депривація сну як фактор ризику метаболічного синдрому та ожиріння - Повний текст
- Вплив ожиріння на спричинене озоном запалення дихальних шляхів - Повний текст
- Вплив ліпоєвої кислоти та ейкозапентаенової кислоти (ЕПК) на ожиріння людини - Повний текст
- Порівняння програм управління ожирінням на робочому місці - Повний текст
- Оцінка довгострокової безпеки тезофензину у пацієнтів із ожирінням - Повний текст