Обмежене в часі годування викликає у дитячих мишей незворотні метаболічні порушення та зміну мікробіоти кишечника
Анотація
Передумови
Обмежений за часом режим годування (TRF), тобто відсутність споживання їжі протягом 14-16 годин протягом світлової фази на добу, послаблює риси відгодівлі та порушення обміну речовин у дорослих. Це дослідження має на меті подальше вивчення того, чи буде TRF захищати від подібних харчових проблем у неповнолітніх мишей.
Методи
Мишей в експериментальній групі лікували TRF протягом перших 4 тижнів (вважали фазою дитинства мишей) перед тим, як перейти на режим годування ad libitum (AD) як дорослі; контрольна група з усіма випробуваними дотримується режиму AD. Відстежували масу тіла і визначали біохімію сироватки крові, статеву зрілість, імунну функцію та мікробіоти кишечника у певний час.
Результати
Миші, які отримували TRF протягом дитинства (з віку відлучення), але проходили схему годівлі AD, оскільки дорослі демонстрували тенденцію до вищої маси тіла, вищих рівнів глюкози в сироватці крові, зморщених острівців Лангерганса, жирової хвороби печінки, потовщення стінок аорти, затримки статевого життя розвиток, збільшення частки Т-регуляторних клітин та нездорова мікробіота кишечника.
Висновок
Дитинство TRF викликає плейотропні побічні ефекти, включаючи важкі незворотні метаболічні порушення, пригнічену імунну функцію та відстале статеве дозрівання. Microbiota створила основу для TRF застосовувати реакції нижче за течією на вищезазначені зміни.
Вступ
Світова поширеність метаболічного синдрому значно зросла за останні десятиліття, що викликає велику загрозу як для дорослого, так і для дитячого населення. Надмірна вага, порушення гомеостазу глюкози, гіпертонія та дисліпідемія, за якими часто страждають серцево-судинні захворювання, цукровий діабет, нейродегенеративні захворювання та проблеми з фертильністю, спільно стали серйозним тягарем для всіх суспільств1 і навіть можуть призвести до затримки діагностики важких захворювань, і збільшити ризик ракових захворювань. 2 Фізичні вправи, баріатричні операції та дієтичні режими, включаючи обмеження калорій, періодичне обмеження енергії та обмежене в часі годування (TRF), є ефективними втручаннями при ожирінні та метаболічному синдромі у дорослих. 3 Крім того, голодування може зменшити ожиріння та захворювання, пов'язані з ожирінням, але може також забезпечити користь для неврологічної системи та тривалості життя. 4,5
Хоча фізіологія дітей відрізняється від дорослих, усі попередні дослідження TRF були зосереджені на дорослих. Тому наслідки TRF у дітей невідомі. Беручи до уваги унікальні фізіологічні особливості дітей, ми були надзвичайно обережними щодо екстраполяції позитивних ефектів TRF, що спостерігаються у дорослих. Поточне дослідження пропонує докази використання TRF у політиці та практиці охорони здоров’я серед дитячого населення. Подальші дослідження повинні перекласти шкідливі фізіологічні дані, що спостерігаються у мишей, на людей, що забезпечить інформацію для тих, хто формує політику, щодо відповідної дієти для молодого покоління.
Матеріали і методи
Тварини
Усі експерименти на тваринах проводились відповідно до інструкцій Інституційного комітету з догляду та використання тварин Інституту Солка. Експериментальний догляд за тваринами проводився з дозволу Комітету з питань захисту тварин лікарні Пекінського союзу медичного коледжу (дозвіл № XHDW-2015-1098). Куньмінських самців мишей (Beijing Vital River Laboratory Animal Technology Co., Ltd. (4 Yangshan Road, Beijing, China)) у віці 3 тижнів (вік відлучення) вводили в цикл 12:12 світло-темно. Втручання розпочато після акліматизації за допомогою нормальної їжі чау, доступної за бажанням (AD) протягом 1 тижня. Тиждень 0: мишам було 4 тижні (3 тижні годування груддю + 1 тиждень нормальної дієти чау для акліматизації). 4 тиждень: мишам було 8 тижнів, і режим їх годування був змінений на експериментальний метод. 4 тиждень розглядався, коли неповнолітні миші перетворилися на дорослих мишей. 8 тиждень: мишам було 12 тижнів, і основні дані результатів були зібрані та проаналізовані.
Графік годування та дієти
На 0 тижні мишей випадковим чином розподіляли на два режими годування. В експериментальній групі миші дотримувались TRF, тоді як миші контрольної групи мали доступ до їжі AD. За режимом TRF мишам дозволявся доступ до їжі між Zeitgeber-часом 13 (ZT 13) (ZT 0: ввімкнене світло; ZT 13: 1 год після вимкнення світла) та ZT 21 (3 години до включення світла).
Калорійність була необмеженою в будь-якому режимі. В обох схемах застосовували нормальний чау (стандарт GB14924.3-2010: 29% білка, 13% жиру та 58% вуглеводів) (за посиланням: LabDiet-5010). Їжу поповнювали на ZT 13 щовечора, щоб забезпечити достатню кількість їжі для кожної клітки.
Визначення експериментальної та контрольної груп: Миші TRF – AD (TA) слідували за TRF протягом перших 4 тижнів (5–8 тижнів після народження, після акліматизації), який вважався юнацьким періодом. Через 4 тижні неповнолітні переросли у дорослих мишей і їм дозволили їсти AD. Мишей AD-AD (AA) позначали контрольною групою, і всіх особин годували AD. Група TRF-TRF (TT) була змушена голодувати протягом 16-годинного періоду щодня протягом усього експерименту.
Споживання їжі та вага
Кількість їжі, споживаної для кожної клітки, зважували щодня при ZT 21, а масу тіла контролювали щотижня.
Біохімія сироватки крові
Кров отримували за ZT 21 (початок періоду голодування для TRF). Імуноферментний аналіз використовували для вимірювання концентрації сироваткового інсуліну, тригліцеридів (TG), загального холестерину (TC), ліпопротеїдів низької щільності (LDL), ліпопротеїдів високої щільності (HDL), лептину, греліну, пептиду YY (PYY), глюкагоноподібний пептид 1 (GLP-1), гонадотропін-вивільняючий гормон (GnRH), фолікулостимулюючий гормон (FSH), лютеїнізуючий гормон (LH), андроген та естроген (E). Рівні глюкози в крові вимірювали за допомогою глюкометра OneTouch Ultra при ZT 13 та ZT 21.
Гістологічне дослідження
Серце, печінку та підшлункову залозу виділяли від мишей на ZT 21 (8 тиждень) та фіксували у розчині формальдегіду. Зразки секціонували і фарбували стандартним методом фарбування гематоксилін-еозином (H&E).
Аналіз проточної цитометрії
Кількість регуляторних Т-клітин (Tregs) визначали за допомогою проточної цитометрії наступним чином: (1) цілу кров відбирали при ZT 21 у присутності антикоагулянта; (2) клітини стимулювали та інкубували при 37 ° С протягом 30 хв; (3) клітини промивали і проникали; (4) клітини ресуспендували в фарбувальному буфері при кінцевій концентрації 5–10 × 106 клітин/мл; (5) Додавали антитіла до фосфолу - кон’югований з CD4 флуоресцеїну ізотіоціанат, кон’югований з CD25 аллофікоціанін, анти-Foxp3, кон’югований з фікоеритрином, і інкубували протягом 60 хв у темряві; (6) клітини промивали, центрифугували і супернатант зливали; (7) клітини ресуспендували перед проточним цитометричним аналізом; та (7) С6 проточний цитометр (BD Accuri) був використаний для ідентифікації складу лімфоцитів.
Метагеномна екстракція ДНК та секвенування 16S рРНК
По три миші (з різних кліток) з кожної групи, що годувала, були забиті на ZT 21 (тиждень 8). Окремі миші Ceca були виділені з прямої кишки і заморожені. Потім Ceca ресуспендували та перетравлювали перед лізисом. ДНК з лізату екстрагували, осаджували, промивали та ресуспендували. Мітки послідовності генів 16S рРНК, що відповідають гіперваріативній області V1 – V3, були сформовані за допомогою платформи 454 піросеквенування. Для формування профілів даних була використана класифікація на основі оперативної таксономічної одиниці (OTU). Для загального розуміння мікробіоти були проведені аналізи різноманітності α та β, переважно для демонстрації різноманітності між групами та всередині них.
Статистичний аналіз
Дані аналізували Stata/MP 14.0. Усі нормально розподілені дані відображались як середнє значення ± s.e.m. Порівняння між двома групами проводив Student's т тест. Значення стор
Результати
Дитинство TRF викликало порушення обміну речовин
Вага тіла (Рис. 1а): Миші TA продемонстрували втрату ваги під втручанням TRF, але страждали ожирінням, коли їм дозволяли їсти AD у зрілому віці. Хоча вага групи TA, як правило, була нижчою, ніж група AA протягом перших 4 тижнів, середня вага мишей в групах TA та AA не суттєво відрізнялася (40,08 ± 0,90 проти 40,71 ± 0,68 г, стор = 0,30; n = 40). Кількість їжі, споживаної мишами в обох групах, вимірювались, проте суттєвої різниці не виявлено наприкінці 4-го тижня при порівнянні групи ТА та групи АА: 5,16 ± 0,20 проти 5,20 ± 0,18 г/день. Однак ваги мишей у групі TA зростали після 4 тижня і залишалися високими до кінця експерименту. У 8 та 14 тижні середні ваги груп TA та AA становили 47,1 ± 0,82 проти 45,0 ± 0,93 г (стор Рис. 1
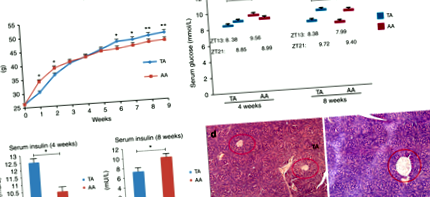
Обмін глюкози: До зміни схеми годування в групі ТА (кінець 4 тижня) середній рівень глюкози в крові для груп ТА та АА становив 8,38 ± 0,39 та 9,56 ± 0,34 ммоль/л при ZT 13 (ТА нижче, ніж АА, стор Рис.2
Концентрація ліпідів у сироватці крові та гістологічне дослідження кореня та печінки аорти. a Рівень ліпідів у сироватці крові наприкінці 8 тижня. nТА = 13, nAA = 6. b Коріння аорти, пофарбовані H & E від мишей TA та AA під збільшенням 10 × 10 (i та ii) та 10 × 20 (iii та iv). (i) та (iii): група TA; (ii) та (iv): група AA. c Репрезентативні гістологічні зрізи печінки, пофарбовані Н & Е: зліва, група TA; праворуч, група AA (збільшення 10 × 20)
Зміни травних гормонів та пептидів
(1) Лептин: На 8 тижні концентрація лептину в сироватці крові у групі ТА становила 849,48 ± 86,55 пг/мл, що було трохи вище, ніж у групі АА, 808,33 ± 124,99 пг/мл (стор = 0,263). (2) Грелін: На 4 тижні грелін в експериментальній групі був значно вищим (1325 ± 60 нг/л), ніж у контрольній групі (1053 ± 39 нг/л) (стор Рис.3
Миші TA демонстрували відсталу статеву зрілість і пригнічену імунну функцію
Статевий розвиток: 27-го дня три миші AD показали збільшені яєчка. Оскільки яєчка еліптичні, ми виміряли найбільший діаметр і визначили “збільшені яєчка” як ≥8 мм. Використовуючи цей стандарт, ми підрахували кількість мишей під TRF або AD з «розвитком яєчка» (рис. 4а). До 31-го дня всі миші мали зрілі яєчка. Миші ТА частіше мали відсталість у розвитку порівняно з групою АА. Забір крові для вимірювання статевих гормонів був проведений на 32 день, оскільки цей час дав найкращі докази статевого розвитку на основі змін розміру яєчок. Дані були дуже узгодженими: високий рівень ГнРГ, ФСГ, ЛГ та низький рівень гормонів нижче за течією, включаючи андроген та естроген, спостерігались у групі ТА (усі стор Рис.4
Трег клітини: На 8 тижні ми використовували зразки свіжої периферичної крові для вимірювання відсотка CD4 + CD25 + Foxp3 + Tregs у всіх лімфоцитах. Середній відсоток Treg (Treg%) для групи TA становив 6,78 ± 1,41% та 2,69 ± 0,31% для групи AA (n = 6, стор Рис.5
Аналіз мікробіоти кишечника на 8 тижні. a Аналіз основних компонентів (PCA) усіх предметів. b α Різноманітність груп за аналізом Шеннона (стор = 0,24). c Такса-дерево видів бактерій за групами. d 10 найкращих бактерій за категорією, класом, порядком та сімейним рівнем груп TA та AA. e Taxa-теплова карта на рівні роду кожного суб'єкта, що аналізується (n = 6)
Продовження TRF у зрілому віці не змогло скасувати існуючі порушення
Продовження TRF протягом дорослого віку не скасувало існуючих порушень мишей, які перенесли TRF протягом перших 4 тижнів. (i) Острівці Лангерганса в підшлунковій залозі були меншими із середнім радіусом, подібним до групи TA. (ii) Жирові зміни були більш серйозними порівняно з групою TA. (iii) Тверда і потовщена стінка судини кореня аорти (рис. 6а). Чотири значення результату показали суттєві відмінності: середня вага мишей ТТ була нижчою (45,5 ± 1,01 г), ніж у групі ТА (47,1 ± 0,82 г; n = 40; стор Рис.6
Показники результату мишей, які перебувають під TRF, як у дітей, так і у дорослих. a Гізологічні зрізи органів та тканин, пофарбованих H & E, у мишей TT. (i) Підшлункова залоза, червоні кола вказують на острівці Лангерганса (збільшення 10 × 10), (ii) печінку (збільшення 10 × 10) та (iii) корінь аорти, синя стрілка вказує на стінку судини (збільшення 10 × 4). b Значення ТТ порівняно з ТА на 8 тижні (крім ваги на 14 тижні). Статистичне значення позначається червоним кольором. ТТ обмежене в часі годування як для неповнолітніх, так і для дорослих
Обговорення
Це дослідження мало деякі обмеження. Як експериментальне дослідження до розслідування TRF у дітей людини, наші результати були несподіваними. Результати патологічних досліджень не були науково визначені кількісно: підшлункова залоза не була розділена за стандартизованою схемою для обчислення обсягу острівців Лангерганса, а тяжкість жирової хвороби печінки не була визначена систематичною оцінкою. Фенотипування метаболізму не проводили ретельно, а результати не повторювались належним чином через обсяг вибірки. Інший недолік полягає в тому, що рівень лептину в сироватці крові не регулювався за вмістом жиру за допомогою магнітно-резонансної томографії. 16
Висновок
Це перше дослідження TRF у дитинстві. Ми виявили, що TRF спричиняв неминучі пошкодження у мишей із порушенням обміну речовин, збільшенням серцево-судинних ризиків, пригніченою імунною функцією та затримкою статевого розвитку. Microbiota опосередковувала ці наслідки TRF у подальшому. Ці згубні наслідки та постійні наслідки свідчать про те, що TRF не слід застосовувати у дітей, але подальші механістичні дослідження потребують повного розуміння мережі дієт, мікробіоти кишечника, метаболізму та біології розвитку. Важливо нагадати органам охорони здоров’я, що настанови щодо кількості їжі та часу для дітей шкільного віку заслуговують на увагу.
- Вестернізація способу життя спричинює метаболічні розлади, пов’язані з ожирінням, у японців
- Обмежена їжа може покращити метаболічний синдром - радник з ендокринології
- Учебные карточки по модулю; Порушення обміну речовин; Вікторина
- Вестибулярні розлади Симптоми, причини та лікування
- Що таке метаболічний ацидоз Причини, симптоми, методи лікування - Інсайдер