Обмежене годування
Пов’язані терміни:
- Супрахіазматичне ядро
- Добовий ритм
- Експресія генів
- Білки
- Гризуни
- Ad Libitum годування
Завантажити у форматі PDF
Про цю сторінку
Нехтувані фактори у фармакології та дослідженнях неврології
Стан до прийому препарату
Голодування та обмежене годування призводять до прийому великої їжі, коли згодом надається доступ до їжі. Такий стан часто використовується при вимірюванні анорексигенних властивостей ліків. Однак позбавлені їжі та вільно вигодовувані щури можуть продемонструвати різницю в чутливості до анорексанції.
Введення 5-гідрокситриптофану (5-HTP) щурам викликає обмеження споживання їжі. Ефект 5-HTP у щурів із вільним вигодовуванням був більш інтенсивним і більш тривалим, ніж у тварин, позбавлених їжі (Blundell and Latham - 1979). У позбавлених їжі щурів (самці щурів з капюшоном, 280–320 г, 18 год. Позбавлення їжі) i.p. ін'єкція 5-HTP (30 мг/кг), після попередньої обробки інгібітором декарбоксилази периферичної дії карбідопою (50 мг/кг внутрішньовенно), зменшила середнє споживання їжі протягом 24 годин з 36,8 до 35,1 г; незначне зниження на 5%. Однак у тварини на вільному вигодовуванні (самці щурів з капюшоном, 330–380 г) однакова обробка на початку темної фази циклу зменшила середнє споживання їжі за 24 години з 29,2 г до 19,1 г, зменшення на 35% . Ефект 5-HTP був головним чином на розмір їжі і був очевидним протягом повних 24 годин (розмір їжі 0–24 год: контрольна група 2,2 г, група 5-HTP 1,6 г).
На відміну від цього, анорексигенний ефект d-амфетаміну у мишей, що вільно годують, менший, ніж у мишей з обмеженим доступом до їжі („голодні” миші) (Dobrzanski and Doggett - 1976). Дози d-амфетаміну, необхідні для значного зменшення споживання їжі у мишей, що вільно годували, були “вдвічі більшими, ніж необхідні для виникнення подібної депресії у голодуючих тварин” (таблиця 12.9) (миші-самці, штам CFLP-ICI 1, 20–25 г, D-фаза 21.00–9.00 год., Розміщений у групах по 8 тварин. Голодні миші пристосовані для годівлі між 12.00 та 15.00 год. Щоденно. Вимірювання споживання їжі між 24.00 та 2.00 год для вільного годування тварин та між 12.00 та 14.00 год для голодуючих тварин. d-амфетамін sc, 5 мл/кг за 15 хв до 2-годинного періоду тестування).
Таблиця 12.9. Анорексигенний ефект d-амфетаміну у мишей із вільним вигодовуванням та мишей, яких годували протягом тригодинного періоду годування
| 0,25 | 87 | 103 |
| 0,50 | 111 | 92 |
| 1.0 | 97 | 70 * |
| 2.0 | 43 * | 50 ** |
| 4.0 | 21 * | 20 ** |
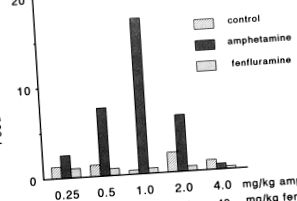
На відміну від загальновживаної класифікації як стандартної анорексигенної сполуки d-амфетамін може за певних умов спричинити збільшення споживання їжі. d-амфетамін (0,5–2,0 мг/кг) помітно збільшив незначне споживання їжі ситими мишами, що вільно годували, протягом L-періоду (рис. 12.11) (Добржанський та Доггетт - 1976). Контрольна ін’єкція фізіологічного розчину не провокувала у цих тварин їжу, спричинену стресом. Фенфлурамін у дозах від 2,5 до 40 мг/кг с. не впливало на годування цих мишей.
Рис. 12.11. Вплив амфетаміну та фенфлураміну на прийом їжі мишами, що годують безкоштовно, між 12.00 та 14.00 год у L-періоді.
(адаптовано за Dobrzanski, S., and Doggett, N.S .: Psychopharmacol. 48, 283–286, 1976)
Подібно амфетаміну, кофеїн (10–40 мг/кг) також спричиняв помітне збільшення споживання їжі у ситих тварин, хоча препарат не впливав на споживання їжі ні голодуючими мишами, ні тваринами, що вільно годувались в умовах тесту. описані вище. Аналогічно циркадній або залежній від насичення орексигенно-анорексигенною дією амфетаміну, такий ефект повідомляється про апоморфін у щурів (Eichler and Antelman - 1977) .
Морфін зменшив споживання їжі та води у щурів, позбавлених їжі протягом 24 годин. На відміну від цього, морфін збільшував рівень споживання їжі (і води) у неблагополучних тварин (рис. 12.12) (Sanger and McCarthy - 1980) (щури Спрег-Доулі; самці; 180–200 г; період L 8.00–18.00 год.; вільне годування або позбавлення їжі протягом 24 год; сульфат морфію 1–30 мг/кг; споживання їжі, виміряне в L-періоді безпосередньо після ін’єкції препарату: 10.00–16.00 год).
Рис.12.12. Вплив морфіну на сукупний прийом їжі у бездоглядних та насичених щурів.
(адаптовано за Sanger, D.J., and McCarthy, P.S .: Psychopharmacol. 72, 103–106, 1980)
Харчування лабораторної миші
Мерел Ріцкес-Хойтінга,. Ларс Фрііс Міккельсен, у лабораторній миші (друге видання), 2012
Годування за умови обмеженого харчування проти обмеження їжі
Порівнюючи дозвільне годування з обмеженням їжі, стає зрозумілим, що годування довільним способом негативно впливає на здоров’я гризунів. Харчування ad libitum призведе до збільшення ожиріння, коротшого часу виживання, збільшення дегенеративних захворювань нирок та серця, коротшого часу латентності та більшої захворюваності на рак порівняно з обмеженим годуванням [67]. У таблиці 4.3.7 наведено порівняння між лібітами та мишами B6C3F1 з обмеженим вмістом їжі, які служили контрольними групами у дослідженнях довгострокової токсичності [67]. Обмеження їжі дало знижену масу тіла в порівнянні з годуванням ad libitum, а також зменшило частоту пухлин печінки у обох статей, зменшило частоту пухлин легенів у чоловіків та зменшило злоякісні лімфоми у жінок. Обмеження їжі призвело до зменшення часу виживання, особливо у жінок. Недавній мета-аналіз показав, що миші в контрольних групах за Національною програмою токсикології продемонстрували 11,8% збільшення маси тіла на десятиліття з 1982 по 2003 рік у самок. У самців мишей спостерігалося збільшення маси тіла на 10,5% за десятиліття [71] .
ТАБЛИЦЯ 4.3.7. Деякі результати контрольних груп мишей B6C3F1 за графіком ad libitum або обмеженням їжі
| Пухлини печінки (%) | 54 | 22 ∗∗ | 45 | 8 ∗∗ |
| Пухлини легенів (%) | 28 | 17 ∗ | 2 | 12 |
| Злоякісна лімфома (%) | 9 | 8 | 16 | 4 ∗ |
| Гемангіо (сарко) ма (%) | 5 | 2 | 8 | 2 |
| Виживання (%) | 80 | 88 | 65 | 94 ∗∗ |
AL, ad libitum; FR, обмеження їжі.
Було проведено велике та складне дослідження щодо впливу складу раціону та споживання їжі на щурах. Значні ефекти зменшення дієти (зниження на 20%) були виявлені на тривалість життя, розвиток дегенеративних захворювань та новоутворення у щурів Wistar [72]. Подібні ефекти можна очікувати на мишей.
Рівень поживних речовин у дієтах з натуральними інгредієнтами набагато перевищує рівні, необхідні для задоволення потреб у поживних речовинах [5]. Виробники роблять це для того, щоб гарантувати відсутність недоліків навіть після тривалого зберігання. Більше того, вимоги NRC підтримують максимальне зростання. Тому обмеження споживання їжі до 75% від споживання лібіту все одно забезпечить, щоб дієта відповідала мінімальним рівням необхідних поживних речовин.
Нехтувані фактори у фармакології та дослідженнях неврології
У ряді експериментальних умов необхідно або вважати корисним утримувати тварин за обмеженим графіком годівлі. Наприклад
вплив наркотиків на харчову поведінку часто вивчається у тварин з обмеженим споживанням їжі,
в оперантних поведінкових дослідженнях часто використовується депривація їжі. Скорочені режими годування застосовуються при вивченні впливу наркотиків на підсилену їжею поведінку, що підтримується за графіком, у дослідженнях наркотиків як дискримінаційних стимулів та в дослідженнях самовведення.,
в токсикологічних експериментах інтерпретація біологічних змін може стати ускладненою, оскільки індуковане порушення харчування також спричиняє модуляцію фізіологічних та біохімічних функцій організму. Іноді намагаються обійти цю проблему, використовуючи контрольні групи при парному годуванні.
Основи для з’ясування причин та наслідків недоїдання при нервовій анорексії
Соціальний стрес + дієта
Модель анорексії, що базується на розлуці (SBA), поєднує в собі хронічний (до 10 тижнів) стрес соціальної розлуки з обмеженим харчуванням самок у пізньому підлітковому віці (7 тижнів) (van Leeuwen, Bonne, Avraham, & Berry, 1997). Ця парадигма забезпечує поведінку, подібну до депресії, і втрату маси тіла на 25–40%. Модель SBA також демонструє багато нейроендокринних адаптацій, які пов'язані зі зниженим вагою та станом АН, включаючи зниження рівня лептину в сироватці крові, стійкість до гормону росту, зниження маси кісткової тканини, зниження частоти естро і підвищений тонус осі HPA (Zgheib et al., 2014). Багато з цих фенотипів можна пояснити переважною втратою жирової маси у мишей SBA порівняно з контролем, що відповідає калоріям. Ця модель не може бути використана для вивчення механізмів, відповідальних за анорексичну поведінку, оскільки знижена маса тіла може спостерігатися за відсутності змін у споживанні їжі (Zgheib et al., 2014).
Дрібні шкідники
5.5 Резюме
Листоногі клопи належать до сімейства Coreidae. Як незрілі, так і дорослі помилки можуть пошкодити помідори, при цьому маленькі німфи харчуються лише епідермальними шарами, тоді як дорослі можуть проникати вглиб фруктів. Після вилуплення німфи живляться стаціонарно, поширюючись по всій рослині пізніше. Зрілі німфи та дорослі є більш шкідливими стадіями. У заражених помідорів прориви плодів є загальним симптомом нападу клопів на листоногих, і це призводить до зміни кольору плодів під час дозрівання. Пошкодження листоногими клопами, як правило, не викликає великих економічних проблем, але якщо велика кількість нападає на кілька рослин, шкода може призвести до економічних втрат. Зазвичай використання інсектицидів широкого спектра дії для інших сисних комах призвело до адекватної боротьби з клопами з листоногими. Однак, коли популяція шкідників перевищує пороговий рівень, для ефективного боротьби з цими помилками слід застосовувати різноманітні методи. Встановлено, що інсектициди з різних хімічних груп є дуже ефективними в боротьбі із зараженням клопів, що переносять листя.
Змінений циркадний енергетичний метаболізм та хронобіологічні фактори ризику хронічних захворювань
30.6 Циркадні ритми та обмін речовин
Кілька досліджень проливають світло на зв'язок між циркадною системою та метаболізмом, враховуючи корисні наслідки обмеженого у часі годування. В одному дослідженні [51] мутація гена циркадних годинників Per1, який впливає на збережене місце фосфорилювання, змусила мишей споживати більше їжі під час відпочинку, схиляючи їх до метаболічних захворювань. Інше дослідження [52] показало, що режим годування мишей, які харчуються дієтою з високим вмістом жиру, змінюється, і миші споживають невелику кількість їжі протягом цілодобового дня, в тому числі протягом звичайного періоду відпочинку. Ще одне дослідження [53] показало, що обмежуючи доступ до дієти з високим вмістом жиру лише протягом ночі (активний проміжок часу) можна запобігти як ожиріння, спричинене дієтою, так і ожиріння у мишей-мутантів Per1. Ці результати підтверджують ранній висновок Гальберга [11,12,14], що час прийому їжі може служити ефективним клінічним втручанням, що в подальшому підтверджується додатковими недавніми дослідженнями на людях, які показують, що більш ранні терміни прийому їжі пов'язані з поліпшенням ефективності терапії для зниження ваги при пацієнти з ожирінням [54,55] .
Якими б важливими не були циркадні ритми, вони представляють лише один періодичний компонент у широкій часовій структурі, який становить життя. Необхідність розгляду ширшої часової структури в цілому ілюструється роллю впливу Bmal1 на тривалість життя. Повідомлялося, що терміни експресії основного тактового гена Bmal1 впливають на його вплив на старіння та виживання [56]. У той час як пренатальна делеція Bmal1 у мишей порушує годинниково-залежну експресію осциляторних генів і поведінкову ритмічність, що збігається зі зниженою масою тіла, порушенням росту волосся, аномальним кальцинозом кісток, патологіями очей, нейродегенерацією та скороченим періодом життя, миші, у яких ген вибитий після народження не проявляють багато з цих фенотипів, пов'язаних зі старінням, що свідчить про те, що ген циркадних годинників відіграє різні ролі під час ембріогенезу та після народження [56] .
Гіпотеза балансу кортикостероїдних рецепторів
Передбачення
На передбачення майбутніх стресових подій впливає CORT, як це демонструє поведінка, зумовлена графіком. Це відбувається, коли щурам пропонують обмежене годування в певний день. Наприклад, якщо щури отримують о 16.00 год лише 80% щоденної потреби в їжі, тварини виявляють підвищене збудження та значно посилену активацію осі HPA в очікуванні їжі. Збудження та активність осі HPA стрімко падають, коли їжа подається. Тварини також демонструють поведінку переміщення через надмірний біг на колесі або полідипсію в очікуванні їжі. Адреналектомія перешкоджає нормальному придбанню такої поведінки, обумовленої графіком, хоча вона може бути відновлена за допомогою CORT, але не заміною дексаметазону. Оскільки сам дексаметазон неактивний, активація МРТ CORT представляється необхідною умовою. 22
Обладнання для годівлі
14.3 Автоматичне годування вимагає введення - концепції годування
Існує кілька способів годувати рибу, що впливає на систему годівлі та способи її використання. Годування можна розділити на обмежене годування або згодовування. Годувати ad libitum означає постійне постачання корму, щоб уся риба завжди мала вільний доступ до корму. Це призведе до збільшення ФКР. Зазвичай використовується для личинок та на ранніх стадіях розвитку, коли швидкість зустрічі їжі та виживання повинні бути оптимізовані (див. Розділ про личинні корми). Що стосується інших стадій виробництва, годування за згодою нечасто, але це може бути зроблено в особливих випадках. Наприклад, після транспортування риби або коли риба потрапляє в нове середовище, може використовуватися додаткове годування для забезпечення того, що риба починає їсти. Застосовуючи самогонниці (описані далі), теоретично риба буде мати доступ до кормів у будь-який час, і таким чином це буде видом довільної годівлі. Однак риба повинна докласти певних зусиль, щоб отримати корм. Навіть у таких випадках загальноприйнятим є більш високий рівень FCR порівняно з обмеженим годуванням.
Щоб мати змогу обмежити годування, потрібно або знати кількість корму, що доставляється до групи риб, або повинен бути якийсь тип зворотного зв’язку, щоб знати, коли більшість риб у групі в будь-який момент часу перегодовані. При ручному годуванні виконується останній пункт, оскільки спостерігається поведінка риби. Для цього також можуть використовуватися електронні пристрої (описані далі). При переході від ручного годування до чистого автоматичного, без будь-якого зворотного зв’язку, буде потрібно знати, скільки корму потрібно подавати рибі протягом певного періоду, як правило, на день. Для цього зазвичай використовуються столи для годування для обмеженого годування.
Клінічна патологія щура
Брюс Д. Кар,. Деніз І. Баунус, у лабораторній щурі (друге видання), 2006
F. Хвороби серцевих та скелетних м’язів
Захворювання, яке називається кардіоміопатією у самців щурів SD (вогнищеве запалення з вогнищевою дегенерацією волокон), є відносно поширеним природним захворюванням, хоча обмежене годування зменшує частоту його старіння у тварин (Van Vleet and Ferrans, 1986; Keenan et al., 1997). Однак пошкодження серця ксенобіотиками досить рідкісне явище. Індукований антрацикліном (наприклад, адріаміцин) некроз міокарда та активований проліфераторами пероксисоми рецептор-гамма (PPARγ), спричинений агоністами, кардіоміопатія епітомізують ефекти, пов’язані із сполуками. Хоча індукована адріаміцином патологія передбачає серцеву патологію людини, кардіоміопатія агоністів PPARγ, як видається, специфічна для щурів. У щурів також розвивається важка запальна кардіоміопатія після введення трийодтироніну; однак цей синдром на відміну від гіпертрофічної кардіоміопатії, що спостерігається у гіпертиреоїдних котів. Щури довели, що є цінним видом для розвитку серцевих біомаркерів.
Ураження скелетних м’язів спостерігаються у щурів, які отримують високі дози інгібіторів HMG CoA-редуктази (наприклад, церивастатин), але це порівняно незвичне відкриття в дослідженнях токсичності або природних захворювань щурів.
Після травми скелетного або серцевого м’яза активність АСТ у сироватці крові та креатинінкінази (КК) зростають. Якщо ALT і SDH - два ферменти, більш специфічні для захворювання печінки - знаходяться в межах своїх контрольних інтервалів, слід запідозрити травмування скелета або серцевого м’яза. На відміну від ситуації у людей та вищих домашніх видів, аналіз ізоферментів СК та лактатдегідрогенази (ЛДГ), як правило, не є корисним для конкретної діагностики або оцінки серцевої патології у щурів. Однак, як повідомляється, концентрації тропоніну-Т, виміряні імуноферментним аналізом (ELISA) у плазмі крові, є відносно специфічними для пошкодження серця у щурів (O'Brien et al., 1997; Bertsch et al., 1999). Тропонін-Т приймається контролюючими органами як чутливий сурогат при пошкодженні серцевого м’яза. Незважаючи на те, що в даний час доступні кілька платформ для аналізу тропоніну, жодна з них не була оптимально кваліфікована для щурів та визнана регуляторними органами. Отже, визначення цього аналіту в даний час найкраще застосовувати як тест другого рівня, а не як скринінговий тест на кардіотоксичність для щурів, якщо не було проведено ретельної перевірки концентрацій у сироватці крові та серцевої гістопатології для серії сполук.
Циркадні метаболічні ритми, регульовані супрахіазматичним ядром
Метаболічні ритми без SCN; Вживання їжі
Для того, щоб підійти до явищ внутрішньої десинхронізації, що виникають внаслідок реактивного відставання, змінної роботи або нічної діяльності, важливо мати на увазі, що їжа може чинити потужний вплив як привабливий сигнал для периферичних органів та обмінних процесів. До таких циркадних розладів можна підходити, чітко контролюючи графіки годування, щоб перенести метаболічні ритми на очікувані фази. Крім того, залишається встановити, чи можуть неорганізовані графіки годування бути пов’язані з проблемами обміну речовин через від’єднання периферичних осциляторів від SCN.
- Пастернак - огляд тем ScienceDirect
- Пролактинома - огляд тем ScienceDirect
- Мононенасичені жири - огляд тем ScienceDirect
- Білок PDZ - огляд тем ScienceDirect
- Нестача харчування - огляд тем ScienceDirect